
AVALIAÇÃO DA QUALIDADE DE ÓLEOS DE SOJA (Glycine max L.), GIRASSOL (Helianthus annus L.) E COCO (Cocos nucifera L.) SOB AQUECIMENTO
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Andressa Alves Pinheiro1; Débora Maria Moreno Luzia2; Neuza Jorge3*
1Mestre em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Docente do Curso de Tecnologia de Alimentos, Universidade do Estado de Minas Gerais – UEMG.
3Docente do Depto de Engenharia e Tecnologia de Alimentos, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected].
Resumo: Os óleos de soja e girassol são predominantemente poli e monoinsaturados, o que os tornam mais instáveis sob elevadas temperaturas e susceptíveis à oxidação. Por outro lado, o óleo de coco, saturado, tem menor potencial para oxidação e possui elevada estabilidade oxidativa. Óleos compostos podem ser altamente benéficos e servirem como alternativas para consumidores e indústria alimentícia. O objetivo do presente trabalho foi avaliar os óleos vegetais quanto às propriedades físico-químicas e ao teor de tocoferóis quando submetidos a altas temperaturas. Os óleos de soja (S), girassol (G), coco (C) e os compostos soja:coco (SC – 75:25, v/v) e girassol:coco (GC – 75:25, v/v) foram submetidos ao aquecimento a 180oC por 15 horas, cujas amostras foram avaliadas em diferentes intervalos de tempo (0, 5, 10 e 15 horas). Na avaliação da qualidade, foi possível observar que o óleo de coco apresentou menor degradação em relação aos demais. Quanto aos óleos compostos, pode-se destacar o GC como o mais eficiente em inibir a oxidação, devido ao menor nível de ácidos graxos poli-insaturados. Na termoxidação, SC e GC quando comparados a S e G, conseguiram minimizar os índices de compostos primários e secundários de degradação, além de reduzir em 40% a formação de compostos polares totais. Ao comparar os óleos compostos, o SC apresentou maior teor de tocoferóis totais, enquanto o GC obteve maior quantidade de vitamina E, maior estabilidade oxidativa e menor degradação. Portanto, é viável a aplicação de óleos compostos como SC e GC em processos que envolvam elevadas temperaturas.
Palavras-chave: estabilidade oxidativa; soja; girassol; coco; termoxidação
INTRODUÇÃO
A produção de óleos vegetais é cada vez maior devido ao aumento do consumo, uma vez que, grande parte da população tem usado estes óleos como substituto das gorduras animais. Os óleos vegetais são produtos de grande importância para a dieta humana, pois os ácidos graxos que os constituem, contribuem para o funcionamento do metabolismo e quando consumidos de maneira adequada são importantes para prevenção de doenças degenerativas e comprometimento dos órgãos vitais (SAVVA; KAFATOS, 2016).
No âmbito industrial, os óleos vegetais são largamente empregados na preparação de alimentos e rações animais, desenvolvimento de novos produtos, fabricação de biodiesel, entre outros. Entretanto, quando utilizados em elevadas temperaturas, podem se degradar e, consequentemente, formar compostos tóxicos à saúde humana, além de prejudicarem a qualidade sensorial do produto (XIE et al., 2019). Desse modo, surgiram os óleos compostos que são formados a partir da mistura de dois ou mais tipos de óleos que podem aumentar a estabilidade oxidativa e contribuir para melhorar suas características físico-químicas (O’BRIEN, 2008). Além disso, a mistura dos óleos pode contribuir com uma provável melhoria na qualidade nutricional, uma vez que mais compostos bioativos poderão estar presentes.
O óleo de soja é constituído majoritariamente por ácidos graxos insaturados como o linoleico, que é um ácido graxo essencial, fundamental para o funcionamento do organismo (MIYOSHI et al., 2011). Os ácidos graxos poli-insaturados (ω3 e ω6) presentes no óleo de soja são altamente benéficos para a saúde, pois podem reduzir os níveis de colesterol e LDLc presentes no sangue e neutralizar os níveis da proteína da hepatite C no metabolismo lipídico (SUÁREZ-MAHECHA et al., 2002; MIYOSHI et al., 2011). Outros compostos minoritários, porém, importantes que estão presentes no óleo de soja são os fitosteróis (β-sitosterol, campesterol e estigmasterol) (CODEX, 2015). Entretanto, o óleo apresenta baixa estabilidade oxidativa devido à presença de ácidos graxos poli-insturados que fazem com que seja instável e oxide rapidamente em processos térmicos (GUNSTONE, 2011).
O óleo de girassol médio oleico quando comparado a outros óleos vegetais, apresenta elevadas estabilidades oxidativa e térmica devido à grande quantidade de ácido oleico (SEILER; GULYA, 2016). Outros componentes minoritários presentes são campesterol, β-sitosterol, α-tocoferol, β-tocoferol, etc. (CODEX, 2015). Embora o óleo de girassol médio oleico apresente de 42 a 72% de ácido oleico, que auxilia na redução do risco das doenças cardíacas, por diminuir as lipoproteínas de colesterol de baixa densidade (LDLc) e aumentar as lipoproteínas de alta densidade (HDLc) (MAHAN; SCOTT-STUMP, 2010), pode também ser facilmente oxidado em altas temperaturas.
A utilização do óleo de coco tem aumentado devido aos possíveis efeitos na saúde e maior estabilidade oxidativa, ocasionada principalmente pelos ácidos graxos saturados de cadeia média. De acordo com Nitbani et al. (2016), o óleo de coco tem praticamente 50% do ácido graxo láurico (C12:0), que é rapidamente hidrolisado por lipases, além de ser facilmente transportado para o fígado e convertido em energia ou corpos cetônicos, tornando-o facilmente digerido (DAYRIT, 2015; RIBEIRO, 2017). Esta presença faz com que o óleo de coco seja mais estável em processos térmicos, contribuindo assim, para melhor conservação das características físico-químicas e sensoriais dos produtos.
Segundo o Indian Council of Medical Research (ICMR, 1989) e a American Heart Association (LaRosa et al., 1990), sob o ponto de vista nutricional para a manutenção de uma dieta equilibrada, a melhor proporção a ser consumida diariamente de ácidos graxos saturados, monoinsaturados e poli-insaturados é de aproximadamente 1:1:1.
O processo oxidativo de óleos e gorduras é responsável pela degradação dos ácidos graxos que alteram as características sensoriais dos produtos, além de degradar compostos minoritários como as vitaminas e ácidos graxos essenciais, e formar compostos tóxicos ao organismo humano (SILVA; BORGES; FERREIRA, 1999). Tais circunstâncias explicam a importância de conduzir estudos sobre óleos vegetais mais estáveis quando submetidos à elevadas temperaturas, porém que também forneçam benefícios à saúde humana ao serem consumidos.
MATERIAL E MÉTODOS
Material
Os óleos de soja (S) e girassol médio oleico (G) refinados sem adição de antioxidantes sintéticos e o de coco (C) extra virgem, prensado a frio, foram adquiridos no comércio local de São José do Rio Preto-SP. Para definir a formulação dos óleos compostos foi realizado teste preliminar com a intenção de se obter a proporção aproximada de 1:1:1 de ácidos graxos saturados, monoinsaturado e poli-insaturados, respectivamente. Os óleos S, G e C foram utilizados na proporção de 100, enquanto S:C e G:C na proporção 75:25 v/v.
Termoxidação
Os óleos foram submetidos à termoxidação de modo descontínuo, conduzida em chapa aquecida a 180 ± 5ºC com 0,4/cm de superfície/volume. Amostras foram tomadas em 0, 5, 10 e 15 horas de aquecimento, armazenadas em frascos de vidro âmbar, inertizadas com nitrogênio gasoso e acondicionadas à temperatura de -18ºC até o momento das análises.
Métodos
Para as determinações dos índices de peróxidos, ρ-anisidina e ácidos dienoicos conjugados foram utilizados os métodos oficiais da AOCS (2009), cujos resultados foram expressos em meq/kg para peróxidos e em porcentagem para dienos conjugados. O valor total de oxidação foi calculado por meio da equação: Totox = 2 (IP) + (IρA) (SHAHIDI, 2005). Os compostos polares totais foram analisados por meio do método cromatográfico proposto por Dobarganes, Velasco e Dieffenbacher (2000) e expressos em porcentagem. A estabilidade oxidativa foi determinada segundo a AOCS (2009) utilizando o instrumento Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland) a 110°C, com fluxo de ar de 20 L/h, expressa em horas.
A preparação dos ésteres metílicos de ácidos graxos foi realizada conforme adaptação do método descrito por Hartman e Lago (1973) em uma micro-escala e o perfil de ácidos graxos foi determinado de acordo com o método AOCS Ce 1-62 (2009) por cromatografia de gás capilar-CGC, usando um Agilent série 6850 CG, sistema equipado com coluna capilar de 60 m Agilent DB-23 (50% cianopropil-metilpolisiloxano), com diâmetro interno de 0,25 mm e 0,25 µm de espessura do filme. As condições cromatográficas foram as seguintes: fluxo da coluna = 1,0 mL/min.; velocidade linear 24 cm/s; temperatura do detector 280ºC; temperatura do injetor 250ºC; temperatura do forno a 110ºC por 5 min, aumentando de 110 a 215ºC a 5ºC/min, seguido por 215ºC durante 34 min.; sendo o gás de arraste o hélio; volume injetado 1,0 µL; split 1:50. Os ácidos graxos foram identificados pela comparação entre os tempos de retenção de padrões puros de ésteres metílicos com os componentes separados das amostras e a análise qualitativa foi feita por normalização de área. Utilizou-se como padrão uma mistura composta por 37 ésteres de ácidos graxos (Supelco) de C4:0 a C24:1, com grau de pureza entre 99,1 e 99,0%. A quantidade de cada ácido graxo foi expressa em porcentagem (%).
Os teores de tocoferóis foram determinados pelo método Ce 8-89 da AOCS (2009). A análise foi realizada em cromatógrafo líquido de alta eficiência (modelo 210-263, Varian, Walnut Creek, CA, Estados Unidos), com detector de fluorescência, coluna de aço inox empacotada com sílica (100 Si, Microsorb, Varian, Walnut Creek, CA, Estados Unidos) e comprimento de onda de excitação em 290 nm e de emissão em 330 nm. Os valores das concentrações foram calculados em base da área dos picos de excitação da leitura e expressos em valores de cada isômero separadamente. Uma curva padrão de α-, β-, γ- e δ-tocoferol (Supelco, Bellefonte, Estados Unidos) com elevado grau de pureza foi elaborada para expressar o teor de tocoferóis em mg/kg. O teor de vitamina E foi calculado conforme método descrito por McLaughlin e Weihrauch (1979), sendo os fatores de conversão os seguintes: α-tocoferol x 1,0; β-tocoferol x 0,40; γ-tocoferol x 0,10 e δ-tocoferol x 0,01, e o resultado expresso como equivalentes de α-tocoferol (mg/kg).
Análise estatística
O ensaio experimental foi realizado no delineamento inteiramente casualizado em esquema fatorial (tratamentos x tempos). Os resultados obtidos das determinações analíticas para os tratamentos foram submetidos à análise de variância e as diferenças entre as médias testadas a 5% de probabilidade pelo teste de Tukey, por meio do programa ESTAT, versão 2.0 (BANZATTO; KRONKA, 2006).
RESULTADOS E DISCUSSÃO
Propriedades físico-químicas
Na Tabela 1, observa-se que o óleo de soja apresentou maior valor de ácidos dienoicos conjugados com 0,3%, enquanto os óleos compostos, SC e GC, atingiram menores valores, 0,2% devido à influência do óleo de coco (0,1%).
O valor máximo de peróxidos permitido para óleos refinados e virgens ou prensados a frio é de 10 e 15 meq/kg, respectivamente (CODEX, 2015). Os óleos estudados apresentaram valores bem abaixo do que preconiza a legislação, além disso, o óleo de coco mostrou o menor valor, 0,8 meq/kg, devido à sua composição majoritária de ácidos graxos saturados de cadeia média que favorecem a estabilidade oxidativa. Entretanto, ao comparar os óleos compostos, verificou-se que o SC mostrou maior valor, 1,7 meq/kg, devido ao efeito sinergístico entre óleos de soja e coco ter sido maior do que o ocasionado entre girassol e coco.
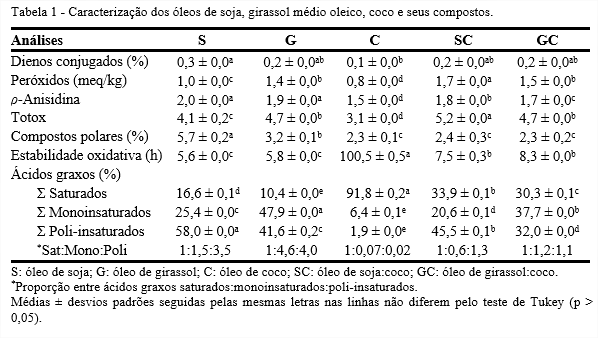
O óleo de coco apresentou o menor índice de ρ-anisidina com 1,5, seguido pelos compostos GC (1,7) e SC (1,8). Pode-se observar que os óleos compostos apresentaram menor degradação que os óleos de soja e girassol, embora todos se encontraram dentro do limite máximo, que é 10, para um óleo ser considerado de boa qualidade (GUILLÉN; CABO, 2002).
Segundo Berset e Culivier (1996), uma matéria graxa bem conservada, apresenta valor totox inferior a 10. Os menores valores encontrados são referentes aos óleos de coco e soja, 3,1 e 4,1, respectivamente. Comparando os óleos compostos SC e GC, pode-se afirmar que embora tenham se diferenciado estatisticamente, apresentaram resultados satisfatórios dentro do limite estipulado.
Inicialmente, os óleos C, SC e GC não se diferenciaram estatisticamente e obtiveram resultados inferiores a 2,4% de compostos polares. Entretanto, o óleo de soja apresentou maior valor de degradação com 5,7%, por ser o óleo mais insaturado, ou seja, mais susceptível a deterioração.
O óleo de coco, composto majoritariamente por ácidos graxos saturados, atingiu o maior índice de estabilidade oxidativa, chegando a um período de indução de 100 h, enquanto soja e girassol atingiram 5 h. Por outro lado, os óleos compostos não se diferenciaram estatisticamente e obtiveram valores entre 7 e 8 h de estabilidade, ou seja, em média 2,5 h a mais que seus óleos puros, demonstrando a influência benéfica do óleo de coco na estabilidade e a validação da formulação dos óleos compostos.
A composição em ácidos graxos dos óleos vegetais pode ser determinada de acordo com sua quantidade de saturados, monoinsaturados ou poli-insaturados, indicando assim, a diferença entre eles. O S é o mais poli-insaturado com 58%, compostos por ácidos graxos que auxiliam no combate a diversas doenças, apresentando proporção entre saturados, monoinsaturados e poli-insaturados (sat:mono:poli) de 1:1,5:3,5.
O óleo de girassol médio oleico tem como constituinte majoritário o ácido oleico, sendo predominantemente monoinsaturado, o que confere maior estabilidade oxidativa quando comparado com o óleo de soja. Apresenta a proporção de sat:mono:poli de 1:4,6:4,0.
O óleo de coco possui aproximadamente 92% de ácidos graxos saturados e é constituído majoritariamente pelo ácido láurico (47,6%). Por ser altamente saturado, esse óleo é mais estável do que soja e girassol quando exposto a altas temperaturas. Sua proporção sat:mono:poli é 1:0,07:0,02.
O óleo SC é constituído em sua maior parte por ácidos graxos poli-insaturados (45,5%). Embora o SC seja majoritariamente poli-insaturado foi menos oxidado que o S, apresentando proporção sat:mono:poli de 1:0,6:1,3.
O composto GC é constituído em maior parte por ácidos monoinsaturados (37,7%). Quando comparado ao G possui menor quantidade de poli-insaturados e maior de monoinsaturados, portanto, é mais estável termicamente. A proporção sat:mono:poli é de 1:1,2:1,1, sendo o GC o óleo que mais se aproximou da proporção recomendada pelo Indian Council of Medical Research (ICMR, 1989) e American Heart Association (LaROSA et al., 1990).
Termoxidação
Observa-se na Figura 1a, que os ácidos dienóicos conjugados apresentaram aumento ao longo do tempo de aquecimento para os óleos estudados. Os óleos compostos obtiveram menores índices de ácidos dienóicos, quando comparados aos óleos de soja e girassol, demonstrando o efeito sinergístico da composição. A partir de 10 horas de termoxidação houve aumento significativo na formação de ácidos dienóicos conjugados com os menores valores para C e GC que conseguiram evitar a degradação em 18 e 4,5%, respectivamente, quando comparados aos óleos de soja e girassol. O óleo de soja obteve maior formação de ácidos dienoicos conjugados, atingindo 3%. O óleo composto GC obteve menores valores que o SC, provavelmente, por ser menos insaturado.
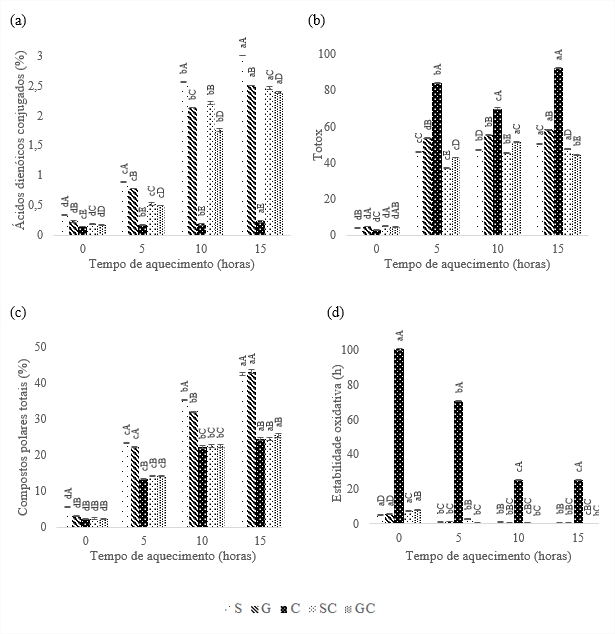
Para cada tempo, médias seguidas pelas mesmas letras maiúsculas não diferem pelo teste de Tukey (p > 0,05).
Para cada óleo, médias seguidas pelas mesmas letras minúsculas não diferem pelo teste de Tukey (p > 0,05).
Os óleos apresentaram seus valores totox aumentados, conforme o tempo de aquecimento (Figura 1b). O óleo de soja inicialmente obteve 4,06, enquanto o óleo de girassol e os compostos, SC e GC, apresentaram os maiores valores totais de oxidação. Berset e Cuvelier (1996) propõem que o limite máximo para totox seja 10, portanto, inicialmente, os óleos encontram-se abaixo desse limite. Os óleos de soja e girassol expressaram aumento gradativo do tempo inicial para 5 horas de aquecimento, entretanto, de 5 a 15 horas, embora se diferenciaram estatisticamente, mantiveram baixa taxa de aumento na degradação dos óleos.
A formação de compostos polares totais aumentou gradativamente para todos os óleos com o aumento do tempo de termoxidação, conforme Figura 1c. Os óleos mais insaturados, S e G, apresentaram os maiores teores de compostos polares, atingindo ao final das 15 horas, 42,5 e 43,2%, respectivamente, por serem mais susceptíveis à oxidação. Entretanto, os demais óleos não se diferenciaram estatisticamente e mantiveram ao longo da termoxidação menores porcentagens de compostos polares. Com 15 horas, os óleos C, SC e GC apresentaram redução de aproximadamente 40% quando comparados aos óleos S e G.
Segundo Lee (2009), um óleo de boa qualidade não deve ultrapassar 25% de compostos polares totais em processo de aquecimento, caso contrário, deverá ser descartado. Logo, pode-se observar que S e G devem ser descartados a partir de 5 horas de termoxidação, entretanto, os demais podem ser utilizados até 15 horas. Portanto, é possível concluir que ácidos graxos majoritariamente saturados, do óleo de coco, contribuíram para menor oxidação dos óleos.
A estabilidade oxidativa dos óleos diminuiu ao longo da termoxidação (Figura 1d). O destaque inicial é para o óleo de coco com 100,5 h de estabilidade, ou seja, aproximadamente 90% mais estável que os demais. Com decorrer da termoxidação, S e G não se diferenciaram estatisticamente e com 15 horas de aquecimento apresentaram maior estabilidade do que SC e GC. Comparando SC e GC, nota-se que o SC possui maior estabilidade oxidativa, devido a presença de γ- e δ-tocoferol (Tabela 2) que agem como antioxidantes naturais protegendo o óleo da oxidação.
O óleo de coco foi o mais estável durante o ensaio de termoxidação, com os menores índices de ácidos dienóicos conjugados, compostos polares totais e 25 horas de estabilidade oxidativa ao final de 15 horas de aquecimento quando comparado com soja e girassol médio oleico. Os compostos SC e GC pouco se diferenciaram estatisticamente, entretanto, ao serem comparados a S e G obtiveram menor oxidação primária e secundária e maior estabilidade oxidativa.
O α-tocoferol é responsável por proteger o metabolismo humano de reações indesejáveis de oxidação (DEBIER; LARONDELLE, 2005). É possível observar, conforme Tabela 2, que o óleo de coco não apresentou nenhum teor de tocoferóis.
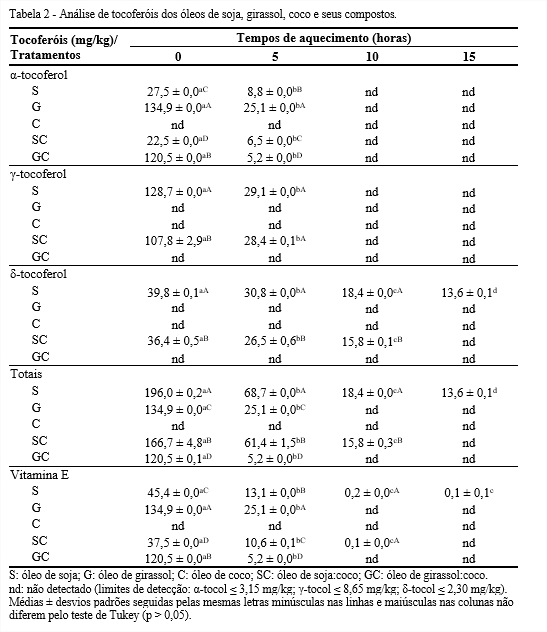
O óleo de soja e SC apresentaram baixos níveis de α-tocoferol com perdas consideráveis de aproximadamente 68 e 71% do isômero, respectivamente, em 5 horas de aquecimento. Por outro lado, o óleo de girassol e GC apresentaram altos níveis do isômero no tempo inicial e perdas de 81 e 95%, respectivamente, em 5 horas de aquecimento. Logo, os óleos compostos foram mais sensíveis ao aquecimento em relação a perda de α-tocoferol. Veronezi e Jorge (2018) analisaram os teores de α-tocoferol do óleo de soja, e dos óleos compostos soja-mamão e soja-melão e encontraram inicialmente 57,6; 53,6 e 51,07 mg/kg, respectivamente.
O isômero γ-tocoferol foi detectado apenas nos óleos de soja e SC nos tempos 0 e 5 horas. É possível observar que o óleo de soja apresentou maior índice deste isômero em ambos os tempos, mas perdeu 77% em 5 horas, enquanto o SC apresentou perda menor, 73%. O isômero de δ-tocoferol foi detectado para os óleos S e SC até 10 horas de termoxidação. Ao final, o S apresentou perda de 66%, enquanto o SC em 10 horas apresentou perda de 57%. Já em 15 horas este não foi mais detectado.
O óleo de soja apresentou os maiores teores de tocoferóis totais, sendo detectados com até 15 horas de termoxidação, tendo ao final do período perda de 93%, enquanto seu composto SC teve perda final ao longo de 10 horas de 91%. Por outro lado, os óleos G e GC apresentaram elevada quantidade do isômero α-tocoferol no tempo inicial e cuja presença foi detectada até 5 horas de termoxidação.
Pazzoti et al. (2018) observaram que os óleos compostos apresentaram maiores retenções de tocoferóis totais, destacando o óleo composto por linhaça e algodão (50:50) com 90,81% no final da estocagem em estufa a 60oC.
A vitamina E foi detectada até 5 horas nos óleos G e GC, embora seus valores tenham caído drasticamente. O óleo em que a vitamina E mais resistiu à termoxidação foi o S, permanecendo até 15 horas, enquanto no óleo composto SC, resistiu até 10 horas.
CONCLUSÕES
As análises físico-químicas realizadas na caracterização dos óleos demonstraram que o C obteve menor oxidação, consequentemente, maior estabilidade oxidativa. Dentre os óleos compostos, o GC atingiu proporção mais próxima de 1:1:1 em ácidos graxos saturados, monoinsaturados e poli-insaturados, respectivamente.
Durante 15 horas de termoxidação, SC e GC quando comparados a S e G, conseguiram minimizar os índices de compostos primários e secundários de degradação, além de reduzir em 40% a formação de compostos polares totais. Ao comparar os óleos compostos, o SC apresentou maior teor de tocoferóis totais, enquanto o GC apresentou maior quantidade de vitamina E.
Apesar do óleo de girassol ser médio oleico e o de soja poli-insaturado, ambos apresentaram bons resultados, quando se juntaram ao coco formando SC e GC. SC foi resistente à oxidação devido a presença de antioxidantes naturais provenientes do S e a composição de ácidos graxos saturados provenientes do C. Da mesma forma, GC conseguiu resultados melhores que S e G devido a sua composição equilibrada em ácidos graxos saturados e monoinsaturados. Portanto, torna-se viável a aplicação de óleos compostos como SC e GC em processos que envolvam elevadas temperaturas.
AGRADECIMENTOS
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelas bolsas de mestrado e produtividade em pesquisa.
REFERÊNCIAS
AOCS. American Oil Chemits’ Society. Official methods and recommended practices of the American Oil Chemists’ Society, Chicago, 6 ed. Champaing, 2009.
BANZATTO, D. A.; KRONKA, S. N. Experimentação agrícola. 4. ed. Jaboticabal: Funep, 2006, p. 237.
BERSET, C.; CUVELIER, M. E. Methods of estimating the degree of lipid oxidation and of measuring antioxidizing power. Sciences des Aliments, Dijon, v. 16, n. 3, p. 219-245, 1996.
CODEX ALIMENTARIUS COMMISSION (FAO/WHO). Codex Stan 210-2015: codex standard for vegetable oils. Codex Alimentarius, Roma, Italia, rev. 3, amendment 2015.
DAYRIT, F. M. The properties of lauric acid and their significance in coconut oil. Journal of the American Oil Chemists’Society, Chicago, v. 92, n.1, p. 1-15, 2015.
DEBIER, C.; LARONDELLE, Y. Vitamins A and E: metabolism, roles and transfer to offspring. British Journal of Nutrition, Cambrigde, v. 93, n. 2, p. 153-174, 2005.
DOBARGANES, M. C.; VELASCO, J.; DIEFFENBACHER, A. Determination of polar compounds, polymerized and oxidized triacylglycerols, and diacylglycerols in oils and fats. Pure and Applied Chemistry, Oxford, v. 72, n. 8, p. 1563-1575, 2000.
GUILLÉN, M. D.; CABO, N. Fourier transform infrared spectra data versus peroxide and anisidine values to determine oxidative stability of edible oils. Food Chemistry, London, v. 77, n. 4, p. 503-510, 2002.
GUNSTONE, F. D. Vegetable oils in food technology: composition, properties and uses. 2 ed. Oxford: Wiley-Blackwell, 2011, p. 376.
HARTMAN, L.; LAGO, R. C. A. Rapid preparation of fatty acid methyl esters from lipids. Laboratory Practice, London, v. 22, n. 1, p. 475-476, 1973.
ICMR. Indian Council for Medical Research. Nutrient requirements and recommended daily allowances for Indians. New Delhi, p. 53-60, 1989.
LaROSA, J. C.; HUNNINGHAKE, D.; BUSH, D.; CRIQUI, M. H.; GETZ, G. S.; GOTTO JR, A. M.; GRUNDY, S. M.; RAKITA, L.; ROBERTSON, R. M.; WEISFELDT, M. L. The cholesterol facts. A summary of the evidence relating dietary fats, serum cholesterol, and coronary heart disease. A joint statement by the American Heart Association and the National Heart, Lung, and Blood Institute. The Task Force on Cholesterol Issues, American Heart Association. Circulation, Dallas, v. 81, n. 5, p. 1721-1733, 1990.
LEE, C. H. How to manage the frying oil quality. Taiwan Food News, Taipei, v. 232, p. 38-42, 2009.
MAHAN, L. K.; ESCOTT-STUMP, S. K. Alimentos, nutrição e dietoterapia. São Paulo: Roca, 2010.
McLAUGHLIN, P. J.; WEIHRAUCH, J. L. Vitamin E content of foods. Journal of the American Dietetic Association, Chicago, v. 75, n. 6, p. 647-665, 1979.
MIYOSHI, H.; MORIYA, K.; TSUTSUMI, T.; SHINZAWA.; FUJIE, H.; SHINTANI, Y.; FUJINAGA, H.; GOTO, K.; TODOROKI, T.; SUZUKI, T.; MIYAMURA, T.; MATSUURA, Y.; YOTSUYANAGI, H.; KOIKE, K. Pathogenesis of lipid metabolism disorder in hepatitis C: polyunsaturated fatty acids counteract lipid alterations induced by the core protein. Journal of Hepatology, Genebra, v. 54, n. 3, p. 432-438, 2011.
NITBANI, F. O.; JUMINA, J.; SISWANTA, D.; SOLIKHAH, E. N. Isolation and antibacterial activity test of lauric acid from crude coconut oil (Cocos nucifera L.). Procedia Chemistry, local, v. 18, p. 132-140, 2016.
O’BRIEN, R. D. Fats and oils: formulating and processing for applications. 3 ed. Boca Raton: CRC Press, 2008. 680 p.
PAZZOTI, G.; SOUZA, C.; VERONEZI, C.; LUZIA, D.; JORGE, N. Evaluation of oxidative stability of compound oils under accelerated storage conditions. Brazilian Archives of Biology and Technology, Curitiba, v. 61, 2018.
RIBEIRO, L. A verdade científica sobre um superalimento funcional denominado óleo de coco. Brazilian Journal of Surgery and Clinical Research, Maringá, v. 18, n. 3, p. 109-117, 2017.
SAVVA, S. C.; KAFATOS, A. Vegetable oils: dietary importance. In: SMITHERS, G. (Ed). Reference module in food science. 1 ed. Amsterdam: Elsevier, 2016. p. 365-372.
SEILER, G. J.; GULYA, T. J. Sunflower: overview. In: SMITHERS, G. (Ed). Reference module in food science. 1 ed. Amsterdam: Elsevier, 2016, p.1-7.
SHAHIDI, F. Bailey’s industrial oil & fats products. 6 ed. New York: John Wiley & Son 2005. 3616 p.
SILVA, F. A. M.; BORGES, M. F.; FERREIRA, M. A. Métodos para avaliação do grau de oxidação lipídica e da capacidade antioxidante. Química Nova, São Paulo, v. 22, n. 1, p. 94-103, 1999.
SUÁREZ-MAHECHA, H.; FRANCISCO, A.; BEIRÃO, L. H.; BLOCK, J. M.; SACCOL, A.; PARDO-CARRASCO, S. Importância de ácidos graxos poli-insaturados 20 presentes em peixes de cultivo e de ambiente natural para a nutrição humana. Boletim do Instituto de Pesca, São Paulo, v. 28, n. 1, p. 101-110, 2002.
VERONEZI, C. M.; JORGE, N. Effect of Carica papaya and Cucumis melo seed oils on the soybean oil stability. Food Science and Biotechnology, Busan, v. 22, n. 4, p. 1031-1040, 2018.
XIE, Y. S.; JIANG, M.; LI, Y.; GUO, Y.; CHENG, H.; QIAN, W.; YAO, H. Evaluation on the formation of lipid free radicals in the oxidation process of peanut oil. LWT – Food Science and Technology, London, v. 104, p. 24-29, 2019.
