
COMPORTAMENTO DO ÓLEO DE BURITI (MAURITIA FLEXUOSA L.) EM CONDIÇÕES DE TERMOXIDAÇÃO
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Pedro Alberto Pavão Pessôa1; Ana Carolina da Silva 2; João da Paixão Soares3, Neuza Jorge4*
1Doutor em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Docente do Depto de Engenharia de Alimentos, Instituto de Ciências Tecnológicas e Exatas, Universidade Federal do Triângulo Mineiro – UFTM.
3Docente da Educação Básica e Tecnológica, Instituto Federal do Maranhão – IFTM.
4Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected]
Resumo: O acelerado aumento no consumo de óleos vegetais no mundo tem impulsionado sua produção a partir de uma variedade extensa de matérias-primas. No Brasil, mais de 80% dos óleos produzidos são utilizados para fins alimentícios, desde tempero de saladas, frituras e até mesmo no preparo de bolos, maioneses, margarinas e cremes vegetais. Inúmeras pesquisas têm sido desenvolvidas com o intuito de agregar valor nutricional, melhorar a conservação, a estabilidade e a aparência dos óleos. Partindo dessa premissa, esta pesquisa teve como objetivo estudar o comportamento do óleo de buriti prensado a frio em condições de termoxidação. O óleo de buriti foi termoxidado a 180ºC e analisado em diferentes intervalos de tempo (0, 1, 2, 3, 4 e 5 horas). As amostras foram analisadas quanto ao teor de compostos polares totais, estabilidade oxidativa, composição de ácidos graxos, carotenoides totais, perfil de fitosteróis e tocoferóis. Durante o processo de termoxidação, não houve oscilação importante no perfil de ácidos graxos do óleo de buriti prensado a frio. Ao longo do aquecimento, o óleo de buriti apresentou maior retenção de fitosteróis em relação aos compostos bioativos, carotenoides e tocoferóis. A estabilidade oxidativa reduziu significativamente e o teor de compostos polares totais aumentou 40%. É possível afirmar que o óleo de buriti, por ser predominantemente monoinsaturado, não apresentou boa resistência ao aquecimento prolongado, verificando-se redução significativa nos teores de compostos bioativos. Recomenda-se, portanto, o uso do óleo em preparações sem uso de calor ou com aquecimentos mais brandos.
Palavras-chave: aquecimento; compostos bioativos; frutos amazônicos; óleos vegetais
INTRODUÇÃO
O buriti (Mauritia flexuosa L.), também conhecido como buritizeiro, miriti ou buriti-do-brejo é uma palmeira cujo habitat concentra-se em campos limpos e úmidos, conhecidos como veredas, sendo indicadores de solos úmidos, com a existência de nascentes de cursos d’água. Por isso, o nome buriti, cuja origem deriva do Tupi-guarani (mburi’ti), e significa “árvore que dá líquido” ou “água da palmeira” (FUJITA, 2007; MATOS et al., 2014).
O buriti é muito utilizado para os mais diversos fins em lugares onde há produção. Da planta se extrai uma seiva que possui elevado teor de sacarose; as folhas são utilizadas para cobrir casas, confecção de cordas, redes, vassouras. No setor alimentício, a polpa de buriti é utilizada para produção de doces, sorvetes, geleias, óleos, entre outros (VIEIRA et al., 2010).
Estudos vêm sendo realizados no sentido de identificar as substâncias presentes no óleo do buriti desde que a polpa dos frutos dessa palmeira foi considerada oleaginosa. Dentre as principais substâncias têm-se os ácidos graxos de cadeia longa, sendo 18% de ácido palmítico e 75% de ácido oleico (ALBUQUERQUE et al., 2005). Além dos ácidos graxos, outras substâncias têm sido encontradas e analisadas no óleo de buriti.
Estudos também apontam a presença de elevado teor de β-caroteno fazendo do buriti grande fornecedor desse pigmento correspondendo a 90% dos carotenoides presentes no óleo extraído da polpa do fruto e seu teor é cerca de dez vezes maior que o do óleo de palma e da cenoura. A polpa de buriti contém entre 8 a 9% de óleo, contendo 300 mg de β-caroteno a cada 100 g da polpa, considerada uma fonte promissora de pró-vitamina A (MARIATH; LIMA; SANTOS, 1989). No entanto, mesmo diante dessas vantagens, tem-se observado poucos trabalhos científicos voltados para o estudo do buriti como fim alimentício, ou pelo uso como corante no lugar do β-caroteno sintético ou como pró-vitamina A.
Costa et al.(2010) realizaram pesquisa empregando polpas e amêndoas de plantas das regiões Norte e Nordeste do Brasil para verificar a presença de fitosteróis e tocoferóis. Dentre as espécies estudadas encontra-se a Mauritia flexuosa L. Utilizando técnicas cromatográficas para a caracterização, os autores observaram a presença de 252,15 µg/g de α-tocoferol na polpa de buriti, sugerindo que o buriti pode ser considerado uma fonte de vitamina E quando consumido in natura. Outro estudo foi realizado por Godoy e Rodriguez-Amaya (1995) sobre o óleo do buriti aonde foram encontrados 700 mg/kg de tocoferóis e 800-1000 mg/kg de fitosteróis. Manhães (2014) ao analisar o óleo de buriti determinou o ponto de fumaça numa faixa entre 110-163ºC, valores estes abaixo do valor máximo de fritura (180ºC) adotado pela ANVISA (BRASIL, 2004). No entanto, faz-se necessário uma análise mais detalhada no óleo de buriti para verificar suas propriedades em altas temperaturas. Portanto, este trabalho teve como objetivo analisar o comportamento do óleo de buriti prensado a frio em condições de termoxidação.
MATERIAL E MÉTODOS
Material
Polpa de buriti
Adquiriu-se no comércio do povoado Brejinho, localizado no município de Caxias-MA, Brasil, 10 kg da polpa in natura do fruto do buriti. A polpa foi extraída de frutos de buriti após serem coletados, lavados em água corrente e submersos em solução aquosa de hipoclorito de sódio a 10%. Logo após, foram despolpados manualmente com faca inoxidável, seguindo normas de boas práticas de fabricação.
Separou-se 0,5 kg da polpa in natura para análises da composição centesimal e 9,5 kg para a extração do óleo. Após a separação, as frações de polpa foram armazenadas a -18ºC até o momento das análises.
Óleo de buriti prensado a frio
Secou-se os 9,5 kg da polpa de buriti, no Laboratório de Bioquímica e Bromatologia, da Universidade Federal do Piauí (UFPI), utilizando estufa de Secagem e Esterilização com circulação de ar mecânica (modelo 320-SE, FANEM), a uma temperatura de 40ºC/120 h e depois a polpa seca foi triturada em multiprocessador (modelo RI7625, Philips Walita) obtendo-se 5,2 kg.
A extração do óleo foi realizada no Laboratório de Agroindústria do Instituto Federal de Educação, Ciência e Tecnologia do Maranhão (IFMA), Campus Caxias-MA. Utilizou-se os 5,2 kg da polpa seca para extração do óleo de buriti, realizada a frio, em única prensagem, com o uso de uma prensa do tipo uniaxial, hidráulica e manual (modelo P30000, Bovenau), com uma massa de 12 ton aplicada sobre o pistão do molde de aço obtendo-se 1,0 L de óleo bruto. Logo após, o óleo bruto foi filtrado com sulfato de sódio anidro, envasado em frascos de vidro âmbar e estocado à uma temperatura de -18ºC, em freezer.
Ensaio de termoxidação
O óleo de buriti extraído por prensagem a frio foi submetido à termoxidação no Laboratório de Óleos e Gorduras, do Departamento de Engenharia e Tecnologia de Alimentos da Universidade Paulista “Júlio de Mesquista Filho” (UNESP), Campus São José do Rio Preto-SP. Utilizou-se chapa elétrica (modelo Q-261-2, Quimis) à temperatura de 180ºC, e as amostras foram coletadas em 0, 1, 2, 3, 4 e 5 horas. Em seguida, transferido a um béquer um volume de 30 mL do óleo para cada tempo, obedecendo a uma relação superfície/volume de 0,40/cm. A temperatura foi controlada com auxílio de termômetro com variação de ± 5ºC. Todas as amostras, a diferentes intervalos de tempo, foram recolhidas em frasco âmbar, inertizadas com nitrogênio gasoso e armazenadas à temperatura de aproximadamente -18ºC até o momento das análises (compostos polares totais, estabilidade oxidativa, composição de ácidos graxos e triacilgliceróis, carotenoides totais, perfil de fitosteróis e tocoferóis).
Métodos
Os compostos polares totais, foram obtidos utilizando o leitor de compostos polares Testo 270 (Campinas, São Paulo, Brasil) com as amostras de óleo de buriti previamente aquecidas a 100ºC ± 5ºC. O sensor do equipamento foi submerso na amostra e a leitura do teor de compostos polares totais foi feita no display do instrumento (URIARTE; GUILLÉN, 2010). Os resultados foram expressos em porcentagem.
A estabilidade oxidativa foi realizada utilizando o método Cd 12b-92 da AOCS (2009), com o uso do instrumento Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland). Transferiu-se 3 g das amostras de óleo para tubos de reação e 60 mL de água destilada nos recipientes contendo o eletrodo e aqueceu-se à temperatura de 110ºC com fluxo de ar de 20 L/h. Os resultados da curva de condutividade elétrica x tempo (período de indução) foram expressos em horas.
A esterificação das amostras foi realizada utilizando-se o método de metilação a frio, Ce 2-66 da AOCS (2009), onde os ésteres metílicos dos ácidos graxos presentes nos óleos foram obtidos. Pesou-se 0,1 g de óleo, filtrado em sulfato de sódio anidro, em tubo de ensaio. Após, adicionou-se 3 mL de n-hexano e 0,5 mL de solução de hidróxido metanólico de potássio 0,5 N. Em seguida, agitou-se vigorosamente por 1 min. em vortex e centrifugou-se por 5 min. a 3.000 rpm. A determinação da composição em ácidos graxos foi realizada de acordo com o método Ce 1-62 (AOCS, 2009), em cromatógrafo gasoso (marca Varian Inc., modelo 3900), com detector de ionização de chama, injetor split e amostrador automático. Condições de análise: coluna capilar de sílica fundida (marca Varian Inc., modelo CP-Sil 88, Microsorb) de 60 m de comprimento, com diâmetro interno de 0,25 mm e espessura do filme de 0,20 μm. A programação de temperatura da coluna foi iniciada em 90°C por 4 minutos, aquecida a 10°C/min. até 195°C e mantida em isoterma durante 16 min. As temperaturas utilizadas no injetor e no detector foram 230 e 250°C, respectivamente. O gás de arraste foi o hidrogênio com velocidade linear de 30 mL/min. Os ácidos graxos foram identificados pela comparação dos tempos de retenção de padrões puros de ésteres metílicos de ácidos graxos com os componentes separados das amostras e a quantificação foi feita por normalização de área. Utilizou-se como padrão uma mistura composta de 37 ésteres metílicos de ácidos graxos (marca Supelco) de C4:0 a C24:1, com pureza entre 99,1 e 99,9%. Os resultados foram expressos em porcentagem.
A composição em triacilgliceróis foi obtida por meio de uma distribuição randômica utilizando programa computacional desenvolvido por Antoniosi Filho, Mendes e Lanças (1995). Grupos com concentração total de triacilgliceróis menor que 1% foram ignorados. Os resultados foram expressos em porcentagem.
Os carotenoides totais foram determinados de acordo com o método de Porim, descrito por Lin, Sue e Al (1995) e Pawlowicz et al. (2013), onde se pesou 0,01 g do óleo de buriti extraído por prensagem obedecendo a Lei de Lambert-Beer, cujas amostras foram dissolvidas em 10 mL de hexano e posteriormente as absorvâncias foram lidas utilizando um comprimento de onda de 446 nm em um espectrofotômetro (modelo Uv-Vis mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão). Os resultados foram expressos em mg de β-caroteno/kg.
Para determinação do teor de fitosteróis, a saponificação foi realizada conforme a metodologia de Duchateau et al. (2002). Para realização da saponificação primeiramente preparou-se uma solução de 3 mg/mL de β-colestanol em terc-butil-metil-éter, com grau de pureza para fins cromatográfico, denominada de padrão interno (PI). Em seguida, pesou-se aproximadamente 0,50 g de óleo em um tubo de ensaio com tampa de rosca, adicionou-se 100 µL do padrão interno e 1 mL de solução alcóolica de hidróxido de potássio. Logo após, homogeneizou-se em vortex a solução por 10 segundos e colocou-se em banho-maria a 70ºC por 50 min., homogeneizando a cada 5 min. em vortex. Adicionou-se 1 mL de água destilada e 5 mL de n-hexano. Agitou-se vigorosamente e transferiu-se a camada orgânica para outro tubo de ensaio contendo sulfato de sódio anidro. Esta operação foi repetida mais duas vezes com 5 e 4 mL de n-hexano. As fases orgânicas foram combinadas, homogeneizadas e deixadas em repouso até ficarem límpidas. Durante todo o procedimento, o tubo de ensaio foi coberto com papel alumínio para evitar degradação dos fitosteróis pela ação da luz. A determinação do teor de fitosteróis foi utilizado o método Ch 6-91 da AOCS (2009) com adaptações. A análise foi realizada em cromatografia gasosa (marca Shimadzu, modelo Plus-2010), com detector de ionização de chama, injetor split e amostrador automático. Condições de análise: coluna capilar de sílica fundida (marca Shimadzu, modelo Restek RTX 5) de 30 m de comprimento, com diâmetro interno de 0,25 mm e espessura do filme de 0,25 µm. A programação de temperatura da coluna foi iniciada em 100°C por 2 min., aquecida a 15°C/min. até 260°C e mantida em isoterma durante 35 min. As temperaturas utilizadas no injetor e no detector foram 280 e 320°C, respectivamente. O gás de arraste utilizado foi o hidrogênio com velocidade linear de 40 mL/min. Os fitosteróis foram identificados por comparação com o tempo de retenção dos padrões puros analisados nas mesmas condições das amostras. A quantificação de cada isômero foi realizada por padronização interna com base nas áreas dos picos, utilizando padrões, campesterol, estigmasterol, β-sitosterol e estigmastanol (marca Supelco) com grau de pureza de 99, 95, 98 e 97,4%, respectivamente. Os teores de fitosteróis individuais foram expressos mg/kg.
O teor de tocoferóis foi determinado utilizando o método da Ce 8-89 da AOCS (2009). A análise foi realizada por cromatografia líquida de alta eficiência (marca Varian Inc., modelo 210-263), com detector de fluorescência. Condições de análise: coluna de aço inox empacotada com sílica (Microsorb 100 Si, marca Varian Inc.) de 250 x 4,60 mm com poro de 0,50 μm e comprimento de onda de excitação em 290 nm e de emissão em 330 nm. A separação cromatográfica foi realizada por eluição isocrática de fase móvel constituída de n-hexano:álcool isopropílico (95,5:0,5 v/v) com fluxo de 1,20 mL/min. Os tocoferóis foram identificados por comparação com o tempo de retenção dos padrões puros analisados nas mesmas condições das amostras. A quantificação de cada isômero foi realizada por padronização externa com base nas áreas dos picos, utilizando padrões de α-, β-, γ- e δ-tocoferol (marca Supelco) com grau de pureza de 99,90, 98,00, 99,40 e 99,60%, respectivamente. A média dos teores de tocoferóis individuais foi expressa em mg/kg.
Análise estatística
As análises foram realizadas e os resultados expressos pelo valor médio ± desvio padrão e os dados avaliados pelos métodos de análise de variância (ANOVA) com comparação das médias pelo Teste de Tukey com 95% de confiança, utilizando o XLSTAT 7.5®.
RESULTADOS E DISCUSSÃO
A termoxidação é usada para avaliar as características do óleo em elevadas temperaturas, comparado aos processos de fritura, porém, sem a interferência do alimento. Normalmente, a temperatura utilizada em frituras é 180ºC e, por isso, adotou-se esse valor (MBA; DUMONT; NGADI, 2015).
Na análise dos compostos polares totais observa-se que no intervalo de 0 a 2 horas o percentual permaneceu constante (Tabela 1). Nos tempos de 3, 4 e 5 horas houve diferença significativa (p < 0,05) com o aumento dos percentuais de compostos polares, indicando uma oxidação e formação de compostos que causam a degradação do óleo, podendo ser detectados, também, pelo aroma. De acordo com Freire, Mancini-Filho e Ferreira (2013), o processo de termoxidação é comparado a uma fritura do tipo contínua, onde o alimento é frito em uma só etapa, em que o óleo é aquecido continuamente, servindo para pré-fritura e fritura de batatas. Segundo os autores, ocorre reação de hidrólise com formação de ácidos graxos livres que diminuem a qualidade do óleo.

A ANVISA por meio de um Informe Técnico considera que o óleo utilizado em frituras não pode ser utilizao em temperatura superior a 180ºC e, no caso das fritadeiras domésticas que não possuem termostatos para controle, não é permitido a produção de fumaça, nem teor de compostos polares totais acima de 25%, a quantidade de ácidos graxos livres não deve ser superior a 0,9% e o teor de ácido α-linolênico não deve ultrapassar o limite de 2% (BRASIL, 2004). Assim, pode-se observar que o percentual de compostos polares do óleo de buriti termoxidado não ultrapassou o limite até 5 horas.
A estabilidade oxidativa está diretamente relacionada com a presença de antioxidantes e estes sofrem influência direta de elevadas temperaturas (JORGE; VERONEZI; DEL RÉ, 2015). Como o óleo de buriti prensado a frio foi submetido a 180ºC, à medida que o tempo aumentou, a concentração das substâncias antioxidantes diminuiu, ocasionando uma redução brusca no período de indução, causando uma diferença significativa entre os intervalos de tempo, principalmente, 4 e 5 horas.
Aquino et al. (2012) ao analisarem a capacidade antioxidante dos óleos de buriti bruto e refinado concluíram que o óleo bruto apresentou maior potencial antioxidante do que o óleo refinado e, em consequência, maior estabilidade oxidativa.
O percentual dos ácidos graxos saturados teve um pequeno aumento, enquanto os percentuais de monoinsaturados e poli-insaturados sofreram pequenas reduções (Tabela 2). A redução foi mais acentuada à medida que aumentou a quantidade de insaturações, ou seja, a diminuição se deu na seguinte ordem: α-linolênico > linoleico > oleico.
Machado, García e Abrantes (2008) avaliaram o grau de insaturação do óleo em processo de fritura e, para isso, empregaram o óleo de palma com elevado percentual de ácidos graxos saturados e monoinsaturados e o óleo de soja com maior predominância de ácidos graxos poli-insaturados. Os autores observaram que houve uma crescente redução do percentual dos ácidos graxos insaturados com o aumento do tempo de aquecimento e concluíram que isto ocorreu devido à termoxidação destas substâncias, ocasionada pela alta temperatura e ação do oxigênio. Também, observaram que a perda dos ácidos graxos insaturados aumentou com o seu grau de insaturação, fato igualmente ocorrido nesta pesquisa. Essa alteração, também, foi observada por Osawa e Gonçalves (2012), ao analisarem o perfil de ácidos graxos da oleína de palma aquecida em processo de fritura por imersão e, de acordo com sua pesquisa, isto ocorreu principalmente com o ácido linoleico, que, segundo os autores, tal perda pode ter sido ocasionada durante os ciclos de fritura devido a oxidação lipídica e a formação de compostos polares.
Os triacilgliceróis PPP, POP, SOP e POO apresentaram um ligeiro aumento, em virtude do maior percentual de ácidos graxos saturados em relação ao dos ácidos graxos insaturados (Tabela 3). Por outro lado, os percentuais dos triacilgliceróis SOO e OOO sofrem redução. A composição dos triacilgliceróis é análoga à composição dos ácidos graxos, uma vez que estes formam as estruturas dos triacilgliceróis.
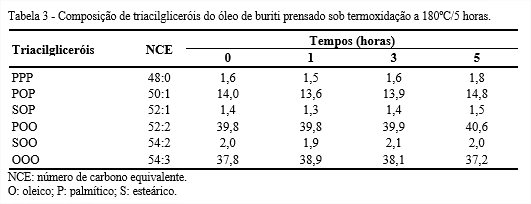
Jorge e Gonçalves (1998) analisaram o comportamento dos óleos de girassol convencional e com alto teor de ácido oleico em processo de termoxidação e em fritura descontínua e constataram que a perda de triacilgliceróis depende principalmente da composição do óleo que das variáveis do processo. Também observaram que o óleo de girassol convencional teve maior perda dos triacilgliceróis em relação ao óleo de girassol com alto teor de ácido oleico, podendo ser justificado pelo maior percentual de ácidos graxos poli-insaturados no óleo de girassol convencional.
Os valores de carotenoides totais (Tabela 4) apresentaram diferença significativa (p < 0,05) apenas nos dois primeiros tempos, 0 e 1 hora, onde houve um decaimento considerável no teor de carotenoides presentes no óleo. Para os demais tempos não houve diferença significativa (p > 0,05), mas, ainda assim, ocorreu uma pequena redução destes compostos, podendo ser observada na Figura 1 a diferença de tonalidade, indicando a perda de carotenoides.
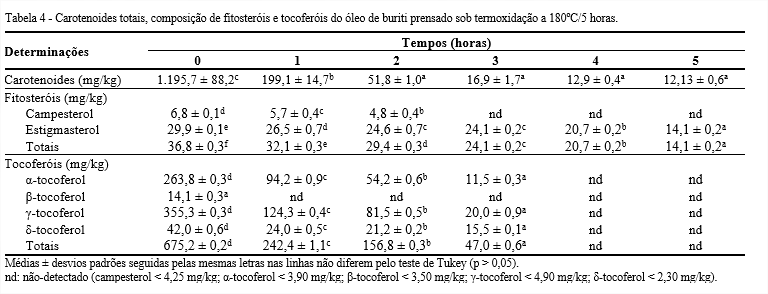

O conteúdo de carotenoides no óleo de buriti no tempo 0 é semelhante ao encontrado no óleo do jerivá (1219 mg/kg). Estes valores são bem superiores ao teor de carotenoides da cenoura, 62 mg/kg, considerada fonte de vitamina A (JORGE; SILVA; VERONEZI, 2021).
Os teores de fitosteróis e tocoferóis tiveram, também, uma redução significativa com o aumento do tempo. Assim como os carotenoides, esses compostos também são sensíveis ao aquecimento do óleo (AQUINO et al., 2012). Observa-se que há uma pequena concentração de fitosteróis em 5 horas de aquecimento e os tocoferóis não são mais detectados desde 4 horas de aquecimento.
Observa-se que só há presença dos isômeros campesterol e estigmasterol e a partir de 3 horas, o campesterol já não é mais detectado. Os teores de fitosteróis totais sofreram redução ao longo do processo de termoxidação, apresentando diferença significativa (p < 0,05) em todos os tempos de aquecimento. A diminuição do teor de fitosteróis está diretamente relacionada com o tempo de permanência do óleo no processo de termoxidação, pois são sensíveis ao aquecimento (AQUINO et al., 2012).
No tempo inicial, o óleo contém todos os isômeros de tocoferóis, porém, em 1 hora de termoxidação do óleo, o isômero β-tocoferol já não é mais detectado e os demais em 4 horas. Há uma redução significativa dos teores de tocoferóis nos intervalos de tempo, pois são sensíveis ao calor.
Segundo Osawa e Gonçalves (2012), a perda dos tocoferóis durante o aquecimento pode ser um parâmetro para avaliar a degradação do óleo, uma vez que essas substâncias se degradam mais rapidamente em óleos sob aquecimento do que em temperatura ambiente. Na análise da oleína de palma em processo de fritura, os autores identificaram que o isômero α-tocoferol foi o que sofreu menor redução.
Costa (2015) analisou azeite de dendê bruto, artesanal, semi-industrial e industrial submetidos à termoxidação. O autor não detectou a presença do isômero β-tocoferol nos azeites artesanal e industrial desde o tempo 0 hora e o semi-industrial apresentou o isômero apenas no tempo 0 hora. Observou, também, que o tempo afetou todos os isômeros que sofreram uma redução brusca à medida que o tempo foi aumentando.
CONCLUSÕES
Durante o processo de termoxidação não houve oscilação importante no perfil de ácidos graxos do óleo de buriti prensado a frio. Ao longo do aquecimento, o óleo de buriti apresentou maior retenção de fitosteróis em relação aos compostos bioativos, carotenoides e tocoferóis. O óleo de buriti prensado a frio demonstrou grande potencial para novas fontes de óleo “alto-oleico”, vitaminas A e E e antioxidantes naturais, despontando como uma via para o uso do buriti na região do município de Caxias-MA.
AGRADECIMENTOS
Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – CAPES, pelo auxílio financeiro e bolsa de doutorado e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa de produtividade em pesquisa.
REFERÊNCIAS
ALBUQUERQUE, M. L. S.; GUEDES, I.; ALCANTARA JR., P.; MOREIRA, S. G. C.; BARBOSA NETO, N. M.; CORREA, D. S.; ZILIO, S. C. Characterization of buriti (Mauritia flexuosa L.) oil by absorption and emission spectroscopies. Journal of the Brazilian Chemical Society, Campinas, v. 16, n. 6A, p. 1113-1117, 2005.
ANTONIOSI FILHO, N. R.; MENDES, O. L.; LANÇAS, F. M. Computer prediction of triacylglycerol composition of vegetable oils by HRGC. Chromatographia, Chicago, v. 40, n. 9, p. 557-562, 1995.
ANVISA. Informe Técnico nº 11, de 05 de outubro de 2004. Estabelece normas para óleos e gorduras utilizados em frituras. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília, DF, 05 out. 2004.
AOCS. AMERICAN OIL CHEMISTS’ SOCIETY. Oficial Methods and Recommended Practices of the American Oil Chemists’ Society. 6 ed. Champaign: AOCS, 2009.
AQUINO, J. S.; PESSOA, D. C. N.; ARAÚJO, K. L. G. V.; EPAMINONDAS, P. S.; SHULER, A. R. P.; SOUZA, A. G.; STAMFORD, T. L. M. Refining of buriti oil (Mauritia flexuosa) originated from the Brazilian Cerrado: physicochemical, thermal-oxidative and nutritional implications. Journal of the Brazilian Chemical Society, Campinas, v. 23, n. 2, p. 212-219, 2012.
CODEX ALIMENTARIUS COMISSION (FAO/WHO). Codex standart for named vegetable oils: codex stan 210-1999. Codex Alimentarius, v. 10, 2009.
COSTA, M. M. Caracterização físico-química de azeites de dendê bruto (Elaeis guineenses) submetidos à termoxidação. 59 f. Dissertação (Mestrado em Alimentos, Nutrição e Saúde), – Programa de Pós-Graduação em Alimentos, nutrição e saúde, Universidade Federal Rural da Bahia, Salvador, 2015.
COSTA, P. A.; BALLUS, C. A.; TEIXEIRA-FILHO, J.; GODOY, H. T. Phytosterols and tocopherols content of pulps and nuts of Brazilian fruits. Food Research International, Barking, v. 43, n. 6, p. 1603-1606, 2010.
DUCHATEAU, G. S. M. J. E; BAUER-PLANK, C. G.; LOUTER, A. J. H.; HAM, M.; BOERMA, M.; ROOIJEN, J. J. M.; ZANDBELT, P. A. Fast and accurate method for total 4-desmethyl sterol(s) content in spreads, fat-blends, and raw materials. Journal of the American Oil Chemists’ Society, Chicago, v. 79, n. 3, p. 273-278, 2002.
FREIRE, P. C. M.; MANCINI-FILHO, J.; FERREIRA, T. A. P. C. Principais alterações físico-químicas em óleos e gorduras submetidos ao processo de fritura por imersão: regulamentação e efeitos na saúde. Revista de Nutrição, Campinas, v. 26, p. 353-358, 2013.
FUJITA, E. Qualidade e conservação frigorificada do fruto de buriti (Mauritia flexuosa L. f.). 52 f. Dissertação (Mestrado em Agronomia), – Faculdade de Ciências Agronômicas, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Botucatu, 2007.
GODOY, H. T.; RODRIGUEZ-AMAYA, D. B. Buriti (Mauritia vinifera Mart), uma fonte riquíssima de pró-vitamina A. Arquivos de Biologia e Tecnologia, Curitiba, v. 38, p. 109-120, 1995.
JORGE, N.; GONÇALVES, L. A. G. Comportamento do óleo de girassol com alto teor de ácido oleico em termoxidação e fritura. Ciência e Tecnologia de Alimentos, Campinas, v. 18, n. 3, p. 1-15, 1998.
JORGE, N.; SILVA, A. C.; VERONEZI, C. M. Syagrus romanzoffiana. In: Lima, F. F.; LESCANO, C. H.; OLIVEIRA, I. P. (org.). Fruits of the Brazilian Cerrado: composition and functional benefits. Gewerbestrasse: Srpinger Nature, 2021, p. 141-159.
JORGE, N.; VERONEZI, C. M.; DEL RÉ, P. V. Antioxidant effect of thyme (Thymus vulgaris L.) and oregano (Origanum vulgare L.) extracts in soybean oil under thermoxidation. Journal of Food Processing and Preservation, Westport, v. 39, n. 6, p. 1399-1406, 2015.
LIN, S.; SUE, T.; AI, T. Methods of test for palm oil and palm oil products. PORIM Test Methods, 1995.
MACHADO, E. R.; GARCÍA, M. C. D.; ABRANTES, S. M. P. Alterações dos óleos de palma e de soja em fritura descontínua de batatas. Ciência e Tecnologia de Alimentos, Campinas, v. 28, n. 4, p. 786-792, 2008.
MANHÃES, L. R. T Avaliação do potencial nutricional, funcional e sensorial de óleo de buriti (Mauritia flexuosa Mart.). 105 f. Tese (Doutorado em Ciências), – Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos, Universidade Federal Rural do Rio de Janeiro, Seropédica, 2014.
MARIATH, J. G.; LIMA, M. C.; SANTOS, L. M. Vitamin A activity of buriti (Mauritia vinifera Mart) and its effectiveness in the treatment and prevention of xerophthalmia. The American Journal of Clinical Nutrition, Rockville, v. 49, n. 5, p. 849-853, 1989.
MATOS, F. D. S.; NUNES, Y. R. F.; SILVA, M. A. P.; OLIVEIRA, I. D. S. Variação biométrica de diásporos de buriti (Mauritia flexuosa L.f. – Arecaceae) em veredas em diferentes estágios de conservação. Ciência Florestal, Santa Maria, v. 24, n. 4, p. 833, 2014.
MBA, O. I.; DUMONT, M.-J.; NGADI, M. Palm oil: processing, characterization and utilization in the food industry – a review. Food Bioscience, London, v. 10, p. 26-41, 2015.
OSAWA, C. C.; GONÇALVES, L. A. G. Deep-fat of meat products in palm olein. Ciência e Tecnologia de Alimentos, Campinas, v. 32, n. 4, p. 804-811, 2012.
PAWŁOWICZ, R.; GROMADZKA, J.; TYNEK, M.; TYLINGO, R.; WARDENCKI, W.; KARLOVITS, G. The influence of the UV irradiation on degradation of virgin rapeseed oils. European Journal of Lipid Science and Technology, Weinheim, v. 115, n. 6, p. 648-658, 2013.
URIARTE, P. S.; GUILLÉN, M. D. Formation of toxic alkylbenzenes in edible oils submitted to frying temperature: Influence of oil composition in main components and heating time. Food Research International, Barking, v. 43, n. 8, p. 2161-2170, 2010.
VIEIRA, R. F.; AGOSTINI-COSTA, T.; SILVA, D.; FERREIRA, F. R.; SANO, S. M. Frutas nativas da região Centro-Oeste do Brasil. Embrapa Informação Tecnológica, 2010.


