
INFLUÊNCIA DA TEMPERATURA SOBRE AS PROPRIEDADES FÍSICO-QUÍMICAS E ANTIOXIDANTES DOS ÓLEOS DE CHIA, GERGELIM E LINHAÇA
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Geisa Simplício de Oliveira Pazzoti1; Carolina Médici Veronezi2; Neuza Jorge3*
1Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Pós-doutoranda do Depto de Engenharia e Tecnologia de Alimentos, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
3Docente do Depto de Engenharia e Tecnologia de Alimentos, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected].
Resumo: Óleos vegetais especiais são utilizados para preparação de pratos culinários e enriquecimento de alimentos industrializados, com restrição de uso em temperaturas mais elevadas, devido a sua composição química. O presente trabalho objetivou-se avaliar os óleos de chia, gergelim (branco e preto) e linhaça (marrom e dourada), extraídos por prensagem a frio, quando submetidos às temperaturas de 60, 90 e 120°C por 5 horas. O óleo de chia apresentou menor estabilidade quando submetido a diferentes temperaturas, devido aos elevados índices de acidez, maiores teores de peróxidos, ρ-anisidina e ácido α-linolênico. Por outro lado, os óleos de gergelim se destacaram pela maior estabilidade oxidativa (média = 10 horas) e menor teor de compostos polares totais (média = 9%). Os teores de carotenoides dos óleos diminuíram com o aumento da temperatura, porém, o óleo de gergelim branco apresentou maior retenção a 120°C (94%). Os teores de tocoferóis decresceram com a elevação da temperatura. Os óleos de gergelim mostraram quantidades consideráveis de tocoferóis totais, em média, 2591,8 mg/kg. Dentre os óleos utilizados nas condições apresentadas desse estudo, os de gergelim se sobressaíram pela estabilidade oxidativa e maiores quantidades de compostos bioativos. Os óleos mostraram significativa capacidade antioxidante quando submetidos a elevação de temperatura, com habilidade para inibir radicais livres e também recomenda-se que possam ser de interesse do ponto de vista funcional, devido a presença de compostos bioativos. Assim, concluiu-se que os óleos de chia, gergelim e linhaça podem ser utilizados a 60, 90 e 120°C/5 horas, nas condições avaliadas.
Palavras-chave: atividade antioxidante; compostos bioativos; oxidação lipídica
INTRODUÇÃO
Os lipídios são componentes importantes dos alimentos, constituintes estruturais e funcionais das células em sistemas biológicos. No entanto, este grupo diversificado de substâncias é propenso à oxidação através de vários caminhos. Sua estabilidade oxidativa depende de um número de fatores intrínsecos e extrínsecos, incluindo a insaturação de seus ácidos graxos, condições ambientais, uso de antioxidantes, entre outros. A oxidação lipídica tem efeitos prejudiciais, tanto na qualidade dos alimentos, como na saúde humana (SHAHIDI; ZHONG, 2010).
A gastronomia utiliza diversas fontes lipídicas para muitas preparações culinárias, entre elas, os óleos vegetais especiais de chia, gergelim e linhaça que fornecem benefícios à saúde. A procura por alimentos saudáveis, sejam os obtidos por preparações culinárias ou industrializados, é frequente. O consumo de alimentos que podem retardar o aparecimento de doenças, aliado à prática de exercícios físicos, proporcionam qualidade de vida, o que reflete em uma maior longevidade.
Óleos originários de certas fontes vegetais, bem como os provenientes de origem marinha são conhecidos por seu alto teor de ácidos graxos poli-insaturados, e estão entre os mais instáveis, exibindo mudanças significativas na composição durante a oxidação, que fornecem uma medida indireta para a extensão da oxidação (SHAHIDI; ZHONG, 2010).
Os óleos de chia, linhaça e gergelim são compostos por ácidos graxos poli-insaturados (COELHO; SALAS-MELLADO, 2014).O óleo de chia é poli-insaturado, composto por cadeias longas de ácidos graxos, altamente suscetíveis à oxidação lipídica, o que, muitas vezes leva à perda do prazo de validade, aceitabilidade pelo consumidor, funcionalidade, valor e segurança (IMRAN et al., 2016). O óleo de gergelim apresenta cerca de 44% de ácidos graxos poli-insaturados (TUNDE-AKINTUNDE; OKE; AKINTUNDE, 2012). Em comparação com outros óleos vegetais, o de linhaça distingue-se pelo maior conteúdo do ácido graxo α-linolênico (53%), importante para o organismo humano, mas infelizmente baixo em estabilidade oxidativa (POPA et al., 2012; BERNACCHIA; PRETI; VINCI, 2014).
A oxidação não ocorre de forma espontânea, e sim por influência dos agentes catalisadores, como luz, traços de metais, metaloproteínas, enzimas e calor, durante a estocagem da matéria-prima ou do produto final, processamento e tratamento térmico com ocorrência da polimerização ou oxidação térmica, que podem ser aceleradas pelo calor (CHOE; MIN, 2006; THODE FILHO et al., 2014).
A oxidação lipídica é a maior causa de deterioração nos alimentos e leva ao desenvolvimento de off-flavours, perda de nutrientes e bioativos, formação de compostos potencialmente tóxicos e afeta negativamente a integridade do sistema biológico (SHAHIDI; ZHONG, 2010). Os produtos oriundos da oxidação são absorvidos pelo organismo e representam riscos para a mucosa intestinal. Os peróxidos afetam a atividade de diversas enzimas, alteram proteínas de baixa densidade (LDLc) e interagem com o DNA, funcionando como promotores da carcinogênese (ARAÚJO, 2019).
Assim, o aumento pela busca por alimentos mais saudáveis, principalmente de origem vegetal e a necessidade de óleos vegetais ricos em compostos bioativos com considerável estabilidade oxidativa, motivaram o estudo dos óleos de chia, gergelim e linhaça submetidos às temperaturas de 60, 90 e 120°C/5 h, com a possibilidade de conhecer a viabilidade de aplicação em preparações culinárias diversas e enriquecimento de produtos industrializados.
MATERIAL E MÉTODOS
Material
Os óleos das sementes de chia, gergelim branco e preto, linhaça dourada e marrom foram obtidos por prensagem a frio. No processo de extração, as sementes foram introduzidas em um secador a gás GLP (modelo SMR 610-G, Scott Tech, Vinhedo, Brasil) por 25 min. a 50°C para redução do teor de umidade. Posteriormente, foram destinadas à extratora de óleos vegetais (modelo ERT 60 III, Scott Tech, Vinhedo, Brasil) em sistema de extração radial tubular. Concluída a extração, os óleos passaram por filtro prensa (modelo FP 240-N2-5, Scott Tech, Vinhedo, Brasil), foram envasados em frascos âmbar, mantidos sob congelamento, transportados em recipiente térmico até o Laboratório de Óleos e Gorduras da Universidade Estadual Paulista – UNESP em São José do Rio Preto-SP e mantidos a -18°C.
Os óleos adquiridos foram submetidos às temperaturas de 60, 90 e 120°C/5 horas no equipamento Rancimat (modelo 743, Metrohm Ltd., Herisau, Switzerland), empregando 120 g de cada óleo. Finalizado o aquecimento, os óleos foram armazenados em frascos de vidro âmbar, inertizados com nitrogênio gasoso e acondicionados à -18°C até o momento das análises.
Métodos
Propriedades físico-químicas
Para as determinações dos índices de acidez, peróxidos (IP) e ρ-anisidina (IρA) foram utilizados os métodos oficiais da AOCS (2009), cujos resultados foram expressos em mg KOH/g e meq/kg, para acidez e peróxidos, respectivamente. O valor total de oxidação foi calculado por meio da equação: Totox = 2 (IP) + (IρA) (PEREIRA DE ABREU et al., 2010). A estabilidade oxidativa foi determinada segundo a AOCS (2009) utilizando o instrumento Rancimat (modelo 743, Metrohm Ltd., Herisau, Switzerland) a 110°C, com fluxo de ar de 20 L/h, expressa em horas. Os compostos polares totais foram analisados pelo instrumento de qualidade de óleo Testo 265 (Lenzkirch Black Forest, Germany) que se baseia na constante dielétrica do meio, com uma sensibilidade de 0,5%, resultado expresso em %.
O perfil de ácidos graxos foi realizado por cromatografia gasosa a partir dos óleos esterificados pelo método Ce 2-66 AOCS (2009). Foi utilizado um cromatógrafo gasoso (modelo 3900, Varian Inc., Walnut Creek, Estados Unidos) equipado com detector de ionização de chama, sistema de injeção split e coluna capilar de sílica fundida (CP-Sil 88, Microsorb, Varian Inc., Walnut Creek, Estados Unidos) de 60 m de comprimento, 0,20 m de espessura de filme e 0,25 mm de diâmetro interno. A temperatura inicial do forno foi de 90°C/10 min., aquecida a 10°C/min. até 195°C e mantida em isoterma durante 16 min. As temperaturas utilizadas no injetor e no detector foram de 230 e 250°C, respectivamente. O gás de arraste utilizado foi o hidrogênio. Os ácidos graxos foram identificados de acordo com os tempos de retenção, comparando-os com padrão de pureza entre 99,1 e 99,9% (Supelco, Bellefonte, Estados Unidos) expresso em porcentagem.
Os carotenoides totais foram determinados por espectrofotometria de varredura (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-Ku, Toquio, Japão), segundo metodologia descrita por Rodriguez-Amaya (2001). A quantificação foi calculada por meio da absorção no comprimento de onda de absorção máxima e valor de absortividade de 2592 em éter de petróleo, utilizando a equação: concentração (µ/g de óleo) = [(Abs x 25 x 1000)/2592 x P], onde Abs representa a absorvância da amostra em λ = 450-477 nm, e P é o peso da amostra de óleo.
Os compostos fenólicos totais foram extraídos de acordo com o método proposto por Parry et al. (2005), quantificados conforme a metodologia descrita por Singleton e Rossi (1965), utilizando reagente de Folin-Ciocalteau e detectados a λ = 765 nm em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-Ku, Tóquio, Japão). Foi utilizado ácido gálico (0-500 mg/L) para plotar a curva padrão, cujos resultados foram expressos em mg/kg.
Os teores de tocoferóis, utilizando o método da AOCS (2009), foram realizados em cromatógrafo líquido de alta eficiência (modelo 210-263, Varian, Walnut Creek, Estados Unidos), com detector de fluorescência, coluna de aço inóx empacotada com sílica (100 Si, Microsorb, Varian, Walnut Creek, Estados Unidos) e comprimento de onda de excitação em 290 nm e de emissão em 330 nm. Os valores das concentrações foram calculados em base da área dos picos de excitação da leitura e expressos em valores de cada isômero separadamente. Uma curva padrão de α-, β- γ- e δ-tocoferol (Supelco, Bellefonte, Estados Unidos) com elevado grau de pureza foi elaborada para expressar o teor de tocoferóis em mg/kg. A vitamina E foi calculada de acordo com o método descrito por Mclaughlin e Weihrauch(1979).Os fatores de conversão foram os seguintes: α-tocoferol x 1,0; β-tocoferol x 0,40; γ-tocoferol x 0,10 e δ-tocoferol x 0,01. O resultado foi expresso como equivalentes de α-tocoferol (mg/kg).
Três metodologias distintas foram utilizadas para determinação da capacidade antioxidante, realizadas em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Toquio, Japão). A capacidade de eliminação do radical DPPH• foideterminada conforme metodologia descrita por Kalantzakis et al. (2006). O óleo foi diluído em acetato de etila (1:10 v/v). Em 1 mL desta solução foi adicionado 4 mL da solução de DPPH• (40 µg/mL). A mistura foi agitada imediatamente em agitador de tubos (Vórtex, QL 901, Qilinbei instruments manufacture, China) e deixada em repouso a 25°C no escuro por 30 min. A absorvância foi medida a 517 nm em espectrofotômetro. Além disso foi feita uma amostra controle, com acetato de etila e DPPH• nas mesmas condições. A capacidade em sequestrar o radical DPPH• foi determinada usando a seguinte equação: atividade antioxidante (%) = [(A0 – A1)/ A0] x 100, onde A0 representa a absorvância da amostra controle e A1 a absorvância da amostra.
A capacidade antioxidante pelo método ABTS•+ foirealizada pela metodologia descrita por Re et al. (1999), baseada na habilidade dos antioxidantes moleculares tanto lipofílicos, quanto hidrofílicos, em reduzir o radical ABTS•+. O radical ABTS•+foi preparado pela reação de 10 mL da solução de ABTS (7 mM) com 176 μL de solução de persulfato de potássio (140 mM). Essa mistura foi mantida a temperatura ambiente (25°C) no escuro por 12-16 horas. A solução de ABTS•+ foi diluída com álcool etílico até uma absorvância de 0,70 ± 0,05 a 734 nm. Então, 30 μL de cada óleo foi misturado com 3 mL da solução de ABTS•+. A mistura foi agitada em agitador de tubos (QL 901, Qilinbei instruments manufacture, China) colocada no escuro e após 6 min. a absorvância foi medida a λ = 734 nm em espectrofotômetro. A capacidade antioxidante dos óleos foi calculada por uma curva padrão obtida pela medida das absorvâncias da solução de Trolox (50-2000 μM). O resultado foi expresso em μM Trolox/100 g.
O poder antioxidante de redução do ferro (FRAP) foi realizado pela metodologia descrita por Szydlowska-Czerniak et al. (2008) que é baseada na capacidade dos fenóis em reduzir o complexo Fe+3-TPTZ (férrico tripiridiltriazina) ao complexo Fe+2-TPTZ (ferroso tripiridiltriazina) em pH 3,6. Primeiramente, 20 mg do óleo foram misturados com 1000 μL de álccol etílico, em agitador de tubos (QL 901, Qilinbei instruments manufacture, China). Então, 2700 μL do reagente FRAP (25 mL de tampão acetato 0,3 mol/L, pH 3,6; 2,5 mL de solução de 10 mmol do complexo Fe+3-TPTZ em 40 mmol HCl mais 2,5 mL de FeCl3.H2O a 20 mmol) foi misturado com 90 μL da amostra e 270 μL de água destilada. Essa mistura foi mantida por 30 min. em banho maria a 37°C e a absorvância foi medida a λ = 595 nm em espectrofotômetro. Os resultados foram expressos em μM Trolox/100 g.
O experimento foi realizado por meio do delineamento inteiramente casualizado em esquema fatorial (4 Temperaturas x 5 Óleos). Os resultados obtidos das determinações analíticas foram submetidos à análise de variância e as diferenças entre as médias foram testadas a 5% de probabilidade pelo teste de Tukey, por meio do programa ESTAT, versão 2.0 (BANZATTO; KRONKA, 2006).
RESULTADOS E DISCUSSÃO
Propriedades físico-químicas
Com a elevação da temperatura, os óleos estudados apresentaram aumento no índice de acidez, exceto os de linhaça dourada e marrom (Tabela 1). O óleo de chia apresentou maior acidez a 120°C (5,5 mg KOH/g), por outro lado, o de linhaça marrom o menor. O de linhaça dourada não apresentou diferença significativa (p > 0,05) perante o aumento de temperatura, mostrando-se mais estável à degradação hidrolítica.
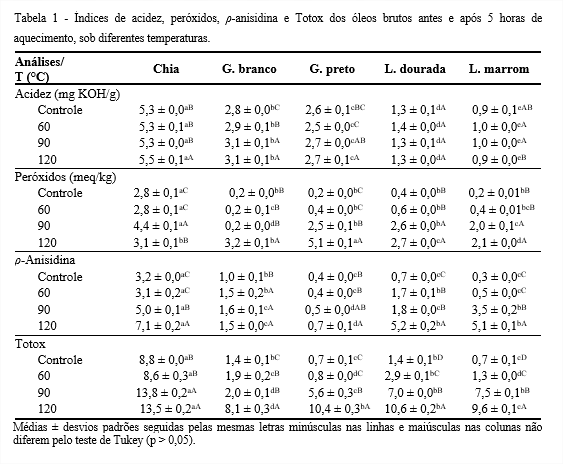
O índice de acidez é uma medida do conteúdo de ácidos graxos livres, um importante parâmetro de qualidade na produção, armazenamento, comercialização de óleos e gorduras comestíveis e no controle oficial de alimentos (SKIERA et al., 2012). O óleo de chia encontra-se fora do limite preconizado pela legislação, que admite até 4 mg KOH/g de acidez para óleos prensados a frio e não refinados (CODEX, 2009), o que reflete sua qualidade inferior como matéria-prima para extração de óleo. As sementes de chia apresentam maior teor de umidade, 6,5%, que aliado a ação das lipases, pode ter favorecido o aumento da acidez.
Com o aumento da temperatura, os óleos apresentaram maior quantidade de peróxidos, exceto o de chia, que oscilou, o que pode ser devido a decomposição dos hidroperóxidos, formação de hidrocarbonetos, ácidos graxos de cadeia curta, radicais livres e compostos voláteis ou, ainda, reações com antioxidantes naturais presentes. O óleo de gergelim preto atingiu maior quantidade de peróxidos a 120°C, 5,1 meq/kg. Kaleem et al. (2015) estudaram 20 óleos a diferentes temperaturas, e constataram que o aquecimento favoreceu o aumento do índice de peróxidos.
Os peróxidos são de natureza transitória e instáveis, seu teor alcança um valor máximo, e se decompõem após sua formação, devido a sua instabilidade, sobretudo com aumento da temperatura (RIBEIRO, 2013).
O Codex Alimentarium Commission (2009) estabelece índice de peróxidos de 15 meq/kg para óleos brutos. Considerando que esse índice é utilizado como um parâmetro de qualidade para avaliar a formação dos compostos de degradação, os óleos em questão, quando submetidos a diferentes temperaturas apresentaram considerável qualidade.
Com a elevação da temperatura, os óleos também apresentaram aumento no teor de p-anisidina. O óleo de chia apresentou maior valor a 120°C (7,1) e os de linhaça dourada e marrom não apresentaram diferença significativa, com valor médio de 5,15. Segundo Guillén e Cabo (2002) e Marina et al. (2009), um óleo de boa qualidade deve apresentar índice de ρ-anisidina inferior a 10. Assim, é possível inferir que os óleos estudados apresentaram boa qualidade. Shahidi e Zhong (2005) relataram que os óleos brutos devem ter índice de p-anisidina de 1 a 3.
O índice de p-anisidina é um parâmetro utilizado para determinar a qualidade dos óleos, quanto à eficiência do processamento e às alterações durante a estocagem (O’BRIEN, 2008). Mensura os produtos de oxidação secundária após a formação de hidroperóxidos, que são aldeídos, cetonas e lactonas, encontrados na maioria dos substratos oxidados. Maiores índices de p-anisidina podem estar relacionados com maiores índices de peróxidos, o que se confirma nesse estudo para o óleo de chia.
Os valores Totox se elevaram com o aumento da temperatura, o óleo de chia a 120°C, obteve maior valor (13,5), enquanto o de gergelim branco o menor (8,1), indicando ser o mais estável e resistente às alterações oxidativas. Berset e Cuvelier (1996) consideram que uma matéria graxa bem conservada deve apresentar Totox inferior a 10. Assim, observa-se que a 120°C, somente os óleos de gergelim branco e linhaça marrom atendem ao limite recomendado por estes autores. De acordo com Matthäus, Haas e Unbehend(2009), o valor Totox limite para óleo de fritura é 30. Assim, os óleos atendem ao limite recomendado (≤ 10), independente das temperaturas estudadas.
O Totox mede tanto hidroperóxidos quanto os produtos de degradação e fornece uma estimativa progressiva da deterioração oxidativa de óleos e gorduras (RIBEIRO, 2013). Uma vez que o valor Totox está associado ao índice de peróxidos e p-anisidina, a variação observada entre os óleos estudados, deve-se a diferentes valores obtidos para estes índices em cada análise.
A Tabela 2 apresenta os resultados da estabilidade oxidativa e compostos polares totais para os fatores Temperaturas e Óleos. Observa-se que o aumento da temperatura não influenciou significativamente (p > 0,05) na estabilidade oxidativa dos óleos, cujo valor médio foi 4,5 h. Dentre os óleos estudados, os de gergelim apresentaram maiores valores para estabilidade oxidativa, sobressaindo o branco com 12,2 h, possivelmente devido a presença de antioxidantes naturais, γ-tocoferol, sesamina, sesamolina e sesamol (GHARBY et al., 2017). Por outro lado, os óleos de chia e linhaça exibiram índices de estabilidade oxidativa abaixo de 1 h. Segundo Michotte et al. (2011), o alto teor de ácidos graxos insaturados do óleo de linhaça, o torna extremamente sensível às reações oxidativas.
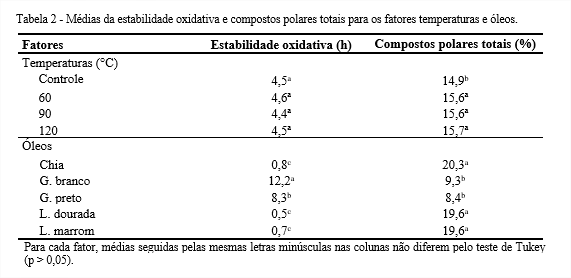
Por se tratarem de óleos brutos, devido a possível presença de compostos interferentes como fosfolipídios e pigmentos, a detecção da redução da estabilidade oxidativa com o aumento da temperatura dos óleos tenha sido dificultada. Os pigmentos naturais, carotenoides e clorofilas, além de conferirem cor característica a tipos específicos de óleos não refinados, podem influenciar na estabilidade oxidativa (Castelo-Branco; Torres, 2011).
A estabilidade oxidativa dos óleos é um indicador importante da qualidade e prazo de validade, favorecendo a sua qualidade nutricional e segurança (Martínez-Cruz; Paredes-López, 2014).
Observa-se, pela Tabela 2, que a temperatura entre 60 e 120°C não influenciou (p > 0,05) o teor dos compostos polares totais, apresentando valores inferiores ao limite estabelecido para descarte de óleos aquecidos, 25% (FREIRE; MANCINI-FILHO; FERREIRA, 2013).
O óleo de chia foi o que apresentou o maior teor de compostos polares (20,3%), seguido pelos óleos de linhaça dourada e marrom que não apresentaram diferença significativa, com valor médio de 19,6%, o que possivelmente se deve ao elevado grau de insaturação. Segundo Ju et al. (2019), os compostos oriundos da oxidação do óleo de fritura, podem perturbar a função hepática através da inibição da taxa de crescimento, promovendo o aumento do fígado e atenuando as enzimas de desintoxicação relacionadas com os mecanismos de defesa contra a peroxidação lipídica in vivo.
A determinação dos compostos polares totais é um dos indicadores mais utilizados para avaliação da qualidade do óleo de fritura, devido a sua importância em relação à saúde pública (CHEN et al., 2013).
Embora a composição de ácidos graxos tenha apresentado pequenas mudanças entre o Controle e 120°C, os óleos de gergelim branco, preto e linhaça dourada não apresentaram diferença significativa (p > 0,05) para ácidos graxos palmítico, oleico, linoleico e α-linolênico (Tabela 3).
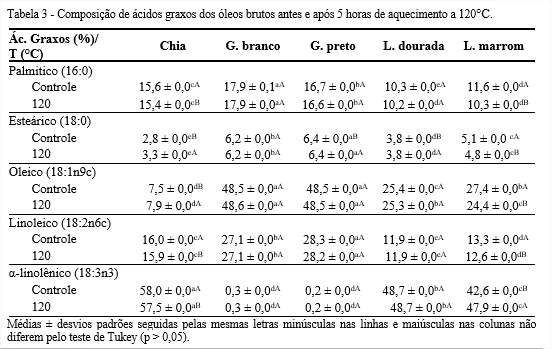
Em relação ao ácido esteárico, o óleo de chia apresentou cerca de 14% de aumento a 120°C, o que possivelmente foi devido a elevação de temperatura que ocasionou a quebra das ligações duplas presentes nos ácidos insaturados, transformando-os em saturados.
Maiores quantidades de ácidos palmítico e oleico foram encontradas nos óleos de gergelim branco e preto, mostrando-se mais estáveis. Pesquisas demonstraram que a presença de ácido oleico na dieta humana diminui os níveis da fração de lipoproteínas de baixa densidade no sangue, a pressão sanguínea, além de melhorar as doenças inflamatórias (Lopez-Huertas, 2010). Elevadas quantidades de ácido oleico nos óleos fazem com que estes sejam desejáveis em termos de nutrição e culinária, representando estabilidade em óleos utilizados para aquecimento. Por outro lado, óleos ricos em ácidos graxos poli-insaturados se oxidam facilmente, quando usados em elevadas temperaturas (BRINKMANN, 2000).
Apesar do óleo de chia, em 120°C, ter apresentado uma redução de ácido α-linolênico, ainda se destacou com a maior quantidade, 57,51%. Considerando a porcentagem desse ácido graxo em óleos comestíveis como canola (5-13%) e soja (4,5-11%) (CODEX, 2009), os óleos de chia e linhaça analisados neste estudo, apresentaram quantidades consideravelmente altas deste ácido graxo essencial, que é muito importante do ponto de vista nutricional, visto que não é produzido pelo ser humano, porém necessário para formação de membranas celulares, vitamina D e muitos hormônios (FRUHWIRTH; HERMETTER, 2007).
Com a elevação da temperatura, os óleos de gergelim (branco e preto) e linhaça dourada não apresentaram diferenças significativas (p > 0,05) nas quantidades de ácidos graxos monoinsaturados e poli-insaturados, demonstrando maior estabilidade (Figura 1). Os óleos estudados são principalmente constituídos de ácidos graxos insaturados, com destaque para os óleos de linhaça, cuja média é 85% do total. Esse perfil é considerado ideal para óleos comestíveis, cuja qualidade e digestibilidade são determinadas pela quantidade e composição de ácidos graxos insaturados, com possível uso para saladas ou na formulação de margarinas (Malacrida; Jorge, 2012).
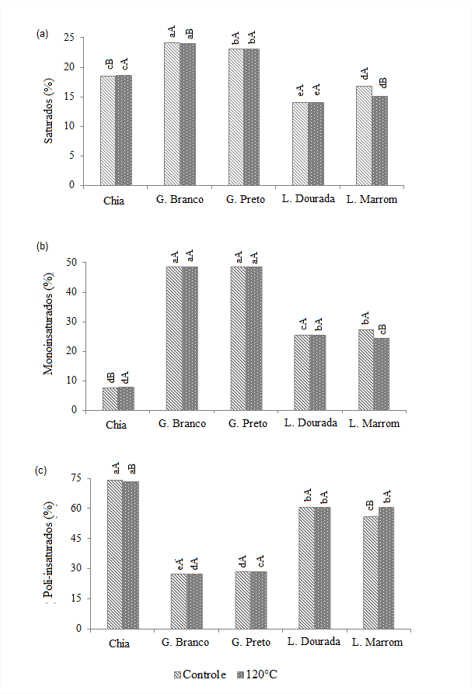
Para cada temperatura, médias seguidas pelas mesmas letras minúsculas não diferem pelo teste de Tukey (p < 0,05).
Para cada óleo, médias seguidas pelas mesmas letras maiúsculas não diferem pelo teste de Tukey (p < 0,05). Controle = temperatura média de 25oC.
Observa-se na Tabela 4 que os teores de carotenoides dos óleos Controle variaram de 4,1 a 128,4 μg/g para os óleos de gergelim preto e branco, respectivamente. Com a elevação da temperatura, os óleos apresentaram decaimento significativo (p ≤ 0,05) nos teores de carotenoides totais até 90°C. Entre 90 e 120°C, os óleos de chia, gergelim preto e linhaça marrom não apresentaram diferença significativa (p > 0,05). O óleo de gergelim branco, independentemente da temperatura, apresentou maiores valores, podendo contribuir para prevenção da oxidação lipídica.
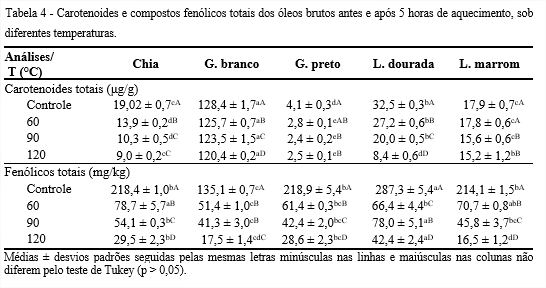
Os óleos de gergelim branco e linhaça marrom apresentaram, a 120°C, retenções de 94 e 85% de carotenoides, respectivamente. A elevada retenção para o gergelim branco se deveu, provavelmente, pela presença de 48% de ácido oleico.
Esses conteúdos diferentes de carotenoides entre as variedades de sementes são comuns, visto que possuem coloração e, consequentemente, são constituídos por pigmentos distintos. De acordo com Rafalowski et al. (2008), o β-caroteno está presente em maiores concentrações nos óleos prensados a frio, quando comparados aos óleos refinados, visto que durante o processamento há perda desse composto. Enfatizam, ainda, que a sua presença é importante por ser um efetivo antioxidante natural.
A síntese e acúmulo de carotenoides em alimentos de origem vegetal é variável em função da espécie, variedade, manejo, condições climáticas, estádio de maturação e condições de armazenamento (FERREYRA et al., 2007). Devido à estrutura altamente insaturada, os carotenoides são propensos à degradação durante o processamento, armazenamento, exposição à luz e ao aumento de temperatura (ACHIR et al., 2010).
Os compostos fenólicos totais para os óleos Controle variaram de 135,1 mg/kg para o de gergelim branco a 287,3 mg/kg para o de linhaça dourada (Tabela 4). De acordo com Kasote (2013), a linhaça é rica em diferentes tipos de fenólicos, como lignanas, ácidos fenólicos, flavonóides, fenilpropanóides e taninos. Por outro lado, o gergelim branco apesar de apresentar menor quantidade, possui outros compostos antioxidantes, como os carotenoides.
Os teores de fenólicos totais reduziram significativamente (p ≤ 0,05) com o aumento da temperatura para os óleos estudados, exceto para o de linhaça dourada, que apresentou oscilações. Em 120°C, o óleo de linhaça dourada se sobressaiu com maior valor (42,4 mg/kg), seguido pelos de chia e gergelim preto e apresentaram retenções, em torno de 13% de compostos fenólicos.
Réblová (2012) estudou a influência da temperatura sobre a capacidade antioxidante de compostos fenólicos, que diminuiu com o aumento da temperatura, na faixa de 90 a 150°C. A decomposição térmica tem sido apontada como a maior causadora da redução do conteúdo de polifenóis (MOURE et al., 2000). Ainda, segundo Conde et al. (1998), o conteúdo total de fenólicos diminui com o aumento da temperatura, o que foi observado nesse estudo.
Segundo Franco et al. (2014), a quantidade de compostos fenólicos totais nos azeites virgens de oliva de sete variedades, apresentam variações, mesmo entre cultivares de mesma espécie. Uma série de processos metabólicos, tais como reações químicas e enzimáticas ocorrem, e induzem a produção de fenóis livres e variações no teor de compostos fenólicos totais.
Freitas e Jorge (2021), estudando os óleos brutos de soja, canola, milho e girassol, encontraram teores de compostos fenólicos totais que variaram de 130,62 a 337,07 mg/kg, corroborando com os resultados obtidos para os óleos Controle, investigados nesse estudo.
Conforme Tabela 5, os isômeros α-, β-, γ- e δ-tocoferóis foram identificados nos óleos submetidos às diferentes temperaturas, sendo os isômeros β- e δ-tocoferóis somente nos óleos de linhaça (dourada e marrom) e chia, respectivamente. Em contrapartida, o γ-tocoferol foi encontrado em todos os óleos como sendo o majoritário, no entanto, em quantidades significativas nos de gergelim (1897,8 e 1850,9 mg/kg, branco e preto, respectivamente), equivalendo, em média, a 72% do total. Diferentemente do encontrado por Gharby et al. (2017), que identificaram em seus estudos, o γ-tocoferol com 90% do total de tocoferóis no óleo de gergelim. Tal diferença pode ser justificada por se tratar de sementes de diferentes variedades e locais de cultivo. Fatores ambientais que podem influenciar a composição das sementes, incluem temperatura, luz, composição do solo, etc. Os óleos de gergelim branco e preto foram os únicos que apresentaram α-tocoferol. Este isômero possui maior atividade biológica, em relação aos demais, sendo recomendado para o consumo.
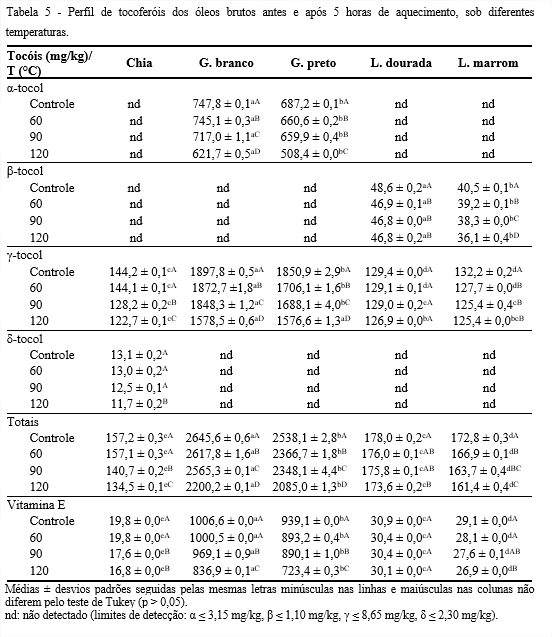
Com o aumento da temperatura houve redução da concentração dos isômeros, exceto o γ-tocoferol do óleo de linhaça dourada, o que pode ser atribuído pela presença de outros compostos antioxidantes, como compostos fenólicos que promovem a proteção oxidativa deste óleo.
Segundo Lampi, Kamal-Eldin e Piironen (2002), agentes oxidantes, especialmente, calor, luz, metais e álcalis oxidam facilmente os tocoferóis totais. Tocoferóis e vitamina E decresceram perante o aumento da temperatura, devido a ação de agentes oxidantes, exceto a linhaça dourada, que apresentou, a 120°C, retenções de 97% de tocoferóis totais e vitamina E.
Capacidade antioxidante
Os óleos submetidos ao aumento de temperatura demonstraram capacidade sequestradora do radical DPPH• (Tabela 6). Com a elevação da temperatura, os óleos estudados, exceto o de gergelim branco, apresentaram aumento na capacidade antioxidante, devido uma possível superestimação. A presença de interferentes, por se tratar de óleos brutos, superestimam o valor do percentual de remoção do DPPH• que apresenta absorvância máxima na mesma região espectral de outros compostos (HUANG; OU; PRIOR, 2005). O óleo de chia apresentou oscilações, possivelmente por causa da estequiometria da reação do DPPH• que difere com o tipo de antioxidante, ou seja, pode ser de 2:1 ou 3:1 (radical/antioxidante), dependendo da quantidade de grupos hidroxilas (ARNAO, 2000).
Os óleos de gergelim preto e os de linhaça não apresentaram diferença significativa (p > 0,05) para capacidade antioxidante a 120°C, com cerca de 80%. Extratos com capacidade antioxidante pelo método DPPH• com cerca de 70% são considerados efetivos, enquanto os com capacidade entre 60-70% são classificados com ação moderada e menor do que 60% são considerados com pouca capacidade antioxidante (MENSOR et al., 2001; LUZIA; JORGE, 2014). Desta forma, os óleos brutos de gergelim preto e os de linhaça deste estudo podem ser considerados efetivos quanto à capacidade antioxidante. Esses óleos demonstraram atividade sequestradora do radical DPPH• superior a 50%, no entanto, inferior ao óleo de soja refinado (94,60%) (VERONEZI; JORGE, 2018). Isso acontece, devido a remoção parcial ou total de carotenoides e clorofilas, no processo de refino, presentes no óleo bruto, que agem como pró-oxidantes (CHAIYASIT et al., 2007; CASTELO-BRANCO; TORRES, 2011).
Segundo Castelo-Branco e Torres (2011) é importante combinar ao menos dois ou mais ensaios para a obtenção de informações mais completas quanto à capacidade antioxidante de óleos vegetais, cuja determinação dependerá do radical livre ou oxidante. Também deve ser considerado o processo de obtenção do óleo, a composição físico-química, que pode estar associada a atributos de qualidade dos óleos, a sua bioatividade e, possivelmente, a sua estabilidade oxidativa.
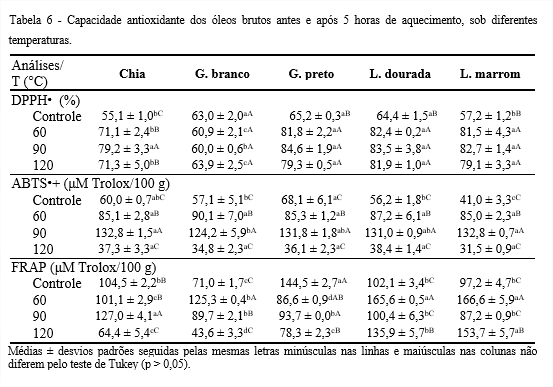
O ensaio do DPPH• é o mais amplamente utilizado para a determinação da capacidade antioxidante em diferentes óleos vegetais, mede a captação de um radical por meio da diminuição da absorvância, que acontece devido a redução de um antioxidante ou por reação com radicais.
Os resultados para capacidade antioxidante podem ser expressos de várias formas, como equivalente de trolox, eficiência antirradical, porcentagem de inibição da oxidação, concentração eficiente, o que limita e dificulta a comparação entre as amostras, devido a diferentes valores de capacidade antioxidante, além dos diferentes protocolos analíticos.
Bodoira et al. (2017) utilizando tolueno como solvente, determinou a capacidade antioxidante de óleo de chia pelo método DPPH•, e o valor obtido foi inferior ao encontrado nesse estudo, comparação que deve ser feita com ressalvas, devido ao solvente utilizado.
Em estudo com óleos comestíveis de oliva, girassol, soja, linhaça, milho, gergelim, entre outros, foram testados os solventes n-hexano, clorofórmio, acetona, éter de petróleo e acetato de etila, para determinação da capacidade antioxidante pelo método DPPH•. Os melhores resultados obtidos foram para o acetato de etila, utilizado no presente estudo (ESPÍN; SOLER-RIVAS; WICHERS, 2000).
Quanto à capacidade antioxidante pelo método ABTS•+, com a elevação da temperatura, os óleos estudados apresentaram oscilações, possivelmente devido a reação do radical ABTS•+ com os compostos fenólicos em duas etapas, o que leva a alteração da sua concentração, que desaparece no sistema de medição devido à sua redução e degradação (OSMAN; WONG; FERNYHOUGH, 2006). A capacidade antioxidante dos óleos Controle, pelo ensaio ABTS•+, variou de 41 a 68,1 μM Trolox/100 g, superior a encontrada para as cinco marcas de óleos de soja brutos (14,82 a 28,60 μM Trolox/100 g) (FREITAS; JORGE, 2021).
Pelo método FRAP, com a elevação da temperatura, os óleos em questão apresentaram oscilações, que se devem à presença de pró-oxidantes, por se tratarem de óleos brutos. Dependendo da concentração dos carotenoides presentes, especialmente quando a concentração de oxigênio no meio é elevada, são convertidos em pró-oxidantes. A energia luminosa absorvida por esses pigmentos pode ser transferida para o oxigênio triplete, transformando-o em singlete, que é um agente oxidante mais reativo (CARIS-VEYRAT, 2007; CASTELO-BRANCO; TORRES, 2011). A capacidade antioxidante dos óleos Controle variou de 71 a 144,5 (μM Trolox/100 g), próximos aos encontrados por Saura-Calixto e Goñi (2006), para óleos brutos de oliva e girassol, 152 e 65,3 μM Trolox/100 g, respectivamente. O óleo de linhaça marrom se destacou, com a maior capacidade antioxidante, 153,7 μM Trolox/100 g, seguido pelo de linhaça dourada, 135,9 μM Trolox/100 g, a 120°C, possivelmente por apresentarem os maiores teores de compostos fenólicos.
Szydlowska-Czerniak et al. (2008), em estudo com diferentes óleos vegetais sobre avaliação da capacidade antioxidante pelo método de FRAP, encontraram valores de 39,5-339,6 μmol sulfato ferroso/100 g, próximos dos valores encontrados nesse estudo. Segundos os autores, o ensaio FRAP tem sido utilizado principalmente para determinação da capacidade antioxidante na fração polar de óleos vegetais ricos em compostos fenólicos, como azeite de oliva e óleo de canola. O reagente do ensaio FRAP é incompatível com os solventes orgânicos utilizados para dissolver óleos ou sua fração apolar.
É possível que óleos vegetais prensados a frio apresentem teores igualmente elevados de compostos fenólicos, os quais podem apresentar importante papel como determinantes da capacidade antioxidante (CASTELO-BRANCO; TORRES, 2011), o que pode ser observado no presente estudo para os óleos investigados.
CONCLUSÕES
Os óleos submetidos às diferentes temperaturas apresentaram aumento nos índices de acidez, peróxidos e ρ-anisidina, mas ainda assim, atenderam aos limites preconizados pela legislação, com exceção do óleo de chia que mostrou degradação hidrolítica. Por outro lado, os de gergelim se destacaram pela maior estabilidade oxidativa (média = 10 h) e menor teor de compostos polares totais (média = 9%).
Os óleos de gergelim e chia, em 120°C, se destacaram com maiores quantidades dos ácidos linoleico (27%) e α-linolênico (57%), respectivamente, considerados ácidos graxos essenciais importantes para a saúde. Com a elevação da temperatura, os óleos de gergelim (branco e preto) apresentaram maiores quantidades de ácidos graxos saturados e monoinsaturados e menores teores de poli-insaturados, demonstrando maior estabilidade oxidativa.
Os teores de carotenoides e compostos fenólicos totais decaíram com o aumento da temperatura. A maior retenção de carotenoides totais, em 120°C, foi observada para o óleo de gergelim branco (94%), enquanto a retenção nos óleos para compostos fenólicos foi, apenas 13%. Os tocoferóis totais decresceram perante o aumento da temperatura. Em 120°C, os óleos de gergelim branco e preto se sobressaíram, apresentando quantidades significativas, 2200,2 e 2085,0 mg/kg, respectivamente. Os óleos mostraram significativa capacidade antioxidante, embora com a elevação da temperatura apresentaram oscilações.
Assim, concluiu-se que os óleos de chia, gergelim e linhaça podem ser utilizados na indústria alimentícia para produção de molhos, maioneses, cremes vegetais, etc. e na gastronomia quando submetidos às temperaturas de 60, 90 e 120°C/5 h, sobretudo os de gergelim que se sobressaíram pela estabilidade termoxidativa e maiores quantidades de compostos bioativos.
AGRADECIMENTOS
Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelas bolsas de doutorado e produtividade em pesquisa, respectivamente.
REFERÊNCIAS
ACHIR, N.; RANDRIANATOANDRO, V. A.; BOHUON, P.; LAFARGUE, A.; AVALLONE, S. Kinetic study of β‐carotene and lutein degradation in oils during heat treatment. European Journal of Lipid Science and Technology, Weinheim, v. 112, n. 3, p. 349-361, 2010.
AMERICAN OIL CHEMITS’ SOCIETY (AOCS). Official methods and recommended practices. 6. ed. Champaing, 2009.
ARNAO, M. B. Some methodological problems in the determination of antioxidant activity uusing chromogen radicals: a practical case. Trends Food Science and Technology, Norwich, v. 11, n. 1, p. 419-421, 2000.
ARAÚJO, J. M. A. Química de alimentos: teoria e prática. 7a ed. Viçosa: Editora UFV, 2019. 666 p.
BANZATTO, D. A.; KRONKA, S. N. Experimentação agrícola. 4. ed. Jaboticabal: Funep, 2006. 237 p.
BERNACCHIA, R.; PRETI, R.; VINCI, G. Chemical composition and health benefits of flaxseed. Austin Journal of Nutrition and Food Science, Austin,v. 2, n. 8, p. 1045, 2014.
BERSET, C.; CUVELIER, M. E. Methods of estimating the degree of lipid oxidation and of measuring antioxidizing power. Sciences des Aliments, Dijon, v. 16, n. 3, p. 219-245, 1996.
BODOIRA, R. M.; Penci, M. C.; Ribotta, P. D.; Martínez, M. L. Chia (Salvia hispanica L.) oil stability: study of the effect of natural antioxidants. LWT – Food Science and Technology, London, v. 75, p. 107-113, 2017.
BRINKMANN, B. Quality criteria of industrial frying oils and fats. European Journal of Lipid Science and Technology, Weinheim, v. 102, n. 8-9, p. 539-541, 2000.
CARIS-VEYRAT, C. Antioxidant and prooxidant actions and stabilities of carotenoids in vitro and in vivo and carotenoid oxidation products. In: SOCACIU, C. Food colorants: chemical and function properties. Washington: CRC Press, 2007. p. 177-195.
CASTELO-BRANCO, V. N.; TORRES, A. G. Capacidade antioxidante total de óleos vegetais comestíveis: determinantes químicos e sua relação com a qualidade dos óleos.Revista de Nutrição, Campinas, v. 24, n. 1, p. 173-187, 2011.
CHAIYASIT, W.; ELIAS, R. J.; MCCLEMENTS, D. J.; DECKER, E. A. Role of physical structures in bulk oils on lipid oxidation. Critical Reviews in Food Science and Nutrition, Cleveland, v. 47, n. 3, p. 299-317, 2007.
CHEN, W. A.; CHIU, C. P.; CHENG, W. C.; HSU, C. K.; KUO, M. I. Total polar compounds and acid values of repeatedly used frying oils measured by standard and rapid methods. Journal of Food and Drug Analysis, Philadelphia,v. 21, n. 1, p. 58-65, 2013.
CHOE, E.; MIN, D. B. Mechanisms and factors for edible oil oxidation. Comprehensive Reviews in Food Science and Food Safety, Chicago, v. 5, n. 4, p. 169-186, 2006.
CODEX ALIMENTARIUM COMMISSION. Codex stan 210-1999: codex standard for named vegetable oils. Rome, 2009.
COELHO, S.; SALAS-MELLADO, M. M. Chemical characterization of chia (Salvia hispanica L.) for use in food products.Journal of Food and Nutrition Research, Jakarta, v. 2. n. 5, p.263-269, 2014.
CONDE, E.; CADAHIA, E.; GARCIA-VALLEJO, M.C.; SIMON, B. F. Polyphenolic composition of Quercus suber cork from different Spanish provenances. Journal of Agricultural and Food Chemistry, Easton, v. 46, n. 8, p. 3166-3171, 1998.
ESPÍN, J. C.; SOLER-RIVAS, C.; WICHERS, H. Characterization of the total free radical scavenger capacity of vegetable oils and oil fractions using 2,2-diphenyl-1-1-picrylhydrazyl radical. Journal of Agricultural and Food Chemistry, Easton, v. 48, n. 3, p. 648-656, 2000.
FERREYRA, R. M.; VIÑA, S. Z.; MUGRIDGE, A.; CHAVES, A. R. Growth and a ripening season effects on antioxidant capacity of strawberry cultivar Selva. Scientia Horticulturae, Amsterdam, v. 112, n. 1, p. 27-32, 2007.
FRANCO, M. N.; Galeano-Díaz, T.; López, O.; Fernández-Bolaños, J. G.; Sánchez, J.; De Miguel, C.; Gil, M. V.; Martín-Vertedor, D. Phenolic compounds and antioxidant capacity of virgin olive oil. Food Chemistry, London, v. 163, p. 289-298, 2014.
FREIRE, P. C. M.; MANCINI-FILHO, J.; FERREIRA, T. A. P. C. Principais alterações físico-químicas em óleos e gorduras submetidos ao processo de fritura por imersão: regulamentação e efeitos na saúde. Revista de Nutrição, Campinas, v. 26, n. 3, p. 353-368, 2013.
FREITAS, I. R.; JORGE, N. Avaliação dos compostos bioativos de óleos brutos de soja, canola, milho e girassol. In: CORDEIRO, C. A. M.; SILVA, E. M.; EVANGELISTA-BARRETO, N. S. (eds.). Ciência & Tecnologia de Alimentos: Pesquisas e Práticas Contemporâneas. São Paulo: Editora Científica Digital, 2021, p. 193-210.
FRUHWIRTH, G. O.; HERMETTER, A. Seeds and oil of the Styrian oil pumpkin: components and biological activities. European Journal of Lipid Science and Technology, Weinheim, v. 109, n 11, p. 1128-1140, 2007.
GHARBY, S.; HARHAR, H.; BOUZOUBAA, Z.; ASDADI, A.; EL YADINI, A.; CHARROUF, Z. Chemical characterization and oxidative stability of seeds and oil of sesame grown in Morocco. Journal of the Saudi Society of Agricultural Sciences, Amsterdam, v. 16, p. 105-111, 2017.
GUILLÉN, M. D.; CABO, N. Fourier transform infrared spectra data versus peroxide and anisidine values to determine oxidative stability of edible oils. Food Chemistry, London, v.77, n. 4, p. 503-510, 2002.
HUANG, D.; OU, B.; PRIOR, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry, Easton, v. 53, n. 6, p. 1841-1856, 2005.
IMRAN, M.; NADEEN, M.; MANZOOR, M. F. JAVED, A.; ALI, Z.; AKLTAR, M. N.; ALI, M.; HUSSAIN, Y. Fatty acids characterization, oxidative perspectives and consumer acceptability of oil extracted from pre-treated chia (Salvia hispanica L.) seeds. Lipids in Health and Disease, London, v. 15, n. 1, p. 162, 2016.
Ju, J.; Zheng Z.; Xu, Y. J.; Cao, P.; Li, J.; Li, Q.; Liu, Y. Influence of total polar compounds on lipid metabolism, oxidative stress and cytotoxicity in HepG2 cells. Lipids in Health and Disease, London, v.18, n. 37, p. 1-13, 2019.
KALANTZAKIS, G.; BLEKAS, G.; PEGKLIDOU, K.; BOSKOU, D. Stability and radical-scavenging activity of heated olive oil and other vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, n. 4, p. 329-335, 2006.
Kaleem, A., Aziz, S.; Iqtedar, M.; Abdullah, R.; Aftab, M.; Rashid, F.; Shakoori, F. R.; Naz, S. Investigating changes and effect of peroxide values in cooking oils subject to light and heat. Fuuast Journal of Biology, Pakistan, v. 5, n. 2, p. 191-196, 2015.
KASOTE, D. M. Flaxseed phenolics as natural antioxidants. International Food Research Journal,Selangor, v. 20, n. 1, p. 27-34, 2013.
LAMPI, A. M.; KAMAL-ELDIN, A.; PIIRONEN, V. Chapter 1. In: SHI, J.; MAZZA, G.; MAGUER, M, L. (eds.). Functional foods, biochemical and processing aspects: tocopherols and tocotrienols from oil and cereal grains. Boca Raton: CRC Press, 2002.
LOPEZ-HUERTAS, E. Health effects of oleic acid and long chain omega-3 fatty acids (EPA and DHA) enriched milks. A review of intervention studies. Pharmacological Research, Milano, v. 61, n.1 p. 200-207, 2010.
LUZIA, D. M. M.; JORGE, N. Study of antioxidant activity of non-conventional Brazilian fruits. Journal of Food Science and Technology, Oxford, v. 51, n. 6, p.1167-1172, 2014.
Malacrida, C. R.; Jorge. N. Yellow passion fruit seed oil (Passiflora edulis f. flavicarpa): physical and chemical characteristics. Brazilian Archives Biology and Technology, Curitiba, v. 55, n. 1, p.127-134, 2012.
McLAUGHLIN, P. J.; WEIHRAUCH, J. L. Vitamin E content of foods. Journal of the American Dietetic Association, Chicago, v. 75, n. 6, p. 647-665, 1979.
MARINA, A. M.; CheMan, Y. B.; Nazimah, S. A. H.; Amin, I. Chemical properties of virgin coconut oil. Journal of the American Oil Chemists’ Society, Chicago, v. 86, n. 4, p. 301-307, 2009.
MARTÍNEZ-CRUZ, O.; PAREDES-LÓPEZ, O. Phytochemical profile and nutraceutical potential of chia seeds (Salvia hispanica L.) by ultra high performance liquid chromatography. Journal of Chromatography A, Amsterdam, v. 1346, p. 43-48, 2014.
MATTHÄUS, B., HAASE, N. U.; UNBEHEND, G. Chemical and sensory characteristics of products fried in high-oleic, low-linolenic rapeseed oil. Journal of the American Oil Chemists’ Society, Chicago, v. 86, n. 8, p.799-808, 2009.
MENSOR, L. L.; MENEZES, F. S.; LEITÃO, G. G.; REIS, A. S.; SANTOS, T. C.; COUBE, C. S.; LEITÃO, S. G. Screnning of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Phytotherapy Research, New Jersey, v. 15, n. 2, p.127-130, 2001.
Michotte, D.; Rogez, H.; Chirinos, R.; Mignolet, E.; Campos, D.; Larondelle, Y. Linseed oil stabilization with pure natural phenolic compounds. Food Chemistry, London,v.129, n. 3, p. 1228-1231, 2011.
MOURE, A.; Franco, D.; Sineiro, J.; Domínguez, H.; Núñez, M. J.; Lema, J. M. Evaluation of extracts from Gevuina avellanahulls as antioxidants. Journal of Agricultural and Food Chemistry, Easton, v. 48, n. 9, p. 3890-3897, 2000.
O’BRIEN, R. D. Fats and oils: formulating and processing for applications. 3. ed. Boca Raton: CRC Press, 2008. 680 p.
OSMAN, A. M.; WONG, K. K. Y.; FERNYHOUGH, A. ABTS radical driven oxidation of polyphenols: isolation and structural elucidation of covalent adducts. Biochemical and Biophysical Research Communications, Padua, v. 346, n. 1, p. 321-329, 2006.
PARRY, J. W.; SU, L.; LUTHER, M.; ZHOU, K.; YURAWECZ, M. P.; WHITTAKER, P.; YU, L.; Fatty acid composition and antioxidant properties of cold-pressed marionberry, boysenberry, red raspberry, and blueberry seed oils. Journal of Agricultural and Food Chemistry, Easton, v. 53, n. 3, p. 566-573, 2005.
PEREIRA DE ABREU, D. A.; Losada, P. P.; Maroto, J.; Cruz, J. M. Evaluation of the effectiveness of a antioxidants (from barley husks) that retard lipid damage in frozen atlantic salmon (Salmo salar L.). Food Research International, Barking,v. 43, n. 5, p.1277-1282, 2010.
POPA, V. M.; Gruia, A.; Raba, D. N.; Dumbrava, D.; Moldovan, C.; Bordean, D., Mateescu, C. Fatty acids composition and oil characteristics of linseed (Linum Usitatissimum L.) from Romania. Journal of Agroalimentary Processes and Technologies, Timisoara, v. 18, n. 2, 2012.
RAFALOWSKI, R.; Zegarska, Z.; Kuncewicz, A.; Borejszo, Z. Fatty acid composition, tocopherol and ß-carotene content in polish commercial vegetable oils. Pakistan Journal Nutrition, Faisalabad, v. 7, p. 278-282, 2008.
RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A.; YANG, M.; RICE-EVANS, C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology & Medicine, Los Angeles, v. 26, n. 9, p. 1231-1237, 1999.
Réblová, Z. Effect of temperature on the antioxidant activity of phenolic acids. Czech Journal of Food Sciences, Prague, v. 30, n. 2, p.171-175, 2012.
RIBEIRO, P. C. E. Avaliação da qualidade oxidativa de margarinas adicionadas de extratos de casca de noz-pecã (Carya illinoinensis (Wangenh) C. Koch) e de alecrim (Rosmarinus officinallis). 2013. 108 f. Dissertação (Mestrado em Ciência de Alimentos) – Centro de Ciências Agrárias, Universidade Federal de Santa Catarina, Florianópolis, 2013.
RODRIGUEZ-AMAYA, D. B. A guide to carotenoids analysis in food. Washington: ILSI Press, 2001. 64 p.
SAURA-CALIXTO, F.; GOÑI, I. Antioxidant capacity of the Spanish mediterranean diet. Food Chemistry, London, v. 94, n. 3, p. 442-447, 2006.
SHAHIDI, F.; ZHONG, Y. Lipid oxidation: measurement methods. In: SHAHIDI, F. (ed.). Bailey’s industrial oil and fat products. Newfoundland: John Wiley & Sons, 2005. p. 357-386.
SHAHIDI, F.; ZHONG, Y. Lipid oxidation and improving the oxidative stability. Chemical Society Reviews, London, v. 39, n. 11, p. 406-4079, 2010.
SINGLETON, V. L.; ROSSI, J. A. Colorimetry of total phenolics with phosphomolybdic and phosphotungstic acid reagents. American Journal of Enology and Viticulture, Davis, v. 16, n. 3, p. 144-158, 1965.
SKIERA, C.; Steliopoulos, P.; Kuballa, T.; Holzgrabe, U.; Diehl, B. Determination of free fatty acids in edible oils by 1H NMR spectroscopy. Lipid Technology, High Wycombe, v. 24, n. 12, p. 279-281, 2012.
SZYDLOWSKA‐CZERNIAK, A.; KARLOVITS, G.; DIANOCZKI, C.; RECSEG, K.; SZLYK, E. Comparison of two analytical methods for assessing antioxidant capacity of rapessed and olive oils. Journal of the American Oil Chemists’ Society, Chicago, v. 85, n. 2, p. 141-149, 2008.
THODE FILHO, S.; Cabral, G. B.; Maranhão, F. S.; Sena, M. F. M.; Silva, E. R. Deterioração de óleos vegetais expostos a diferentes condições de armazenamento. Revista Eletrônica em Gestão, Educação e Tecnologia Ambiental, Santa Maria, v. 18, p. 7-13, 2014.
TUNDE-AKINTUNDE, T. Y; OKE, M. O; AKINTUNDE, B. O. Sesame seed. In: AKPAN, U. G. (ed.). Oilseeds. Rijeka: InTech, 2012. p. 81-98.
VERONEZI, C. M.; JORGE, N. Effect of Carica papaya and Cucumis melo seed oils on the soybean oil stability. Food Science and Biotechnology, Seoul, v. 27, n. 4, p. 1031-1040, 2018.
