
EXTRAÇÃO SUPERCRÍTICA PARA OBTENÇÃO DE COMPOSTOS FENÓLICOS: REVISÃO
Capítulo de livro publicado no livro do VIII ENAG E CITAG. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062046-69
Este trabalho foi escrito por:
Lucas Monteiro Bezerra Pinheiro *; Ivânia Samara dos Santos Silva ; Maria Carla Candido da Silva ; Débora Ferreira Silva ; Maria Eduarda Josué da Silva; Haíssa Roberta Cardarelli ; Carolina Lima Cavalcanti de Albuquerque
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Os compostos fenólicos são metabólitos secundários das plantas, e por sua característica antioxidante podem desempenhar funções na prevenção do câncer e de doenças cardiovasculares quando ingeridos pelos seres humanos. A principal classe de compostos fenólicos são os flavonóides, que estão presentes em diversos vegetais. Para a extração desses compostos tradicionalmente utiliza-se solventes orgânicos em alta temperatura, que possuem a desvantagem de deixar resíduos tóxicos dos solventes no produto, além de ser demorado e degradar os compostos pelo calor excessivo. A extração por fluido supercrítico (SFE – “Supercritical Fluid Extraction”) é um método alternativo que vem mostrando-se viável para a extração de compostos fenólicos, pois trata-se de um método que pode usar menos energia, ser ecologicamente mais sustentável, possuir um tempo de processamento curto, além de ter um produto com ausência de resíduos de solventes nos extratos. Este trabalho trata-se de uma revisão da literatura que utilizou as bases de dados Google acadêmico, Science Direct e Scielo para analisar artigos a respeito da extração supercrítica de compostos fenólicos com o objetivo identificar os principais fenólicos alvo nesse método de extração.
Palavras–chave: compostos fenólicos; extração supercrítica; flavonoides
Abstract: Phenolic compounds are secondary metabolites of plants, and due to their antioxidant characteristics, they can play a role in the prevention of cancer and cardiovascular diseases when ingested by humans. The main class of phenolic compounds are flavonoids, which are present in many plants. For the extraction of these compounds, organic solvents are traditionally used at high temperatures, which have the disadvantage of leaving toxic residues of the solvents in the product, in addition to being time consuming and degrading the compounds by excessive heat. Supercritical Fluid Extraction (SFE – “Supercritical Fluid Extraction”) is an alternative method that has proven to be viable for the extraction of phenolic compounds, as it is a method that can use less energy, be more ecologically sustainable, have a short processing time, in addition to having a product with no solvent residues in the extracts. This work is a literature review that used the Google Academic, Science Direct and Scielo databases.
to analyze articles about the supercritical extraction of phenolic compounds in order to identify the main target phenolics in this extraction method.
Keywords: flavonoids; phenolic compounds; supercritical extraction
INTRODUÇÃO
Os compostos fenólicos, grupo formado por mais de 8000 substâncias, são metabólitos secundários abundantes em plantas, sendo fundamentais no metabolismo, proteção contra patógenos, regulação do crescimento, dentre outros (1). Essas substâncias bioativas, por apresentarem atividade antioxidante, dificultam a formação de radicais livres e retardam processos oxidativos em de seres vivos, possuindo potenciais benefícios à saúde como proteção contra doenças cardiovasculares e câncer (2).
A extração de compostos fenólicos por fluido supercrítico (SFE – “Supercritical Fluid Extraction”) é um método alternativo para substituir os métodos convencionais de extração. Existem muitas desvantagens e dificuldades associadas aos métodos tradicionais de extração. Esses métodos, como o Soxhlet, requerem grandes quantidades de solventes orgânicos e são muito demorados. Além disso, eles podem causar degradação dos compostos insaturados devido ao calor excessivo e deixam resíduos tóxicos de solventes no produto. Há uma demanda crescente por novos métodos de extração com tempos de extração mais rápidos, baixo consumo de solvente e sem poluição. Uma vantagem do SFE é que ele pode usar menos energia do que os métodos tradicionais, seu produto é de alta qualidade devido à ausência de solventes nos extratos e o tempo de processamento é curto (3).
Este trabalho de revisão possui o objetivo de identificar os principais fenólicos alvo na extração por fluido supercrítico.
Compostos fenólicos
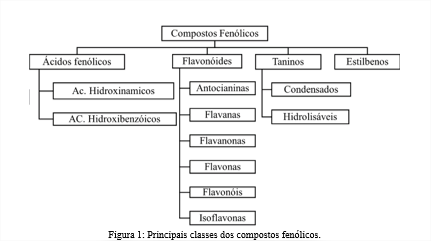
A estrutura dos compostos fenólicos é caracterizada pela presença de ao menos um anel aromático tendo um ou mais grupos hidroxilas (OH), e pode variar desde estruturas simples como a Vanilina, até moléculas complexas como os Flavonóides (4). São classificados com base no número de anéis aromáticos que possuem nos elementos estruturais que ligam esses anéis uns aos outros. Podem ser divididos em: Ácidos fenólicos, Flavonóides, Taninos e Estilbenos. (1). As divisões e subdivisões podem ser observadas na Figura 1.
Os Flavonóides são considerados a maior classe de compostos fenólicos e estão presentes em frutas comestíveis, vegetais folhosos, raízes, tubérculos, bulbos, ervas, temperos, legumes, chás, café e vinho tinto (5). Derivam-se da biossíntese do aminoácido aromático (fenilalanina) e do ciclo de Krebs (acetil coa), e são utilizados pelas plantas em várias situações. Um exemplo é a sua participação na fixação simbiótica do nitrogênio. As plantas requerem uma fonte reduzida de nitrogênio no solo ou na presença de bactérias (Rhizobium) redutores de nitrogênio, pois são incapazes de absorvê-lo na forma de nitrogênio gasoso (N2). Portanto, raízes exsudam substâncias flavonóides, que induzem ou reprimem os genes chave (nod) nas bactérias redutores de nitrogênio, o que torna possível a penetração dessas bactérias na raiz da planta; portanto, na sua ausência, a fixação do nitrogênio não ocorre (6).
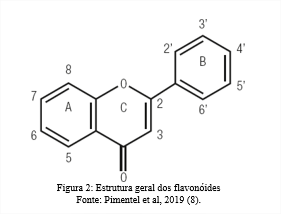
A estrutura básica dos flavonóides caracteriza-se por moléculas com 15 átomos de carbono do tipo 2-fenil benzopirona, eles podem ser distinguidos entre sim por meio do grau de oxidação do seu grupo pirano (7). Os grupos hidroxila (OH) são encontrados preferencialmente nos carbonos 4, 5 e 7, e a maioria dos flavonóides de ocorrência natural são glicosídios, isto é, apresentam açúcar na molécula, sua estrutura geral está demostrada na Figura 2. A presença de grupos hidroxila e açúcares aumenta as propriedades hidrofílicas da molécula, enquanto a ligação com ésteres metílicos ou unidades modificadas de isopentenil aumenta as características hidrofóbicas (6).
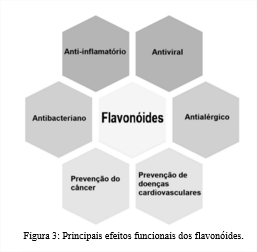
Os Flavonóides são os polifenóis mais comuns nas plantas, são altamente cobiçados pela indústria devido à sua capacidade biológica e benefícios à saúde (9). Dentre as suas funcionalidades bioativas se destacam a capacidade antioxidante, sendo capaz de eliminar os radicais livres, na quelação de metais pró oxidantes e regenerar moléculas antioxidantes, o que pode estar interligado com a diminuição dos riscos e incidências de câncer, problemas cardiovasculares e outras patologias, também são reconhecidos pela ação antimicrobianas e anti-inflamatória (10, 11 e 12). Na figura 3 podemos observar as principais bioatividades e potencial funcional dos flavonoides.
Extração por fluido supercrítico
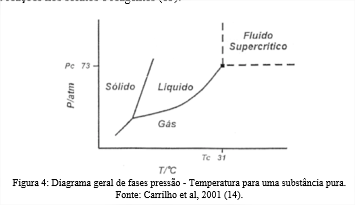
Um fluido em estado supercrítico, tem densidade semelhante aos líquidos, enquanto a sua viscosidade é mais parecida com a dos gases normais, já a difusividade é cerca de duas ordens de grandeza maior do que a difusividade dos líquidos típicos. O fluido supercrítico pode ser identificado com base em regiões do diagrama de fases pressão – Temperatura que caracterizam seu comportamento. O ponto crítico é definido como as condições em uma faixa de temperatura crítica, pressão crítica e volume crítico. Em condições abaixo deste ponto, as substâncias podem existir no estado sólido, líquido ou vapor. Já fluidos supercríticos estão localizados em regiões acima do ponto crítico como demostrado na Figura 4. Nessas áreas as mudanças nas propriedades termodinâmicas dos fluidos podem causar fortes reações nos solutos e reagentes (13).
Por conta dessas propriedades particulares, os fluidos supercríticos combinam o melhor dos dois mundos: a alta difusividade e a baixa viscosidade dos gases com a solvência dos líquidos, isto resulta em taxas de transferência de massa superiores aos solventes convencionais. Os fluidos supercríticos são referência em pesquisas sobre extração devido a essa característica de combinar o comportamento de líquidos e gases (15).
As vantagens do método variam de acordo com os tipos de mistura selecionados para separação. Como o dióxido de carbono supercrítico é uma fase móvel não tóxica, não inflamável e barata sem problemas de descarte, ele é o solvente normalmente utilizado. A principal desvantagem do dióxido de carbono supercrítico é sua baixa polaridade. Em baixas pressões, o poder de solvência do CO2 se assemelha ao hexano, tornando-se ligeiramente mais polar em pressões mais altas. A adição de uma pequena quantidade de um solvente orgânico altamente polar ao CO2 aumenta sua polaridade. Mais comumente, isso é feito com metanol. A proporção da adição do cossolvente pode variar de 1 a 25%, mas o ponto crítico do fluido misturado aumenta com a proporção de líquido orgânico e as vantagens mencionadas neste parágrafo são gradualmente erodidas com o aumento da proporção de modificador. Vários outros fluidos mais polares foram testados com sucesso em algumas aplicações, mas no geral, o dióxido de carbono com modificadores é o fluido da grande maioria das separações (16).
Na figura 5 é demostrado a esquematização do sistema SFE de extração. Inicialmente, a célula extratora bombeia suavemente o solvente líquido para a célula de amostra. Em seguida, as pressões e temperaturas da câmara são ajustadas às condições desejadas. A amostra se mistura com o fluido supercrítico (SF – Surpercritical Fluid) na célula extratora, esse processo de extração pode acontecer de forma dinâmica onde há um fluxo contínuo do SF através da matriz ou de forma estática, onde uma quantidade fixa de SF é mantido em contato com a matriz por um período determinado. Uma vez extraído, o material resultante é movido para restritor – fixo ou variável – que controla tanto a temperatura quanto a pressão. O material extraído é despressurizado e reconstituído em seu estado físico original por meio da interação com um solvente, sistema criogênico ou retenção de fase sólida apropriada. Após o processo, o solvente extrator geralmente é reaproveitado (17).
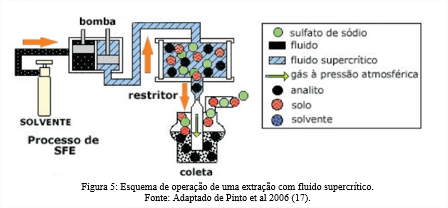
A SFE pode ser usada em uma gama de matérias primas como pode ser observado na Tabela 1, a modificação dos parâmetros e condições da extração, como, tempo, temperatura e vazão, pode determinar ou influenciar a concentração dos compostos diferentes, logo a importância de conhecer quais os compostos compõem a matéria prima e consequentemente qual os compostos alvos da extração.
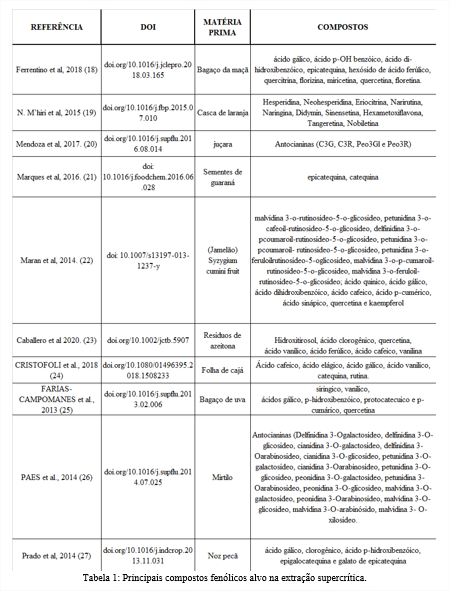
Também pode ser observado na Tabela 1 que existe uma inclinação para o uso de resíduos como matéria prima (25, 23). Isso pode se dar por diversos fatores, tanto pelo apelo ao meio ambiente e preocupação com os resíduos gerados pelo processamento de alimentos, como também, pelo desperdício de compostos nutricionalmente valiosos após processamento, como os compostos fenólicos. Estima se que cerca de 70% dos polifenóis da uva permaneçam no bagaço, assim como em outros vegetais esse comportamento se repete (28).
O processamento de alimentos vegetais gera grandes volumes de resíduos orgânicos, que demandam gastos consideráveis para a sua remoção dentro do setor industrial, além disso, pela possível presença de substâncias fitotóxicas pode se gerar algum estresse ambiental. Desta forma, a valorização desses resíduos tornou-se uma estratégia para a agroindústria, tanto pelo melhor aproveitamento, agregação de valor e otimização do custo, como também pelos aspectos de políticas de sustentabilidade (29).
Apesar dos compostos fenólicos serem abundantes nos vegetais a sua utilização é dificultada pela grande variação e heterogeneidade das moléculas (8). Desta maneira, os compostos alvos podem ser diversos, no entanto, fenólicos como epicatequina e ácido gálicos aparecem com maior proporção, como podemos ver nos estudos de Ferrentino et al. (18), Marques et al. (21), Maran et al. (22), Cristofoli et al. (24), Farias-Campomanes et al. (25), Prado et al. (27). Esses compostos são visados pela sua capacidade, já demostrada na literatura de promover ação antioxidante, diminuição do risco de câncer, ação fotoprotetora, atuação na quelação de metais e inibição da lipoperoxidação (30, 31, 32).
CONCLUSÕES
A extração de compostos fenólicos por fluido supercrítico (SFE) vem mostrando-se uma alternativa viável para os métodos tradicionais de extração, entretanto, ainda existem muitas barreiras para a extração eficiente desses compostos em matrizes vegetais. A utilização dessas moléculas é dificultada pela grande variedade e heterogeneidade de suas estruturas, fazendo com que diferentes moléculas possuam maior ou menor afinidade com determinados solventes, dificultando a eficiência da extração.
Desta maneira, observou-se que os fenólicos como epicatequina e ácido gálicos aparecem com maior proporção, os quais são reconhecidos devido as suas funções biológicas para os seres humanos.
Em virtude da grande importância dos compostos fenólicos para a dieta humana, e do constante desperdício dessas substâncias durante o processamento industrial de alimentos, são indispensáveis que técnicas como a SFE para a extração desses compostos sejam mais estudadas para garantir a melhor eficiência do processo de extração.
REFERÊNCIAS
- Niedzwiecki A, Roomi M W, Kalinovsky T, Rath M. Anticancer efficacy of polyphenols and their combinations. Nutrients. 2016; 8(9):552.
- Hitz D.; Barbosa M.; Nezello M. D. C.; Mazur C. E. Ação dos compostos fenólicos na aterosclerose: uma revisão. Visão Acadêmica. 2018; v. 19: n. 1.
- Lindy J. Materials science and technologies series. – Supercritical fluid extraction _ technology, applications and limitations. Nova Publishers. 2015.
- Tiago O, Maicon N, Ivan R C, Diego N F, Vinícius J S, Mauricio F, et al. Plant secondary metabolites and its dynamical systems of induction in response to environmental factors: a review. Afr. J. Agric. 2017; Res. 12, 71–84.
- Damodaran, S; Parkin, Kirk L; Fennema, Owen R. Química de Alimentos de Fennema. 4. Ed. São Paulo: artmed, 2010.
- Araújo J M A. Química de Alimentos – Teoria e Prática. 4. Ed. Viçosa: UFV; 2008.
- Vaccari N F de S, Soccol M C H, Ide G M. Compostos fenólicos em vinhos e seus efeitos antioxidantes na prevenção de doenças. Rev. Ciênc. Agrovet. [Internet]. 2009 [acesso em 2022 set 22];8(1):71-83. Disponível em: https://www.revistas.udesc.br/index.php/agroveterinaria/article/view/5316
- Pimentel M S, Cádiz G M L, Rodríguez P C, Segura C A. Functional and Preservative Properties of Phytochemicals – Recent advances in extraction technologies of phytochemicals applied for the revaluation of agri food by products. Cambridge: Academic Press; 2020.
- Maldonado-Celis M E, Yahia E M, Bedoya R, Landazuri P, Loango N, Aguillon J, Restrepo B, Ospina Warrior J C. Composição química do fruto da manga (Mangifera indica L.): Compostos nutricionais e fitoquímicos. Fronteiras Planta Sci. 10 (2019), pág. 1073
- Tuladhar, P., Sasidharan, S., Saudagar, P. (2021). 17 – Role of phenols and polyphenols in plant defense response to biotic and abiotic stresses. In Biocontrol Agents and Secondary Metabolites, Ed.: Jogaiah, S. (Ed.), Woodhead Publishing, Pages 419–441.micos.z, L. et al. Fisiologia e desenvolvimento vegetal. 6. ed. Porto alegre: Artmed; 2017.
- Forni, C., Facchiano, F., Bartoli, M., Pieretti, S., Facchiano, A., D’Arcangelo, D., … Jadeja, R. N. (2019). Beneficial role of phytochemicals on oxidative stress and agerelated diseases. BioMed Res Int, 2019, 1–16.
- Cory, H., Passarelli, S., Szeto, J., Tamez, M., & Mattei, J. (2018). The role of polyphenols in human health and food systems: A mini-review. Front Nutr, 5, 87.
- Brunner G. Supercritical fluids: technology and application to food processing. Journal of Food Engineering. V. 67, n. 1-2, p. 21-33, 2005.
- Carrilho E, Tavares MCH, Lanças FM. Fluidos supercríticos em química analítica. I. Cromatografia com fluido supercrítico: conceitos termodinâmicos [Internet]. Química Nova. 2001 ; 24(4): 509-515. [acesso em 2022 set 22] Disponível em: http://www.sbq.org.br/publicacoes/quimicanova/qnol/2001/vol24n4/11.pdf
- Santos O V, Corrêa N C F, Carvalho Jr R N, Costa C E F, França L F, Lannes S C S. Yield, nutritional quality, and thermal oxidative stability of Brazil nut oil (Bertolletia excelsa H.B.K) obtained by supercritical extraction. Journal of Food Engeneering. 2013; 117(4), 499–504.
- Morgan E D. Natural products supercritical fluid chromatography. Reference Module in Chemistry. In: Molecular Sciences and Chemical Engineering. Elsevier. 2013.
- Pinto GMF, Pinto JF, Jardim ICSF. Extração com fluido supercrítico. Rev. Chemkeys [Internet]. 2018 2009 [acesso em 2022 out 22];(4):1-13. Disponível em: https://econtents.bc.unicamp.br/inpec/index.php/chemkeys/article/view/9603iencesas-
- Ferrentino G, Morozova K, Mosibo O K, Ramezani M, Scampicchio M. Biorecovery of antioxidants from apple pomace by supercritical fluid extraction. Journal of Cleaner Production. 2018; v 186, 253-261.
- N. M’hiri, I. Ioannoub,∗, N. Mihoubi Boudhriouaa, M. Ghoul. Effect of different operating conditions on theextraction of phenolic compounds in Orange. Elsevier. 2015.
- Mendoza F A, Garcia M P, Espinosa P, Baseggio A M, Fernández G, Barbero Mário et al. Extraction of phenolic compounds and anthocyanins from jucara (Euterpe edulis Mart.) residues using pressurized liquids and supercritical fluids. J. of Supercritical Fluids. 2017.
- Marques LL, Panizzon GP, Aguiar BA, Simionato AS, Cardozo-Filho L, Andrade G, de Oliveira AG, Guedes TA, Mello JC. Guaraná (Paullinia cupana) seeds: Selective supercritical extraction of phenolic compounds. Food Chem. 2016 Dec 1;212:703-11.
- Maran J, Prakash B, Priya S, Manikandan. Modeling and optimization of supercritical fluid extraction of anthocyanin and phenolic compounds from Syzygium cumini fruit Pulp. J Food Sci Technol. 2014.
- Caballero A S, García J M R, Castro E, Cardona C A. Supercritical fluid extraction for enhancing polyphenolic compounds production from olive wastes. Journal of Chemical Technology and Biotechnology. 2020.
- Cristofoli N L L, Vieira C A R., Andrade M M C, Ferreira K S, Sandra R. Antioxidant and antimicrobial potential of cajazeira leaves (Spondias mombin) extracts. Separation Science and Technology. 2019.
- Farías C A M, Rostagno M A, Angela M, Meireles A. Production of polyphenol extracts from grape bagasse using supercritical fluids: Yield, extract composition and economic evaluation, The Journal of Supercritical Fluids. 2013; v 77, Pages 70-78,
- Paes J, Dotta R, Barbero G F, Martinez J. Extraction of phenolic compounds and anthocyanins from blueberry (Vaccinium myrtillus L.) residues using supercritical CO2 and pressurized liquids. The Journal of Supercritical Fluids. 2014; v 95, 8-16.
- Prado A C P, Silva H S, Silveira S M, Barreto P L M, Vieira C R W, Maraschin M. Effect of the extraction process on the phenolic compounds profile and the antioxidant and antimicrobial activity of extracts of pecan nut [Carya illinoinensis (Wangenh) C. Koch] shell. Industrial Crops and Products. 2014; v 52, 552-561.
- Averilla J N, Oh J, Kim H J, Kim J S, Kim J S. Potential health benefits of phenolic compounds in grape processing by-products. Food Sci Biotechnol. 2019; 28(6), 1607–1615.
- Jimenez L C, Fraga C M, Carpena M, García O P, Echave J, Pereira, A G, Simal G J. Agriculture waste valorisation as a source of antioxidant phenolic compounds within a circular and sustainable bioeconomy. 2020; Food Funct, 11, 4853–4877.
- Senger V E A, Schwanke C H A, Maria G V G. Chá verde (Camellia sinensis) e suas propriedades funcionais nas doenças crônicas não transmissíveis. Scientia Médica. 2010; v. 20, n. 4, p. 292-300.
- Papademetrio D L, Trabucchi A, Cavaliere V, Ricco R, Costantino S, Wagner M L, et al. The catechin flavonoid reduces proliferation and induces apoptosis of murine lymphoma cells LB02 through modulation of antiapoptotic proteins. Revista Brasileira de Farmacognosia. 2013. 23(3), 455-463
- Papi N, Fidelis M, Azevedo L C, Wang M A V, Mocan D A, Granato D. 2021. Berry polyphenols and human health: Evidence of antioxidant, anti-inflammatory, microbiota modulation, and cell-protecting effects. Current Opinion in Food Science, 42, 167-186.
Tag:ENAG

