
PROPRIEDADES QUÍMICAS E BIOATIVAS DOS ÓLEOS DE ABACATE (PERSEA AMERICANA MILL), VARIEDADES MARGARIDA E HASS
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Tamara de Souza Jorge1; Javier Telis Romero2; Neuza Jorge2*
1Mestre em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected].
Resumo: O presente trabalho teve como principais objetivos avaliar as propriedades físico-químicas, bioativas e atividade antioxidante dos óleos de abacate (Persea americana Mill) das variedades, Margarida e Hass, extraídos por centrifugação e pelo método Bligh & Dyer. Os óleos foram caracterizados físico-quimicamente e analisados quanto à composição em ácidos graxos, triacilgliceróis, fitosteróis, tocoferóis e atividade antioxidante. Os óleos apresentaram índices de acidez e peróxidos inferiores aos estabelecidos pela legislação. O índice de estabilidade oxidativa e o teor de clorofila apresentaram maiores valores para o comercial, seguidos pelas variedades Hass e Margarida. Dentre os ácidos graxos, o oleico foi predominante em todos os óleos. Os principais triacilgliceróis encontrados confirmaram a quantidade significativa de ácido oleico presente nos óleos. Dentre os fitosteróis e tocoferóis, os constituintes principais encontrados nos óleos foram o β-sitosterol e o α-tocoferol, respectivamente, com destaque para Margarida. Os óleos apresentaram comportamento similar entre os sistemas DPPH•, FRAP e ABTS•+, sendo o óleo de Margarida o de maior atividade antioxidante.
Palavras-chave: ácido oleico; atividade antioxidante; compostos bioativos; fitosteróis
INTRODUÇÃO
A alimentação e nutrição constituem requisitos básicos para a promoção e a proteção da saúde. Nos últimos anos, a tendência mundial com relação à alimentação indica um interesse acentuado dos consumidores por alimentos, que, além do valor nutritivo proporcionem benefícios às funções fisiológicas do organismo humano.
Características da dieta são indicadores do estado de saúde do indivíduo, em particular no que se refere às doenças crônicas. Uma das primeiras relações a ser comprovada foram entre o consumo de gorduras saturadas, níveis plasmáticos elevados de colesterol e o risco de doença coronariana. O efeito da gordura dietética e o risco de doenças crônico-degenerativas sugerem que a concentração dos diferentes ácidos graxos presentes na dieta pode ser mais importante para o risco cardiovascular do que propriamente o total de lipídios da dieta.
Há uma relativa redução (geralmente < 30%) no risco de mortalidade por doenças cardiovasculares em associação com hábitos alimentares saudáveis, ou seja, dietas com frutas e verduras, grãos e carnes magras e dentre os possíveis componentes destacam-se as proteínas vegetais, as fibras e alguns compostos fitoquímicos como os esteróis/estanóis, ácido fítico, taninos, inibidores de enzimas, saponinas, entre outros (BABBAR et al., 2011).
A identificação de componentes dietéticos que auxiliam no controle e prevenção das doenças crônicas não transmissíveis tem sido cada vez mais pesquisada, com ênfase nas potencialidades funcionais dos alimentos (MOO-HUCHIN et al., 2014). Dentre eles, os fitosteróis, presentes na porção insaponificável de óleos vegetais, têm sido apontados como fator protetor contra as doenças cardiovasculares. A ação de ácido graxo monoinsaturado, representado principalmente pelo ácido oleico, também tem sido estudada, demonstrando efeitos significativos na prevenção e tratamento de doenças crônicas (RICHARD et al., 2008).
O abacate pode ter seu óleo extraído da polpa e se destaca pela excelente qualidade nutricional (BHUYAN et al., 2019). De acordo com alguns estudos, o óleo de abacate é rico em β-sitosterol e ácido oleico, uma gordura insaturada utilizada como coadjuvante no tratamento de hiperlipidemias (COWAN; WOLSTENHOLME, 2016; LÓPEZ-COBO et al., 2016). Devido ao seu elevado teor lipídico, o óleo de abacate é de interesse para fins comestíveis in natura, como ocorre em alguns países, onde são utilizados em culinária. Além disso, pode ser utilizado na indústria farmacêutica e cosmética, principalmente pela presença de vitamina E, em torno de 3% (DÁVILA et al., 2017).
Tendo como norte a possibilidade de prevenir doenças por meio da ingestão de alimentos funcionais enriquecidos com compostos bioativos e mostrar o potencial de comercialização do óleo de abacate no Brasil, faz-se necessário investigar sobre a caracterização dos óleos extraídos por centrifugação da polpa de abacate, como também avaliar seus compostos bioativos.
MATERIAL E MÉTODOS
Material
Duas variedades de abacate foram selecionadas para o trabalho, Margarida, pela disponibilidade no mercado brasileiro, e Hass, por apresentar maior teor de matéria graxa. Os abacates, colhidos ainda firmes na Fazenda Grupo Tsuge de São Gotargo, MG (19°24’43” S e 46°09’33” W), foram acondicionados em caixas de plástico e armazenados à temperatura ambiente. Após atingirem seu ponto de maturação (MONTENEGRO, 1961), os frutos foram transportados até a Empresa de Pesquisa Agropecuária de Minas Gerais – EPAMIG de Maria da Fé, MG, para a extração do óleo.
Óleos – extração por centrifugação
Para realizar o processo de extração, 100 kg de cada variedade de abacate, Margarida e Hass, foram higienizados, cuja polpa foi removida manualmente, homogeneizada em liquidificador e a pasta obtida foi passada em uma peneira e transferida para uma termobatedeira, projetada e fabricada para o trabalho. A pasta foi mantida neste equipamento sob agitação e aquecimento durante 40 minutos. A temperatura atingida foi de 40°C, monitorada por termômetro infravermelho. Por último, a pasta foi introduzida em uma centrífuga horizontal, (Toscana Enologica Mori – TEM, OLIOMIO 100, Itália, capacidade de 100 kg/hora e rotação do decantes de 4.200 rpm) para a obtenção do óleo (OLIVEIRA et al., 2010). Para o abacate da variedade Hass, foi obtido um óleo de cor esverdeada e para a variedade Margarida, óleo amarelado.
Os óleos extraídos das duas variedades foram filtrados com uso de peneira e acondicionados em frascos de vidro âmbar. Em seguida, foram transportados para o Laboratório de Óleos e Gorduras do Departamento de Engenharia e Tecnologia de Alimentos, onde foram centrifugados, colocados em frascos de vidro âmbar, inertizados com nitrogênio gasoso, vedados com tampas de rosca e devidamente rotulados. Os óleos foram mantidos em freezer (-18°C) até o momento das análises.
Óleos – extração por Bligh & Dyer
A fim de comparação de métodos de extração, os óleos das variedades, Margarida e Hass, também foram extraídos por Bligh e Dyer (1959).
Óleo de abacate comercial
Para realização do experimento foi utilizado o óleo de abacate extra virgem comercial da marca Grove, processado na Nova Zelândia, obtido por prensagem a frio.
Propriedades físico-químicas e bioativas
As medidas de ácidos graxos livres, índice de peróxidos, dienos conjugados, ρ-anisidina, índices de iodo, refração, saponificação e matéria insaponificável foram determinados segundo métodos da AOCS (2009). O valor total de oxidação (Totox) foi calculado utilizando a equação: Totox = 2 (índice de peróxidos) + (valor de ρ-anisidina). Compostos polares totais foram determinados por meio do analisador de qualidade de óleo Testo 265 (Lenzkirch Black Forest, Germany). Após a calibração, o Testo 265 foi imerso nas amostras de óleos e a leitura do teor de compostos polares totais, em porcentagem, foi realizada no display do instrumento.
Índice de estabilidade oxidativa, conforme método Cd 12b-92 proposto pela AOCS (2009) utilizando o Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland). Amostras de óleo (3 g) foram transferidas para os tubos de reação e submetidas à oxidação a temperatura de 100°C com fluxo de ar de 20 L/h. A curva de condutividade elétrica versus tempo foi automaticamente registrada com o decorrer da reação de oxidação e o período de indução foi expresso em horas.
O teor de clorofila foi determinado utilizando espectrofotômetro (modelo Uv-Vis mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão), nos comprimentos de ondas de 630, 670 e 710 nm, conforme método Ch 4-91 (AOCS, 2009), cujo resultado foi expresso em mg/kg.
A composição de ácidos graxos foi avaliada por cromatografia gasosa a partir das amostras transesterificadas segundo método Ce 2-66 da AOCS (2009). Foi utilizado cromatógrafo a gás (modelo 3900, Varian Inc., Walnut Creek, CA, Estados Unidos), equipado com detector de ionização de chama. Os ácidos graxos metilados foram separados em coluna capilar de sílica fundida (CP-Sil 88, Microsorb, Varian Inc., Walnut Creek, CA, Estados Unidos) de 60 m de largura, com diâmetro interno de 0,25 mm e espessura de filme de 0,20 μm. O gás de arraste foi o hidrogênio com velocidade linear de 30 mL/min. Os ácidos graxos foram identificados pela comparação dos tempos de retenção de padrões puros de ésteres metílicos de ácidos graxos com os compostos separados das amostras e por co-cromatografia. A quantificação foi feita por normalização de área (%).
Os teores de triacilgliceróis, foram calculadospor meio do software desenvolvido pelo Laboratório de Métodos de Extração e Separação – LAMES da Universidade Federal de Goiás, desenvolvido por Antoniosi Filho et al. (1995). O software se baseia no modelo de distribuição 1,2,3-randômico que tenta estimar a porcentagem molar dos triacilgliceróis de uma amostra através da concentração dos ácidos graxos presentes.
Os teores de fitosteróis foram determinados por cromatografia a gás com saponificação previa da amostra, segundo Duchateau et al., 2002. Foi utilizado cromatógrafo a gás (modelo Plus-2010, Shimadzu, Chiyoda-ku, Toquio, Japão), equipado com detector de ionização de chama e coluna capilar de sílica fundida (Restek RTX 5 Shimadzu, Chiyoda-ku, Toquio, Japão) de 30 m de comprimento, 0,25 μm de espessura de filme e 0,25 μm de diâmetro interno. O gás de arraste foi hidrogênio. Os compostos foram identificados pela comparação dos tempos de retenção dos padrões puros e por co-cromatografia. A quantificação foi feita por padronização interna, utilizando o β-colestanol como padrão interno. Os teores de fitosteróis individuais foram expressos em mg/100 g.
Os teores de tocoferóis foram obtidos por cromatografia líquida de alta eficiência segundo método Ce 8-89 descrito na AOCS (2009). Foi utilizado um cromatógrafo líquido (modelo 210-263, Varian Inc., Walnut Creek, CA, Estados Unidos), equipado com detector de fluorescência. Foi utilizado coluna de sílica (Microsorb 100 Si, Varian Inc., Walnut Creek, CA, Estados Unidos) de 250 x 4,6 mm com poro de 5 micrômetros. A fase móvel foi composta de mistura de 99,5% de n-hexano e 0,5% de isopropanol, com fluxo de 1,2 mL/min. O comprimento de onda de excitação foi 290 nm e de emissão 330 nm. Os isômeros de tocoferóis foram identificados pela comparação dos tempos de retenção dos padrões puros e por co-cromatografia. A quantificação foi realizada por calibração externa. Os teores de tocoferóis individuais foram expressos em mg/kg.
Atividade antioxidante
A atividade antioxidante obtida pelo método do radical livre 2,2-difenil-1-picrilhidrazila – DPPH• foi determinada segundo Kalantzakis et al. (2006). A absorvância foi lida em 515 nm e os resultados foram expressos em porcentagem.
A obtenção da atividade antioxidante pelo método de Redução do Ferro – FRAP foi realizadaconforme metodologia descrita porSzydłowska-Czerniak et al. (2008). A absorvância foi lida em 593 nm e os resultados foram expressos em µM Trolox/100 g.
A capacidade antioxidante pelo método da captura do radical livre – ABTS•+ foirealizadade acordo com metodologia descrita por Re et al. (1999). A leitura das amostras foi realizada a 734 nm e os resultados foram expressos em µM Trolox/100 g.
Análise estatística
O ensaio experimental foi realizado no delineamento inteiramente casualizado, cujos resultados obtidos das determinações analíticas foram submetidos à análise de variância e ao teste de Tukey a 5% de probabilidade, por meio do programa Statistica, versão 7.0.
RESULTADOS E DISCUSSÃO
Características físico-químicas e bioativas
A Tabela 1 apresenta os resultados da caracterização físico-química dos óleos de abacate obtidos da extração por centrifugação das variedades, Margarida e Hass, e do óleo de abacate comercial. Dentre os óleos estudados, o da variedade Margarida apresentou valor superior de ácidos graxos livres (1,8%). O óleo da variedade Hass e o comercial apresentaram 0,8 e 0,4%, respectivamente. Em estudo realizado por Salgado et al. (2008), óleo de abacate (Persea americana Mill) extraído com hexano e cetona (1:1) apresentou 0,9% de ácidos graxos livres. É comumente utilizada uma simples relação entre os parâmetros ácidos graxos livres e índice de acidez. O índice de acidez é calculado multiplicando-se a quantidade de ácidos graxos livres (% oleico) por 1,99 e expresso em mg KOH/g. O Codex Alimentarium Commission (2009) determina como parâmetro de qualidade para óleos brutos prensados a frio acidez máxima de 4,0 mg KOH/g. Nos óleos analisados, nenhum apresentou índice de acidez superior a este valor, indicando a boa qualidade dos mesmos.
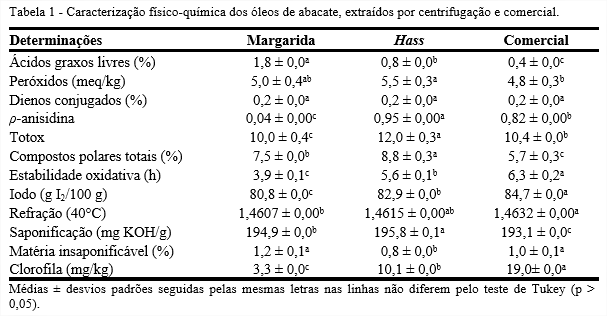
O Codex Alimentarium Commission (2009) estipula para óleos refinados e brutos valores máximos de índice de peróxidos de 10 e 15 meq/kg, respectivamente. Os óleos analisados apresentaram índices de peróxidos abaixo de 15 meq/kg. O menor índice de peróxidos foi obtido para o óleo comercial (4,8 meq/kg) e o maior para o óleo da variedade Hass (5,5 meq/kg). Os peróxidos são os principais produtos iniciais da autoxidação. Segundo Salgado et al. (2008), óleo de abacate (Persea americana Mill) extraído com hexano e cetona (1:1) apresentou 20,6 meq/kg de índice de peróxidos, valor superior aos encontrados nos óleos estudados.
A presença de dienos em óleos indica formação de compostos primários de oxidação lipídica. O óleo da variedade Margarida apresentou menor valor de dienos conjugados (0,1%), como também ρ-anisidina (0,04) e totox (10,0). Considera-se que um óleo bem conservado deve apresentar valor totox inferior a 10,0. Os outros óleos apresentaram valores totox superiores ao recomendável, 12,0 e 10,4, para Hass e comercial, respectivamente.
Segundo Lumley (1988), a porcentagem de compostos polares totais em óleos sem uso deve estar compreendida entre 0,4 e 6,4%. O óleo comercial apresentou 5,7% de compostos polares totais. Os óleos de abacate obtidos da extração por centrifugação apresentaram 7,5 e 8,8%, para Margarida e Hass, respectivamente.
Entre os óleos estudados, o que apresentou maior índice de estabilidade oxidativa foi o comercial (6,3 h), seguidos de Hass (5,6 h) e Margarida (3,9 h), cujos índices apresentaram diferença significativa (p < 0,05). Gutiérrez-Rosales (1989), analisando amostras de azeite de oliva, encontrou valores entre 6,7 e 79,8 h para a estabilidade oxidativa a 100°C com fluxo de ar de 10 L/h. Merrill et al. (2008) reportaram valores de período de indução para óleos de milho, canola, soja e girassol de 9,8; 8,4; 7,6 e 5,2 h, respectivamente. Além da composição em ácido graxo, outros fatores como a posição dos ácidos graxos individuais dentro da molécula de triacilglicerol, a presença e composição de tocoferóis, carotenóides e esteróis, a variedade do grão e as condições de processamento podem apresentar influência sobre a estabilidade dos mesmos (KAIJSER; DUTTA; SAVAGE; 2000).
O índice de iodo foi menor para o óleo da variedade Margarida (80,8 g I2/100 g), indicando um óleo mais saturado, e, consequentemente, menor capacidade em incorporar iodo ou outros halogêneos às duplas ligações da cadeia, o que acarreta em uma menor susceptibilidade à rancidez oxidativa. De acordo com Salgado et al. (2008), óleo de abacate (Persea americana Mill) extraído com hexano e cetona (1:1) apresentou 96,31 g I2/100 g de índice de iodo. O óleo comercial apresentou maior índice de iodo (84,7 g I2/100 g), indicando maior grau de insaturação, podendo ser correlacionado com o índice de refração, que também se apresentou superior aos demais óleos.
O resultado para o índice de saponificação foi maior para o óleo da variedade Hass (195,8 mg KOH/g), indicando presença de ácidos graxos de pesos moleculares mais baixos. Os óleos da variedade Margarida e comercial apresentaram valores de 194,9 e 193,1 mg KOH/g, respectivamente. Estes valores são comparáveis àqueles reportados pelo Codex Alimentarius Commission (2009) para óleos vegetais convencionais como milho (187-195 mg KOH/g), soja (189-195 mg KOH/g) e palma (190-209 mg KOH/g). Segundo Salgado et al. (2008), óleo de abacate (Persea americana Mill) extraído com hexano e cetona (1:1) apresentou 184,10 mg KOH/g de índice de saponificação.
Os óleos da variedade Margarida e comercial não apresentaram diferença significativa nos valores de matéria insaponificável, 1,2 e 1,0%, respectivamente. Segundo Salgado et al. (2008), óleo de abacate (Persea americana Mill) extraído com hexano e cetona (1:1) apresentou 1,72% de matéria insaponificável. No Codex Alimentarium Commission (2009) são encontrados valores superiores de matérias insaponificáveis para óleos vegetais como milho (≤ 2,8%), girassol(≤ 1,5%) e soja (≤ 1,5%). Nesta fração estão presentes os esteróis (β-sitosterol), tocoferóis (vitamina E) e outros.
Nota-se, que os resultados de teor de clorofila para os óleos estudados diferiram significativamente (p < 0,05). O teor de clorofila foi maior para o óleo comercial (19,0 mg/kg), seguido por Hass (10,1 mg/kg) e Margarida (3,3 mg/kg).
A Tabela 2 apresenta a composição dos principais ácidos graxos dos óleos de abacate obtidos da extração por centrifugação das variedades, Margarida e Hass, e do óleo de abacate comercial. Os óleos contêm como principais constituintes, os ácidos oleico, palmítico e linoleico, entretanto, a proporção destes componentes varia entre eles. Nota-se, que os dados diferiram significativamente (p < 0,05) para os óleos estudados.
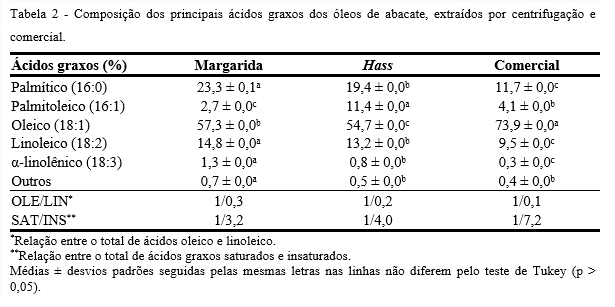
Dentre os ácidos graxos, o oleico foi predominante nos óleos, ácido graxo monoinsaturado da família ω9, auxilia na diminuição plasmática de LDL, sem redução de HDL, com redução do risco de doenças cardiovasculares. O óleo de abacate comercial foi o que apresentou maior concentração de ácido oleico (73,9%), seguidos das variedades Margarida (57,3%) e Hass (54,7%). Segundo Salgado et al. (2008), óleo de abacate (Persea americana Mill) da variedade Margaridaextraído com hexano e cetona (1:1) apresentou 55,8% de oleico. De acordo com Tango et al. (2004), o óleo da variedade Hass extraído utilizando-se do aparelho de Butt e hexano como solvente de extração, apresentou 47,7% de oleico.
O óleo da variedade Margarida obteve concentração superior de ácido palmítico (23,3%), ácido graxo saturado, que promove menor benefício para saúde, porém confere maior estabilidade diante do processo degradativo da rancidez autoxidativa. Apresentou, ainda, uma quantidade superior de ácidos graxos poli-insaturados das famílias ω6 e ω3, linoleico (14,8%) e α-linolênico (1,2%), respectivamente, que produzem efeitos especiais no organismo vivo. Levando em consideração a porcentagem de α-linolênico em óleos comuns como girassol (0,3%), milho (2%) (CODEX, 2009), o óleo da variedade Margarida apresentou quantidade considerável de ácido α-linolênico.
De acordo com Salgado et al. (2008), óleo de abacate (Persea americana Mill) da variedade Margaridaextraído com hexano e cetona (1:1) apresentou 22,74% de ácido palmítico, 15,3% de linoleico e 1,03% de α-linolênico, valores próximos aos encontrados neste estudo. Segundo Tango et al. (2004), o óleo da variedade Hass extraído utilizando-se do aparelho de Butt e hexano como solvente de extração, apresentou 24,5% de ácido palmítico e 14,2% de linoleico.
O óleo da variedade Hass apresentou quantidade expressiva de palmitoleico (11,3%), outro ácido graxo importante da família ω9, encontrado em maiores concentrações em óleos de animais marinhos. Segundo Tango et al. (2004), o óleo da variedade Hass extraído utilizando-se do aparelho de Butt e hexano como solvente de extração, apresentou 13,3% de palmitoleico. Salgado et al. (2008) encontraram 3,92% de palmitoleico no óleo de abacate (Persea americana Mill), variedade Margarida,extraído com hexano e cetona (1:1).
Os óleos das variedades, Margarida e Hass, e o comercial apresentaram relações ácido oleico/linoleico de 1/0,3, 1/0,2 e 1/0,1, respectivamente. Em estudos já realizados, os maiores valores de ácido linoléico comparados ao oléico foram obtidos para os óleos de sementes de goiaba, melancia e maracujá que apresentaram relações ácido oléico/linoléico de 1/8,05, 1/6,69 e 1/5,29, respectivamente (MALACRIDA; JORGE, 2012; 2013; JORGE; SILVA; MALACRIDA, 2015).
A relação entre o total de ácidos graxos saturados e insaturados encontrados neste trabalho para os óleos das variedades Margarida e Hass, e comercial foram 1/3,2; 1/4,0 e 1/7,2, respectivamente. Borges et al. (2007) encontraram valores para relação entre o total de ácidos graxos saturados e insaturados de 1/2,8; 1/5,7 e 1/6,7, para óleos de amendoim, soja e milho, respectivamente.
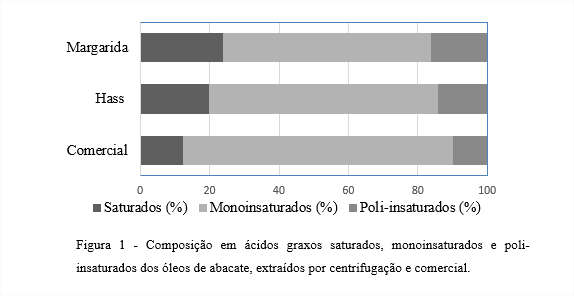
A Figura 1 apresenta a composição em ácidos graxos saturados, monoinsaturados e poli-insaturados dos óleos de abacate obtidos da extração por centrifugação das variedades, Margarida e Hass, e do óleo de abacate comercial. Altas quantidades de ácidos graxos monoinsaturados foram encontradas em todos os óleos analisados com porcentagens de 60,0, 66,1 e 78,0% para Margarida, Hass e comercial, respectivamente. O óleo da variedade Margarida foi o que apresentou maior porcentagem de ácidos graxos saturados (24,0%) e poli-insaturados (16,1%). Segundo Beardsell et al. (2002), o perfil de ácidos graxos do óleo comestível considerado ideal deveria ter 80-90% de ácidos graxos monoinsaturados e o restante, principalmente, constituído de ácidos poli-insaturados. Estes últimos são mais susceptíveis à oxidação e isomerização quando aquecidos.
A Tabela 3 apresenta a composição dos principais ácidos graxos dos óleos de abacate das variedades, Margarida e Hass, obtidos da extração pelo método de Bligh & Dyer. Nota-se que os dados diferiram significativamente (p < 0,05) para os óleos estudados.

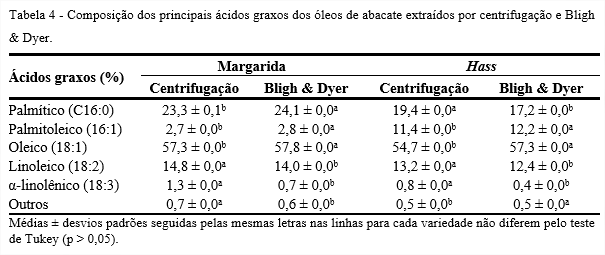
A Tabela 4 apresenta a composição dos principais ácidos graxos dos óleos de abacate das variedades, Margarida e Hass, obtidos da extração por centrifugação e pelo método de Bligh & Dyer. Verifica-se que os dados diferiram significativamente (p < 0,05) para os métodos de extração utilizados. Os óleos de ambas as variedades apresentaram
diferença na porcentagem de ácido graxo α-linolênico entre os métodos empregados. A extração por centrifugação se apresentou mais eficiente que a por Bligh & Dyer para este ácido graxo. O óleo da variedade Hass apresentou 57,3% de ácido graxo oleico no método Bligh & Dyer, valor superior ao encontrado na extração por centrifugação e similar ao valor encontrado nos óleos da variedade Margarida.
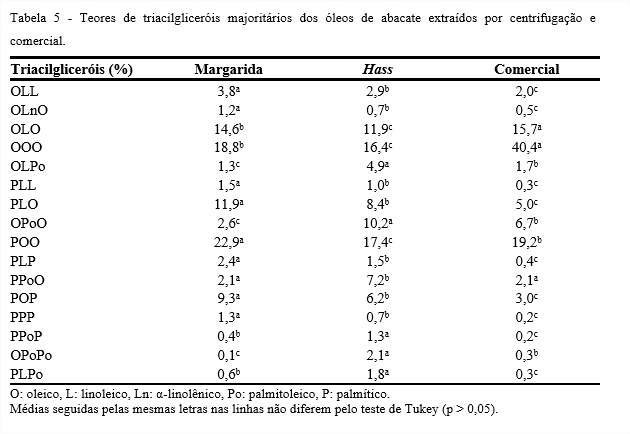
A Tabela 5 apresenta os teores de triacilgliceróis majoritários dos óleos de abacate das variedades, Margarida e Hass, obtidos da extração por centrifugação e do comercial. Observa-se que os dados diferiram significativamente (p < 0,05) para os óleos estudados.
Para o óleo da variedade Margarida, os triacilgliceróis obtidos em maiores quantidades foram: POO (22,9%), OOO (18,8%), OLO (14,6%), PLO (11,9%) e POP (9,3%). Para o óleo da variedade Hass, os triacilgliceróis obtidos em maiores quantidades foram: POO (17,4%), OOO (16,4%), OLO (11,9%), OPoO (10,2%) e PPoO (7,2%). Para o óleo de abacate comercial, o triacilglicerol que mais se destacou foi OOO (40,4%), seguidos por POO (19,2%) e OLO (15,7%), o que é confirmado pela quantidade significativa de ácido oleico encontrado para este óleo (73,9%).
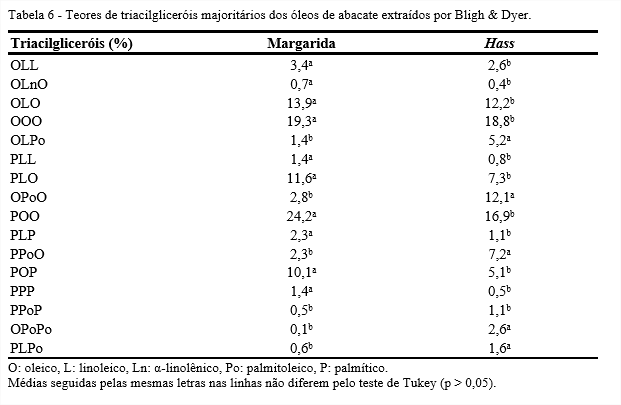
A Tabela 6 apresenta os teores de triacilgliceróis majoritários dos óleos de abacate das variedades, Margarida e Hass, obtidos da extração pelo método de Bligh & Dyer. Nota-se que os dados diferiram significativamente (p < 0,05) para os óleos estudados.
Para o óleo da variedade Margarida, os triacilgliceróis obtidos em maiores quantidades foram: POO (24,1%), OOO (19,3%), OLO (13,9%), PLO (11,6%) e POP (10,1%). Para o óleo da variedade Hass, os triacilgliceróis obtidos em maiores quantidades foram: POO (16,9%), OOO (18,8%), OLO (12,2%), OPoO (12,0%) e PPoO (7,2%).
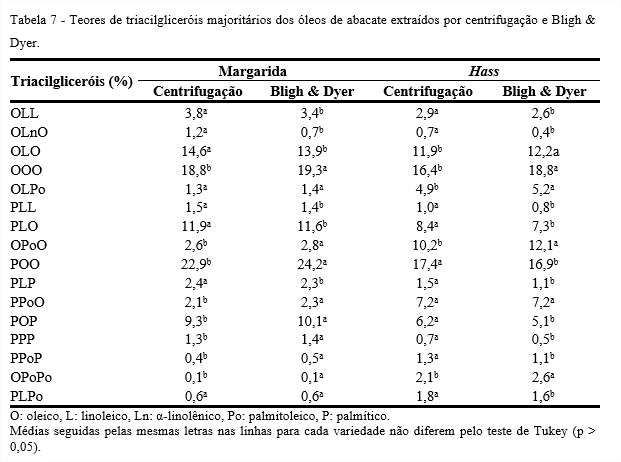
Óleos e gorduras são considerados substâncias complexas, devido ao grande número de diferentes triacilgliceróis que os formam. Portanto, a identificação de triacilglicerol é um processo difícil, em que o número de possíveis formas estruturais é elevado, em comparação com o número de ácidos graxos presentes. A Tabela 7 apresenta os teores de triacilgliceróis majoritários dos óleos de abacate das variedades, Margarida e Hass, obtidos da extração por centrifugação e pelo método de Bligh & Dyer. Verifica-se que os dados diferiram significativamente (p < 0,05) para os métodos utilizados, porém os valores apresentados são coerentes.
Para a determinação desta composição, os principais triacilgliceróis representam os componentes de concentrações mais elevadas do isômero, em que o número de átomos de carbono para os óleos estudados foi de 50 a 54. O óleo da variedade Margarida extraído por centrifugação apresentou maior quantidade de carbono 52 (42,5%) e 54 (40,3%), e ainda 50 (15,0%), valores próximos aos encontrados para o óleo da mesma variedade extraído por Bligh & Dyer. Hass apresentou uma quantidade superior de carbono 52 (44,1%) e C50 (19,7%), em contrapartida valor inferior de 54 (33,1%), valores próximos ao encontrado para o óleo da mesma variedade extraído por Bligh & Dyer. O óleo comercial apresentou maior quantidade de carbono 54 (59,5%), seguidos pelo carbono 52 (33,5%) e 50 (6,3%).
A composição de fitosteróis dos óleos de abacate das variedades, Margarida e Hass, extraídos por centrifugação e do óleo de abacate comercial está apresentada na Tabela 8. O constituinte principal encontrado foi o β-sitosterol para os três óleos, destacando-se no óleo da variedade Margarida (82,3 mg/100 g). Também foram identificados teores significativos de ∆7-avenasterol no três óleos, 13,6; 13,7 e 10,1 mg/100 g para Margarida, Hass e comercial, respectivamente. Villa-Rodriguez et al. (2020) relataram que β-sitosterol (89%) foi o principal fitosterol encontrado em óleo de abacate Hass, com 35,6 mg/100 g, seguidos de campesterol (10%) e estigmasterol (1%).

Observa-se que o resultado de fitosteróis totais diferiu significativamente pelo teste de Tukey (p < 0,05) para os óleos estudados. O óleo da variedade Margarida apresentou quantidade total de fitosteróis superior aos demais (100,0 mg/100 g).
A composição de fitosteróis dos óleos de abacate extraídos pelo método de Bligh & Dyer das variedades, Margarida e Hass, está apresentada na Tabela 9. Observa-se que o resultado para todos fitosteróis diferiu significativamente pelo teste de Tukey (p < 0,05) para os óleos estudados e foi superior para o óleo da variedade Margarida.
A composição de fitosteróis dos óleos de abacate das variedades, Margarida e Hass, extraídos por centrifugação e pelo método de Bligh & Dyer está apresentada na Tabela 10. Observa-se que os resultados para todos os fitosteróis diferiram significativamente pelo teste de Tukey (p < 0,05) entre os métodos utilizados.
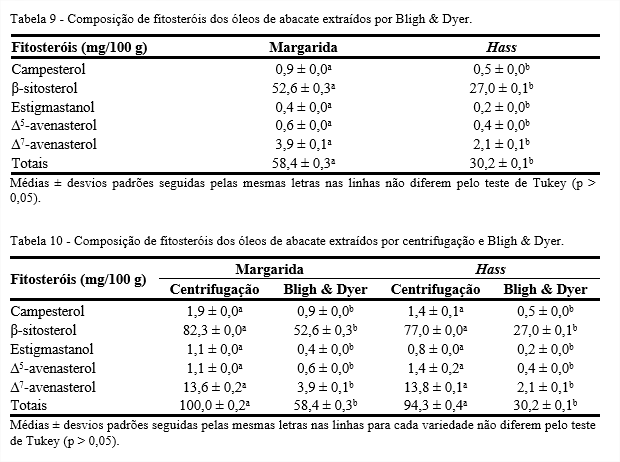
Os valores de fitosteróis encontrados nos óleos de abacate extraídos por centrifugação foram superiores aos encontrados nos óleos extraídos por Bligh & Dyer. Pode-se considerar que o método de extração por centrifugação foi melhor na extração e preservação dos fitosteróis.
A Tabela 11 apresenta a composição de tocoferóis dos óleos de abacate extraídos por centrifugação das variedades, Hass e Margarida, e do óleo comercial. Observa-se, que os valores de α-tocoferol dos óleos estudados, diferiram significativamente pelo teste de Tukey (p < 0,05), porém não houve diferença significativa (p > 0,05) no valor total de tocoferóis entre os óleos, comercial e da variedade Hass.
Tabela 11 – Composição de tocoferóis dos óleos de abacate extraídos por centrifugação e comercial.
| Tocoferóis (mg/kg) | Margarida | Hass | Comercial |
| α-tocoferol | 36,7 ± 0,3a | 30,5 ± 0,5b | 28,8 ± 0,1c |
| γ-tocoferol | nd | nd | 2,0 ± 0,1 |
| Totais | 36,7 ± 0,3a | 30,5 ± 0,5b | 30,9 ± 0,1b |
| Vitamina E (UI/kg) | 40,4 ± 0,1a | 33,5 ± 0,0b | 32,0 ± 0,0c |
nd: não detectado (≤ 0,01%).
Médias ± desvios padrões seguidas pelas mesmas letras nas linhas não diferem pelo teste de Tukey (p > 0,05).
O α-tocoferol foi predominante nos três óleos estudados, com destaque do óleo da variedade Margarida (36,7 mg/kg). Segundo Villa-Rodriguez et al. (2020), α-tocoferol foi identificado como o tocoferol mais abundante (> 70%) na polpa de abacate ‘Hass’, seguido por γ- e δ-tocoferóis, 20,8 e 5,27%, respectivamente, e esses valores variam com a maturação do fruto. De acordo com o Codex Alimentarium Commission (2009), os óleos que apresentam teor de α-tocoferol predominante são: girassol (403-935 mg/kg), palma (30-280 mg/kg) e uva (16-38 mg/kg). O óleo de abacate comercial foi o único dentre os três óleos que apresentou o γ-tocoferol. Enquanto o α-tocoferol apresenta a maior atividade biológica como vitamina E, o γ-tocoferol possui maior atividade antioxidante (SHAHIDI; NACZK, 1995; SCHMIDT; POKORNÝ, 2005).
Os valores de vitamina E para os óleos Margarida, Hass e comercial foram de 40,41; 33,52 e 32,02 UI/kg, respectivamente, com diferença significativa entre eles (p < 0,05). De acordo com a RDC n°. 269, de 22 de setembro de 2005, a Ingestão Diária Recomendada (IDR) para a vitamina E é de 10 mg/dia de α-tocoferol (BRASIL, 2005). Diante disso, os óleos estudados são uma excelente fonte dessa vitamina, podendo atender às necessidades diárias de adultos e gestantes.
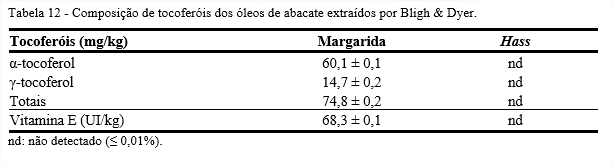
A composição de tocoferóis dos óleos de abacate das variedades, Margarida e Hass, obtidos da extração pelo método de Bligh & Dyer está apresentada na Tabela 12. Não foram detectados tocoferóis na amostra do óleo da variedade Hass. O óleo da variedade Margarida apresentou quantidade de γ-tocoferol equivalente a 14,7 mg/kg.
A Tabela 13 apresenta a composição de tocoferóis dos óleos de abacate das variedades, Margarida e Hass, extraídos por centrifugação, Bligh & Dyer e Soxhlet. Como não foram detectados tocoferóis no óleo da variedade Hass, fez-se necessário utilizar outro método de extração, optou-se por Soxhlet.
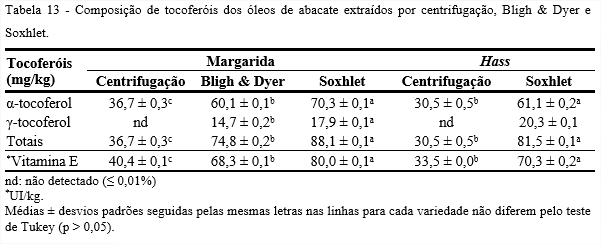
Observa-se, que os valores de tocoferóis dos óleos estudados diferiram significativamente pelo teste de Tukey (p < 0,05). Nota-se por meio dos métodos Bligh & Dyer e Soxhlet, o potencial dos óleos de abacate em tocoferóis, devido aos elevados valores encontrados, superiores aos dos óleos extraídos por centrifugação e por apresentarem o γ-tocoferol em quantidades significativas.
Foi realizado o estudo da correlação entre a estabilidade oxidativa, tocoferóis totais e a composição de ácidos graxos (saturados, monoinsaturados, poli-insaturados e linoleico) para os óleos de abacate, extraídos por centrifugação e comercial. A análise está apresentada na Tabela 14.

Foram obtidas correlações significativas entre a estabilidade oxidativa e a quantidade de ácidos graxos monoinsaturados (0,92), quantidade de ácidos graxos poli-insaturados (-0,91) e porcentagem de ácido linoleico (-0,90). Tal fato demonstra a influência dos ácidos graxos poli-insaturados e, em especial do ácido linoleico, sobre a estabilidade oxidativa, ou seja, quanto maior a porcentagem destes ácidos nos óleos, menor a resistência dos mesmos à oxidação. Os ácidos graxos insaturados têm diferentes suscetibilidades à oxidação, já sendo conhecido que as taxas oxidativas são mais baixas para substratos monoinsaturados, como o ácido oleico, do que para ácidos graxos poli-insaturados, principalmente linoleico e α-linolênico (KAMAL-ELDIN, 2006).
Usualmente, altas quantidades de tocoferóis totais estão associadas com os conteúdos de ácidos graxos poli-insaturados (TUBEROSO et al., 2007). Neste estudo foi obtido, para os óleos, uma correlação significativa (0,70) entre as quantidades de ácido linoleico e de tocoferóis totais, o que indica a presença de elevadas quantidades de tocoferóis nos óleos mais insaturados.
Foi obtida correlação significativa e positiva entre a estabilidade oxidativa e a quantidade de clorofila (0,96) nos óleos analisados, indicando que os óleos que contêm maiores quantidades de clorofila apresentam maior estabilidade oxidativa. Apesar de as clorofilas serem pró-oxidantes sob a luz, elas agem como antioxidantes no escuro, possivelmente pela doação de hidrogênio para os radicais livres (GUTIÉRREZ-ROSALES et al., 1992).
Observa-se, ainda, que os óleos estudados apresentaram correlação significativa, porém inversamente proporcional, entre a composição de tocoferóis e a estabilidade oxidativa (-0,94), indicando que os óleos que contêm maiores quantidades de tocoferóis apresentam menor estabilidade oxidativa.
Além da composição em ácido graxo, outros fatores como a posição dos ácidos graxos individuais dentro da molécula de triacilglicerol, a presença e a composição de tocoferóis, carotenóides e esteróis, a variedade do grão e as condições de processamento podem apresentar influência sobre a estabilidade dos mesmos (MERRILL et al., 2008).
Atividade antioxidante
A Tabela 15 apresenta os resultados da atividade antioxidante para os métodos DPPH•, FRAP e ABTS•+ dos óleos de abacate extraídos por centrifugação e comercial. Nota-se que os resultados diferiram significativamente pelo teste de Tukey (p < 0,05). Observa-se que os óleos apresentaram comportamento similar entre os sistemas DPPH•, FRAP e ABTS•+. O óleo da variedade Margarida demonstrou maior atividade antioxidante e Hass obteve menor atividade pelos sistemas estudados.
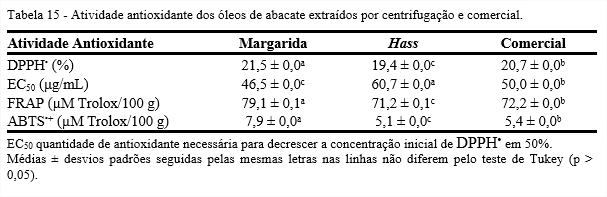
A atividade antioxidante determinada pelo método do radical DPPH• permite a avaliação do comportamento antioxidante dos compostos através da capacidade de sequestrar radical livre em determinado período de tempo. Os óleos apresentaram por este método, atividade antioxidante de 21,5 e 19,4% para os óleos das variedades Margarida e Hass, respectivamente, e 20,7% para o óleo comercial.
A atividade antioxidante dos compostos, representada pelo valor de EC50, é calculada pela redução de 50% da concentração inicial de DPPH•. Ressalta-se que, quanto menor o valor de EC50, maior a atividade antioxidante do composto analisado. A quantidade de óleo necessária para decrescer a concentração inicial de DPPH• em 50% (EC50) foi de 46,5; 60,6 e 50,0 μg/mL para Margarida, Hass e comercial, respectivamente.
O sistema FRAP é comumente utilizado para estudar a atividade antioxidante de frutos e plantas. Os valores de atividade antioxidante dos óleos estudados foram 79,1, 71,2 e 72,2 µM Trolox/100 g para Margarida, Hass e comercial, respectivamente. Saura-Calixto e Goňi (2006) encontraram 152,0 e 65,3 µM Trolox/100 g para óleos de oliva e girassol, respectivamente, enquanto Cheung, Szeto e Benzie (2007) obtiveram valores de 40,0 e 10,0 µM Trolox/100 g para óleos de canola e milho, respectivamente.
Para o sistema da capacidade antioxidante por meio do ABTS•+, os óleos das variedades Margarida e Hass, e o comercial apresentaram valores de 7,9; 5,0 e 5,4 µM Trolox/100 g, respectivamente. Nakib et al. (2010), em estudo realizado com óleos de oliva extra virgem de duas cultivares da Tunísia, encontraram 2,4 µM Trolox/kg para a cultivar Chétoui e 0,6 µM Trolox/kg para a Chemlali. Foi realizado o estudo da correlação entre a estabilidade oxidativa, teor de tocoferóis totais e os métodos de atividade antioxidante (DPPH•, FRAP e ABTS•+), cujos resultados estão apresentados na Tabela 16. A atividade antioxidante correlacionou-se significativamente com a quantidade de tocoferóis totais, ou seja, óleos com maiores concentrações de tocoferóis apresentaram maiores atividades antioxidantes. A atividade antioxidante não se correlacionou positivamente com a estabilidade oxidativa dos óleos analisados no presente estudo, indicando que os óleos com maior atividade antioxidante apresentam menor estabilidade oxidativa.

CONCLUSÕES
Os óleos das variedades Margarida e Hass, e comercial apresentaram índices de acidez e peróxidos inferiores aos estabelecidos pela legislação. O índice de estabilidade oxidativa e o teor de clorofila apresentaram maiores valores para o comercial, seguidos pelas variedades Hass e Margarida.
Dentre os ácidos graxos, o oleico foi predominante nos óleos. O da variedade Margarida apresentou concentração superior de ácidos palmítico, linoleico e α-linolênico, enquanto o da variedade Hass apresentou quantidade expressiva de palmitoleico. O óleo da variedade Margarida foi o que apresentou maiores porcentagens de ácidos graxos saturados e poli-insaturados. Para o óleo da variedade Margarida, os triacilgliceróis obtidos em maiores quantidades foram: POO, OOO, OLO, PLO e POP, enquanto para a variedade Hass, foram: POO, OOO, OLO, OPoO e PPoO. Já para o comercial, os que mais se destacaram foram OOO, POO e OLO, o que é confirmado pela sua quantidade significativa de ácido oleico.
Dentre os fitosteróis, o constituinte principal encontrado foi o β-sitosterol para os três óleos, sobressaindo-se no óleo da variedade Margarida. Também foram identificados teores significativos de ∆7-avenasterol nos óleos estudados. O óleo da variedade Margarida apresentou quantidade de fitosteróis totais superior aos demais. Os teores de fitosteróis nos óleos de abacate extraídos por centrifugação foram superiores aos encontrados nos óleos extraídos por Bligh & Dyer. Pode-se considerar que o método de extração por centrifugação foi melhor na extração e preservação desses compostos. O α-tocoferol foi predominante nos óleos estudados, com destaque no óleo da variedade Margarida. O valor de vitamina E foi superior para o óleo Margarida, seguidos por Hass e comercial. Nota-se por meio dos métodos Bligh & Dyer e Soxhlet, o potencial dos óleos de abacate em tocoferóis, devido aos elevados valores encontrados, superiores aos dos óleos extraídos por centrifugação e por apresentarem o γ-tocoferol em quantidades significativas.
Os óleos apresentaram comportamento similar entre os sistemas DPPH•, FRAP e ABTS•+. O óleo da variedade Margarida, demonstrou maior atividade antioxidante e Hass obteve menor atividade pelos sistemas estudados. A atividade antioxidante correlacionou-se significativamente com a quantidade de tocoferóis totais, ou seja, óleos com maiores concentrações de tocoferóis apresentaram maiores atividades antioxidantes.
AGRADECIMENTOS
Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelas bolsas de mestrado e produtividade em pesquisa, respectivamente.
REFERÊNCIAS
AMERICAN OIL CHEMITS SOCIETY (AOCS). Official and tentative methods of the American Oil Chemists’ Society: including additions and revisions. 6. ed.Champaign, 2009.
ANTONIOSI FILHO, N. R.; MENDES, O. L.; LANÇAS, F. M. Computer prediction of triacylglycerol composition of vegetable oils by HRGC. Chromatographia, v. 40, p. 557-562, 1995.
BABBAR, N.; OBEROI, H. S.; UPPAL, D. S.; PATIL, R. T. Total phenolic content and antioxidant capacity of extracts obtained from six important fruit residues. Food Research International, Barking, v. 44, n. 1, p. 391-396, 2011.
BEARDSELL, D.; FRANCIS, J.; RIDLEY, D.; ROBARDS, K. Health promoting constituents in plant derived edible oils. Journal of Food Lipids, Trumbull, v. 9, n. 1, p. 1-34, 2002.
BHUYAN, D. J.; ALSHERBINY, M. A.; PERERA, S.; LOW, M.; BASU, A.; DEVI, O. A.; BAROOAH, M. S.; LI, C. G.; PAPOUTSIS, K. The odyssey of bioactive compounds in avocado (Persea americana) and their health benefits. Antioxidants, Basel, v. 8, n. 10, p. 426, 2019.
BLIGH, E. G.; DYER, W. J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, Toronto, v. 37, n. 8, p. 911-917, 1959.
BORGES, S. V.; MAIA, M. C. A.; GOMES, R. C. M.; CAVALCANTI, N. B. Chemical composition of umbu (Spondias tuberosa Arr. Cam) seeds. Química Nova, São Paulo, v. 30, n. 1, p. 49-52, 2007.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC n°. 269, de 22 de setembro de 2005. Diário Oficial da União; Poder Executivo, de 23 de setembro de 2005. Aprova o Regulamento técnico sobre a Ingestão Diária Recomendada (IDR) de proteína, vitaminas e minerais. Brasília, 2005.
CHEUNG, S. C.; SZETO, Y. T.; BENZIE, I. F. Antioxidant protection of edible oils. Plant Foods for Human Nutrition, Dordrecht, v. 62, n. 1, p. 39-42, 2007.
CODEX ALIMENTARIUS COMMISSION. Codex-Stan 210: codex standard for named vegetable oils. Rome, 2009.
COWAN, A. K.; WOLSTENHOLME, B. N. Avocado. In: CABALLERO, B.; FINGLAS, P. M.; TOLDRÁ, F. Encyclopedia of Food and Health. 1st ed. Academic Press: Oxford, 2016. p. 294-300.
DÁVILA, J. A.; ROSENBERG, M.; CASTRO, E.; CARDONA, C. A. A model biorefinery for avocado (Persea americana Mill) processing. Bioresource Technology, Essex, v. 243, p. 17-29, 2017.
DUCHATEAU, G. S. M. J. E.; BAUER-PLANK, C. G.; LOUTER, A. J. H.; VAN DER HAM, M.; BOERMA, J. A.; VAN ROOIJEN, J. J. M.; ZANDBELT, P. A. Fast and accurate method for total 4-desmethy sterol’s, content in spreads, fat-blends and raw materials. Journal of American Oil Chemists’ Society, Chicago, v. 79, n. 3, p. 273-278, 2002.
GUTIÉRREZ-ROSALES, F. Determinación de la estabilidad oxidativa de aceite de oliva vírgenes: comparación entre el método del oxígeno activo (AOM) y el método Rancimat. Grasas y Aceites, Sevilla, v. 40, n.1, p. 1-5, 1989.
GUTIÉRREZ-ROSALES, F.; GARRIDO-FERNÁNDEZ, J.; GALLARDO-GUERRERO, L.; GANDUL-ROJAS, B.; MINGUES-MOSUERA, M. I. Action of chlorophylls on the stability of virgin olive oil. Journal of the American Oil Chemist’s Society, Chicago, v. 69, n. x, p. 866-871, 1992.
JORGE, N.; SILVA, A. C.; MALACRIDA, C. R. Physicochemical characterisation and radical-scavenging activity of Cucurbitaceae seed oils. Natural Product Research, London, v. 29, n. 24, p. 2313-2317, 2015.
KAIJSER, A.; DUTTA, P.; SAVAGE, G. Oxidative stability and lipid composition of macadamia nuts grown in New Zealand. Food Chemistry, London, v. 71, n. 1, p. 67-70, 2000.
KALANTZAKIS, G.; BLEKAS, G.; PEGKLIDOU, K.; BOSKOU, D. Stability and radical scavenging activity of heated olive oil and other vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, n. 4, p. 329-335, 2006.
KAMAL-ELDIN, A. Effect of fatty acids and tocopherols on the oxidative stability of vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, n. 12, p. 1051- 1061, 2006.
LÓPEZ-COBO, A.; GÓMEZ-CARAVACA, A. M.; PASINI, F.; CABONI, M. F.; SEGURA-CARRETERO, A.; FERNÁNDEZ-GUTIÉRREZ, A. HPLC-DAD-ESIQTOF- MS and HPLC-FLD-MS as valuable tools for the determination of phenolic and other polar compounds in the edible part and by-products of avocado. LWT – Food Science and Technology, London, v. 73, p. 505-513, 2016.
LUMLEY, I. D. Frying of foods: principles, changes, new approaches; Varela, G.; Bender, A. E.; Morton, I. D., eds.; Ellis Horwood: Chichester, 1988, p. 166.
MALACRIDA, C.; JORGE, N. Fatty acids and some antioxidant compounds of Psidium guajava seed oil. Acta Alimentaria, Budapest, v. 42, n. 3, p. 371-378, 2013.
MALACRIDA, C.; JORGE, N. Yellow passion fruit seed oil (Passiflora edulis f. flavicarpa): physical and chemical characteristics. Brazilian Archives of Biology and Technology, Curitiba, v. 55, n. 1, p. 127-134, 2012.
MERRILL, L. I.; PIKE, O. A.; OGDEN, L. V.; DUNN, M. L. Oxidative stability of conventional and high-oleic vegetable oils with added antioxidants. Journal of the American Oil Chemists’ Society, Chicago, n. 85, p. 771-776, 2008.
MONTENEGRO, H. W. S. A cultura do abacateiro. São Paulo: Editora Melhoramentos, 1961.
MOO-HUCHIN, V. M.; ESTRADA-MOTA, I.; ESTRADA-LEÓN, R.; CUEVAS-GLORY, L.; ORTIZ-VÁZQUEZ, E.; VARGAS, M. L. V.; BETANCUR-ANCONA, D.; SAURI-DUCH, E. Determination of some physicochemical characteristics, bioactive compounds and antioxidant activity of tropical fruits from Yucatan, Mexico. Food Chemistry, London, v. 152, n. 1, p. 508-515, 2014.
NAKBI, A.; ISSAOUI, M.; DABBOU, S.; KOUBAA, N.; ECHBILI, A.; HAMMAMI, M.; ATTIA, N. Evaluation of antioxidant activities of phenolic compounds from two extra virgin olive oils. Journal of Food Composition and Analysis, San Diego, v. 23, n. 7, p. 711-715, 2010.
OLIVEIRA A. F., CRUZ M. C. M., OLIVEIRA D. L., SILVA L. F. O. Óleo de abacate, uma alternativa para o azeite de oliva. Circular Técnica da Empresa de Pesquisa Agropecuária de Minas Gerais, Belo Horizonte, n. 114, p. 1-5, 2010.
RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A. S.; YANG, M.; RICE-EVANS, C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology & Medicine, New York, v. 26, n. 9, p. 1231-1237, 1999.
RICHARD, D.; KEFI, K.; BARBE, U.; BAUSERO, P.; VISIOLI, F. Polyunsaturated fatty acids as antioxidants. Pharmacological Research, London, v. 57, n. 6, p. 451-455, 2008.
SALGADO, J. M.; DANIELI, F.; REGITANO-D’ARCE, M. A. B.; FRIAS, A.; MANSI, D. N. O óleo de abacate (Persea americana Mill) como matéria-prima para a indústria alimentícia. Ciência e Tecnologia de Alimentos, Campinas, v. 28, p. 20-26, 2008.
SAURA-CALIXTO, F.; GOŇI, I. Antioxidant capacity of the Spanish Mediterranean diet. Food Chemistry, London, v. 94, n. 3, p. 442-447, 2006.
SCHMIDT, S.; POKORNÝ, J. Potential application of oilseeds as sources of antioxidants for food lipids – a review. Czech Journal of Food Science, Prague, v. 23, n. 3, p. 93-102, 2005.
SHAHIDI, F.; NACZK, M. Food phenolics: sources, chemistry, effects and applications. Lancaster: Technomic, 1995.
SZYDŁOWSKA-CZERNIAK, A.; DIANOCZKI, C.; RECSEG, K.; KARLOVITS, G. Y.; SZŁYK, E. Determination of antioxidant capacities of vegetable oils by ferric-ion spectrophotometric methods. Talanta, London, v. 76, n. 4, p. 899-905, 2008.
TANGO, J. S.; CARVALHO, C. R. L.; SOARES, N. B. Caracterização física e química de frutos de abacate visando a seu potencial para extração de óleo. Revista Brasileira de Fruticultura, Jaboticabal, v. 26, n. 1, p. 17-23, 2004.
TUBEROSO, C. I. G., KOWALCZYK, A., SARRITZU, E., CABRAS, P. Determination of antioxidant compounds and antioxidant activity in commercial oilseeds for food use. Food Chemistry, London, v. 103, n. 4, p. 1494-1501, 2007.
VILLA-RODRIGUEZ, J. A.; YAHIA, E. M.; GONZÁLEZ-LEÓN, A.; IFIE, I.; ROBLES-ZEPEDA, R. E.; DOMÍNGUEZ-AVILA, J. A.; GONZÁLEZ-AGUILAR, G. A. Ripening of ‘Hass’ avocado mesocarp alters its phytochemical profile and the in vitro cytotoxic activity of its methanolic extracts. South African Journal of Botany, Amsterdam, v. 128, p. 1-8, 2020.


