
TÉCNICAS DE SÍNTESE DE LIPOSSOMAS APLICADOS À BACTERIOCINAS
Capítulo de livro publicado no livro Ciência e tecnologia de alimentos: Pesquisas e avançosPara acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062060-10
Este trabalho foi escrito por:
Mariana Teixeira de Avila ¹; Camila Ramão Contessa ²; Mariano Michelon ³; Caroline Costa Moraes 4; Janaína Fernandes de Medeiros Burket 5
1Graduanda de Engenharia Bioquímica – FURG. – Email: [email protected]
2Doutoranda do Programa de Pós-Graduação em Engenharia e Ciência de Alimentos – PPGECA – FURG. E-mail: [email protected]
3Docente no Programa de Pós-Graduação em Engenharia e Ciência de Alimentos – PPGECA – FURG. E-mail: [email protected]
4Docente no Programa de Pós-Graduação em Ciência e Engenharia de Materiais – PPGCEM – UNIPAMPA. E-mail: [email protected]
5Docente no Programa de Pós-Graduação em Engenharia e Ciência de Alimentos – PPGECA da Universidade Federal do Rio Grande – FURG. E-mail: [email protected]
Resumo: Com o atual interesse em temáticas como plant-based e os avanços tecnológicos, há uma busca por novas tecnologias para a conservação de produtos alimentícios visando a segurança dos alimentos e a ausência de conservantes químicos, visto os malefícios que estes causam a saúde. Conservantes naturais, como as bacteriocinas, são alternativas promissoras como substituintes aos conservantes químicos. No entanto, sua instabilidade quando aplicados em matrizes alimentícias complexas caracteriza-se como uma limitação. Os lipossomas são pequenas vesículas, podendo variar de dimensões nanométricas até micrométricas, que contém um núcleo interno aquoso e uma membrana formada por fosfolipídios em bicamadas. A estrutura de núcleo hidrofílico e bicamada fosfolipídica, além da composição de sua parede semelhante à das membranas celulares, os torna veículos eficientes. O objetivo desta revisão é abordar aspectos gerais sobre o encapsulamento de bacteriocinas, sobretudo em lipossomas, afim de melhorar sua estabilidade como conservantes naturais para alimentos. A obtenção de lipossomas pode se dar por uma variedade de técnicas, envolvendo quatro princípios básicos: secagem dos lipídios dissolvidos em solvente orgânico, exposição dos lipídios em solução aquosa, purificação do lipossoma e análise do produto final. Assim, vale ressaltar que testes com diferentes solventes orgânicos devem ser realizados e estudos para o escalonamento da produção se fazem necessários, afim de analisar a possibilidade de encapsulamento e aplicação dos lipossomas em escala industrial, visto que o tema se mostra promissor.
Palavras–chave: antibacteriano; biossegurança; encapsulação; nanolipossoma;
Nos últimos anos, houve um crescente interesse das políticas públicas de alimentação e dos consumidores, além do constante avanço tecnológico, por novas tecnologias para a conservação de alimentos visando a segurança alimentar, a ausência de conservantes químicos e o mínimo de processamento (1,2). No entanto, a fabricação de produtos alimentícios com baixa ou nenhuma quantidade de conservantes químicos pode resultar na diminuição da vida útil do alimento e aumentar a possibilidade de proliferação de microrganismos deterioradores e patogênicos (3). Assim, uma alternativa para este aspecto é a utilização de antimicrobianos naturais, como as bacteriocinas (4).
As bacteriocinas são definidas como substâncias de natureza proteica com capacidade antimicrobiana em determinadas concentrações, sintetizadas no ribossomo de procariotos, que possuem massa molecular de 3 a 10 kDa e 20-60 aminoácidos, são catiônicas e possuem ponto isoelétrico elevado. Há variação quanto ao seu espectro de ação de acordo com o microrganismo produtor, propriedades bioquímicas e peso molecular. São classificadas em 3 classes: I (lantibióticos), II (não-lantibióticos) e III (termolábeis) (5–7). Devido mostrarem-se seguras e eficazes como conservantes naturais, além de seu amplo espectro bacteriano, o interesse quanto ao uso das bacteriocinas cresceu (2,8).
No geral, as bacteriocinas nos alimentos podem ser afetadas por condições físicas, químicas e biológicas que podem influenciar negativamente seu uso como bioconservantes, levando a uma interferência na sua atuação ou sua inativação total (9). Uma estratégia que pode ser utilizada para contornar a instabilidade das bacteriocinas causada por essa interação indesejada é o uso de metodologias de encapsulação, como a encapsulação em lipossomas (10,11).
Os lipossomas são partículas esféricas constituídas por uma ou mais bicamadas fosfolipídicas concêntricas separadas por compartimentos aquosos (12). Sua estrutura é atribuída devido à natureza anfipática dos fosfolipídios, caracterizados por uma região polar, capaz de interagir com a água, e uma apolar constituída por uma ou duas cadeias carbonatadas. A composição de sua parede faz com que sejam sistemas de transporte biocompatíveis, biodegradáveis, atóxicos e não imunogênicos (13,14). Assim, podem ser utilizados para encapsulação de substâncias hidrofílicas em seu núcleo e compostos hidrofóbicos em sua bicamada, fazendo com que forneçam proteção aos compostos ativos instáveis contra as condições do ambiente e promovam melhorias em sua absorção e biodisponibilidade (14,15).
Diante do exposto, esta revisão tem por objetivo abordar aspectos gerais sobre o encapsulamento de bacteriocinas, sobretudo em lipossomas, afim de melhorar sua estabilidade como conservantes naturais para alimentos.
ENCAPSULAMENTO DE COMPOSTOS ATIVOS
Diversos alimentos contêm compostos ativos, como vitaminas, compostos fenólicos, ácidos graxos essenciais, óleos essenciais, entre outros. A maioria desses são hidrofóbicos ou pouco solúveis em água, além de apresentarem baixa estabilidade devido à sensibilidade frente a alguns fatores (15). Dentre as estratégias para melhorar o desempenho e a instabilidade de alguns compostos ativos, estão as tecnologias de encapsulação (16). A encapsulação pode ser definida como uma técnica de isolamento ou “blindagem” de uma substância ou partícula dentro de outra substância, que constituirá a parede da célula (17,18). O processo engloba a formação de dois tipos de partículas: cápsulas e esferas (Figura 1). As cápsulas são sistemas do tipo reservatório, onde o núcleo se concentra na região central e está envolto por uma camada do agente encapsulante. Enquanto nas esferas o núcleo é envolvido em uma rede matricial, constituída por um polímero que dá formação a uma cadeia tridimensional onde uma parte do núcleo pode estar adsorvida na superfície da partícula, incorporada ou ligada covalentemente à matriz polimérica (19).
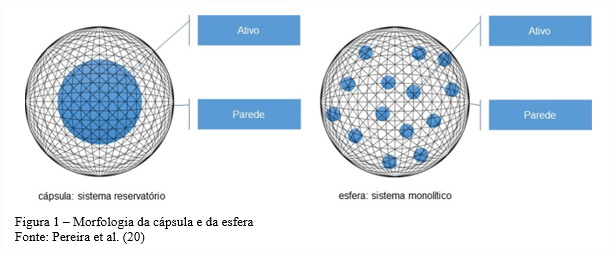
A técnica de encapsulação pode ser utilizada afim de estabilizar o material encapsulado, atuar com liberação sustentada, controlar as reações oxidativas, mascarar sabores, cores ou odores, proteger os compostos de valor nutricional e prolongar a vida útil (21). É importante salientar que apesar de aumentar a dispersão dos compostos pouco solúveis em água, não deve causar alterações nas propriedades sensoriais dos produtos alimentícios (17).
Variados procedimentos de encapsulação vêm sendo propostos, porém nenhum destes pode ser considerado como aplicação universal para os compostos ativos, uma vez que eles têm sua própria estrutura molecular característica. Isto é, demonstram diversas diferenças em relação a massa molecular, polaridade, solubilidade, entre outros. Assim, diferentes técnicas de encapsulação devem ser aplicadas, a fim de satisfazer os requisitos físico-químicos e moleculares de cada composto, além de resistir às condições externas (18,22)
As técnicas de encapsulação são classificadas em três grupos: i) métodos físicos, incluindo secagem por spray-dryer, liofilização, precipitação de fluído super crítico e evaporação de solvente; ii) métodos físico-químicos, como coacervação complexa, lipossomas e gelificação iônica; iii) métodos químicos, sendo polimerização interfacial e complexação por inclusão molecular (23).
A encapsulação em lipossomas tem sido utilizada em estudos com compostos ativos em alimentos (12,24–26), para desenvolver sistemas de liberação frente a fatores como pH, temperatura, luz e oxigênio. Além de apresentar capacidade de encapsular moléculas hidrofílicas e hidrofóbicas simultaneamente e alta flexibilidade na composição, tamanho e compatibilidade com tecidos animais devido sua estrutura (27).
LIPOSSOMAS
Os lipossomas (LPS) são um dos transportadores mais antigos, utilizados para a entrega de agentes bioativos às células e tecidos, protegendo-os de barreiras fisiológicas. Constituídos principalmente por fosfolipídios anfifílicos, seu revestimento aumenta o tempo de vida in vitro além de permitir que estes se acumulem nos sítios de destino (28,29). São vesículas coloidais, com tamanho que pode variar da escala nanométrica à micrométrica formadas por bicamadas fosfolipídicas (lamelas) orientadas de forma concêntrica em torno de um núcleo aquoso (Figura 2) (12,30). Esse núcleo permite realizar o carregamento de substâncias hidrofílicas, assim ocorrendo um ganho de eficácia da substância ativa (30).
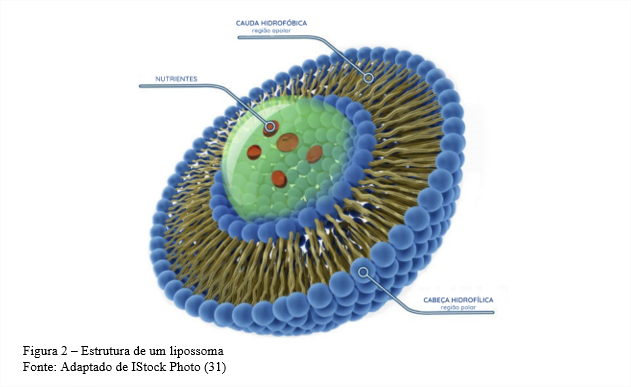
Sua estrutura contém fosfolipídios insolúveis em água, no entanto, em meio aquoso formam dispersões e se ordenam em agregados, devido as interações hidrofílicas em regiões polares e hidrofóbicas em regiões apolares, originando as bicamadas fosfolipídicas. Isso permite que o exterior do lipossoma seja hidrofílico e seu núcleo envolto por uma membrana lipofílica (27,31). A parede destes tem como principais materiais: fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidilserina (PS) e fosfatidilglicerol (PG) (28,32).
Os LPS podem apresentar carga superficial (positiva ou negativa) ou serem Zwitteriônico, o que depende de sua composição e permitem o encapsulamento de compostos hidrofílicos, hidrofóbicos e anfifílicos, melhorando sua farmacocinética e protegendo contra a atividade hidrolítica de enzimas (30,33,34). Além disso, também podem variar quanto suas propriedades físico-químicas, como tamanho, composição lipídica, número e fluidez da bicamada fosfolipídica (35).
Com base na estrutura, os lipossomas podem ser classificados em duas categorias, vesículas multilamelares (MLV, MultiLamellar Vesicles) e unilamelares, de acordo com o número de bicamadas fosfolipídicas. As unilamelares podem ser sub-classificadas pelo tamanho, em gigantes (GUV, Giant Unilamellar Vesicles), grandes (LUV, Larga Unilamellar Vesicles) e pequenas (SUV, Small Unilamellar Vesicles). Enquanto os lipossomas unilamelares possuem apenas uma camada fosfolipídica em torno de um compartimento aquoso, os MLV apresentam uma estrutura onde diversos lipossomas unilamelares se formam no interior de outro lipossoma, apresentando as bicamadas fosfolipídicas separadas por compartimentos aquosos (36,37).
TÉCNICAS DE SÍNTESE DE LIPOSSOMAS
A formação dos lipossomas ocorre quando os fosfolipídios interagem com moléculas de água, onde os grupos polares finais dos fosfolipídios são expostos a fase aquosa e as caudas hidrofóbicas dos hidrocarbonetos são forçadas a formar uma bicamada. Assim torna-se possível a encapsulação de solutos presentes no meio aquoso (38).
A escolha da técnica de obtenção de lipossomas depende de alguns parâmetros, sendo eles i) características físico-químicas do material a ser encapsulado; ii) concentração e toxicidade da substância encapsulada; iii) possibilidade de produção em larga escala (39,40).
As técnicas convencionais de obtenção de lipossomas seguem quatro princípios básicos: i) secagem de lipídios dissolvidos em solvente orgânico, permitindo a distribuição uniforme destes na mistura; ii) exposição de lipídios em meio aquoso, ocorrendo a formação das bicamadas lipídicas; iii) purificação de lipossomas, afim de remover compostos indesejáveis; iv) análise do produto final (41).
Na literatura, são encontradas diversas técnicas para sua obtenção, que incluem hidratação do filme lipídico, evaporação em fase reversa, pró-lipossomas, injeção de solvente e remoção de detergente. Ademais, algumas técnicas para promover a redução do tamanho dos lipossomas também vêm sendo utilizadas, como: ultrassom, extrusão de alta pressão e microfluidização (40,42). A técnica de hidratação do filme lipídico, também conhecida como método de Bangham, é uma das primeiras técnicas para obtenção de lipossomas e a mais utilizada. Consiste na solubilização de lipídios em solvente orgânico, seguida pela etapa de evaporação do mesmo, o que resulta em um filme lipídico seco no fundo de um balão de vidro. Posteriormente o filme é hidratado através da adição de um meio aquoso e submetido ao processo de agitação, onde ocorre a formação dos lipossomas (Figura 3) (43,44).
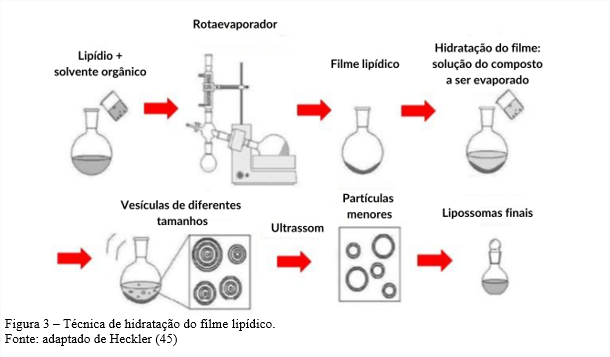
A evaporação em fase reversa baseia-se na dissolução dos fosfolipídios em solvente orgânico. Posteriormente o composto bioativo a ser encapsulado é injetado nessa solução e é homegeneizada no ultrassom originando uma microemulsão água-em-óleo. Com a remoção do solvente em rotaevaporador com baixo vácuo, é originado um gel. O gel é submetido à agitação em vórtex, fazendo com que sofra colapso e a suspensão de lipossomas seja formada (41).
Na técnica pró-lipossomas ocorre o preparo da mistura de lipídios secos, posteriormente a mistura é hidratada para formação de lipossomas MLV. As partículas secas podem ser produzidas através de atomização, que resulta em estruturas amorfas, significativamente mais fáceis de hidratar se comparado a outros métodos (38).
O método de injeção de etanol consiste em injetar uma solução de etanol contendo fosfolipídios em água pura. Nessa etapa, as fases aquosa e orgânica entram em contato diluindo imediatamente o etanol na fase aquosa. Assim, ocorre a auto agregação das moléculas formando fragmentos de bicamadas. Durante o processo o sistema é agitado, levando a organização das bicamadas e, consequentemente, a formação dos lipossomas (47).
Remoção de detergente é uma técnica baseada na solubilidade de lipídios em detergente, onde são formadas micelas mistas de detergente/lipídio. A formação dos lipossomas ocorre na remoção do detergente através de diálise. Esse método forma diferentes tipos de lipossomas e tem capacidade de produzir lipossomas com distribuição de tamanhos homogênea (38).
De modo complementar, a Tabela 1 apresenta as vantagens e desvantagens das técnicas de obtenção dos lipossomas.
BACTERIOCINAS ENCAPSULADAS
Peptídeos antimicrobianos têm sido estudados como potenciais bioconservantes devido a atividade antimicrobiana em sua forma isolada. No entanto, podem sofrer redução em seu efeito devido à degradação proteolítica e a interação do peptídeo com lipídios e proteínas presentes no alimento. Assim, o encapsulamento de bacteriocinas em lipossomas é uma alternativa devido ao potencial de atividade biológica, aumento de estabilidade e proteção contra a degradação molecular (7,44,49).
Em um estudo, Malheiros, Daroit e Brandelli (50) investigaram a eficácia de nisina encapsulada em nanolipossomas, em comparação a nisina livre, frente a Listeria monocytogenes em queijo minas frescal. O encapsulamento da nisina comercial em lipossomas de lecitina de soja parcialmente purificada foi realizado pelo método de hidratação do filme lipídico. Os resultados obtidos mostraram que a nisina livre apresentou efeito bactericida e a encapsulada apenas efeito bacteriostático., no entanto, isso ocorreu pela inibição da atividade da nisina provocada pela lecitina, possivelmente pela formação de complexos nisina-fosfolipídeos estáveis.
Malheiros et al. (51) encapsularam a bacteriocina P34, através do método de hidratação do filme lipídico, em lipossomas preparados com fosfadilcolina de soja parcialmente purificada apresentando resultados com alta eficiência de encapsulação e estabilidade durante o armazenamento, além de apresentar ação contra a bactéria patogênica L. monocytogenes.
Jiao et al. (52) investigaram a atividade anti-listerial da bacteriocina CAMT2 encapsulada em nanolipossomas de fosfatidilcolina comparada a CAMT2 livre. A encapsulada apresentou alta atividade anti-listerial em ágar e aumento na estabilidade em alimentos à temperatura de refrigeração (4°C). Em leite desnatado refrigerado, ambas apresentaram bom efeito. Ainda assim, em leite integral a bacteriocina encapsulada apresentou melhor desempenho.
A estabilidade e a liberação sustentada de pediocina extraída de Pediococcus pentosaceus KC692718 apresentaram melhoras no desempenho devido ao encapsulamento em nanolipossomas, diminuindo 2 log de L. monocytogenes em meio com caldo de soja tríptico e extrato de levedura durante 48h de incubação (53).
A aplicação de bacteriocinas encapsuladas em alimentos tem sido focada principalmente em leite cru, queijo e produtos cárneos devido sua capacidade de inibir o crescimento de L. monocytogenes. Apesar de apresentarem eficiência contra um amplo espectro de patógenos de origem alimentar, poucos estudos foram feitos a respeito de seu uso para a conservação de frutas, sucos, vegetais, creme e iogurte (54). Nesse sentido, lipossomas carregados com bacteriocinas, permitem o aumento da estabilidade, além de proporcionar em alguns casos, a liberação gradual e sustentada destes compostos proteicos.
CONCLUSÕES
Com a busca por alimentos mais saudáveis e seguros, a técnica de encapsulação em lipossomas se apresenta como uma abordagem viável e eficiente para contornar a instabilidade das bacteriocinas frente a matrizes alimentícias complexas. A estrutura dos lipossomas proporciona melhorias na biodisponibilidade e adsorção, além de aumentar a estabilidade. A tecnologia de lipossomas tem sido aplicada em produtos alimentícios, no entanto, vale ressaltar que por se te tratar do encapsulamento de bacteriocinas cuja origem é proteica, testes com diferentes solventes orgânicos devem ser realizados. Além disso, estudos para o escalonamento da produção devem ser avaliados, afim de analisar a possibilidade de encapsulamento e aplicação dos lipossomas em escala industrial.
REFERÊNCIAS
- Dwivedi S, Prajapati P, Vyas N, Malviya S, Kharia A. A review on food preservation: Methods, harmful effects and better alternatives. Asian J Pharm Pharmacol. 2017;3(6).
- Cleveland J, Montville TJ, Nes IF, Chikindas ML. Bacteriocins: safe, natural antimicrobials for food preservation. Int J Food Microbiol. 2001;71(1):1–20.
- Mills S, Ross RP, Hill C. Bacteriocins and bacteriophage; a narrow-minded approach to food and gut microbiology. Vol. 41, FEMS Microbiology Reviews. Oxford University Press; 2017. p. S129–53.
- Hammami R, Fliss I, Corsetti A. Editorial: Application of protective cultures and bacteriocins for food biopreservation. Vol. 10, Frontiers in Microbiology. Frontiers Media S.A.; 2019.
- Chikindas ML, Weeks R, Drider D, Chistyakov VA, Dicks LM. Functions and emerging applications of bacteriocins. Vol. 49. Current Opinion in Biotechnology. 2018.
- Sulthana R, Archer AC. Bacteriocin nanoconjugates: boon to medical and food industry. Vol. 131, Journal of Applied Microbiology. 2021.
- Contessa CR, Moraes CC, Burkert JFM. Bacteriocinas enquanto conservante alimentar. Pesquisas e Atualizações em Ciência dos Alimentos. Agron Food Academy. 2022.
- Sobrino-López A, Martín-Belloso O. Use of nisin and other bacteriocins for preservation of dairy products. Int Dairy J. 2008;18(4):329–43.
- Singh VP. Recent approaches in food bio-preservation – a review. Vol. 8. Open Veterinary Journal. 2018.
- Soltani S, Hammami R, Cotter PD, Rebuffat S, Said LB, Gaudreau H, et al. Bacteriocins as a new generation of antimicrobials: Toxicity aspects and regulations. Vol. 45, FEMS Microbiology Reviews. 2021.
- Lopes NA, Brandelli A. Nanostructures for delivery of natural antimicrobials in food. Crit Rev Food Sci Nutr. 2018;58(13).
- Mattos MVC, Michelon M, Burkert JFM. Production and stability of food-grade liposomes containing microbial carotenoids from Rhodotorula mucilaginosa. Food Structure. 2022 Jul;33:100282.
- Chen W, Zou M, Ma X, Lv R, Ding T, Liu D. Co-encapsulation of EGCG and quercetin in liposomes for optimum antioxidant activity. J Food Sci. 2019;84(1).
- Gulzar S, Benjakul S. Characteristics and storage stability of nanoliposomes loaded with shrimp oil as affected by ultrasonication and microfluidization. Food Chem. 2020;310:125916.
- Rezaei A, Fathi M, Jafari SM. Nanoencapsulation of hydrophobic and low-soluble food bioactive compounds within different nanocarriers. Food Hydrocoll. 2019;88:146–62.
- Arribas C, Cabellos B, Cuadrado C, Guillamón E, Pedrosa MM. Cooking effect on the bioactive compounds, texture, and color properties of cold-extruded rice/bean-based pasta supplemented with whole carob fruit. Foods. 2020;9(4).
- Sauvant P, Cansell M, Hadj Sassi A, Atgié C. Vitamin A enrichment: Caution with encapsulation strategies used for food applications. Food Research International. 2012;46(2):469–79.
- Vos P, Faas MM, Spasojevic M, Sikkema J. Encapsulation for preservation of functionality and targeted delivery of bioactive food components. Int Dairy J. 2010;20(4):292–302.
- Souza PK. Microemcapsulação de extratos vegetais e suas aplicações: Revisão sistemática. Bagé; 2021.
- Pereira KC, Ferreira DC, Alvarenga GF, Pereira MS, Barcelos MC, Costa JM. Microencapsulation and release controlled by the diffusion of food ingredients produced by spray drying: A review. Brazilian Journal of Food Technology. 2018;21.
- Menezes CR, Barin JS, Chicoski AJ, Zepka LQ, Jacob-Lopes E, Fries LL, Terra NN. Microencapsulation of probiotics: progress and prospects. 2013;(7):1309–16.
- Betoret E, Betoret N, Vidal D, Fito P. Functional foods development: Trends and technologies. Trends Food Sci Technol. 2011;22(9):498–508.
- Ozkan G, Franco P, de Marco I, Xiao J, Capanoglu E. A review of microencapsulation methods for food antioxidants: Principles, advantages, drawbacks and applications. Food Chem. 2019;272:494–506.
- González-Ortega R, Šturm L, Skrt M, di Mattia CD, Pittia P, Poklar Ulrih N. Liposomal encapsulation of oleuropein and an olive leaf extract: Molecular interactions, antioxidant effects and applications in model food systems. Food Biophys. 2021;16(1).
- Pettinato M, Trucillo P, Campardelli R, Perego P, Reverchon E. Bioactives extraction from spent coffee grounds and liposome encapsulation by a combination of green technologies. Chemical Engineering and Processing – Process Intensification. 2020;151.
- Sarkar A, Carvalho E, D’souza AA, Banerjee R. Liposome-encapsulated fish oil protein-tagged gold nanoparticles for intra-articular therapy in osteoarthritis. Nanomedicine. 2019;14(7):871–87.
- Maurya VK, Bashir K, Aggarwal M. Vitamin D microencapsulation and fortification: Trends and technologies. J Steroid Biochem Mol Biol. 2020;196:105489.
- Hasan M, Elkhoury K, Belhaj N, Kahn C, Tamayol A, Barberi-Heyob M, et al. Growth-inhibitory effect of chitosan-coated liposomes encapsulating curcumin on MCF-7 breast cancer cells. Mar Drugs. 2020;18(4).
- Melo VF, Coelho JL, Sousa CM, Fernandes EA, Brito RT, Santana WJ. Pharmacological applications of controlled release drugs. Amadeus International Multidisciplinary Journal. 2020;5(9):124–8.
- Wang DY, van der Mei HC, Ren Y, Busscher HJ, Shi L. Lipid-based antimicrobial delivery-Systems for the Treatment of Bacterial Infections. Vol. 7, Frontiers in Chemistry. 2020.
- IStock Photo [Internet]. 2019 [acesso em 25 Fev 2023]. Disponível em: https://www.istockphoto.com/br/vetor/estrutura-de-lipossomas-gm1126691190-296720909
- Luna-Herrera J, Pérez-Martínez DE, Barradas-Hernández VM, Zenteno-Cuevas R. Nanoparticles as drug transporters: A promising tool against tuberculosis. Rev Peru Med Exp Salud Publica. 2021;38(1):143–52.
- Li Y, Li X, Lu Y, Chaurasiya B, Mi G, Shi D, et al. Co-delivery of Poria cocos extract and doxorubicin as an ‘all-in-one’ nanocarrier to combat breast cancer multidrug resistance during chemotherapy. Nanomedicine. 2020;23.
- Sandoval-Yañez C, Rodriguez CC. Dendrimers: Amazing platforms for bioactive molecule delivery systems. Vol. 13, Materials. 2020.
- Santos NC, Castanho MA. Lipossomas: a bala mágica acertou? Quim Nova. 2002;25(6b).
- Barros NB, Macedo SRA, Ferreira AS, Tagliari MP, Zanchi FB, Kayano AM, et al. Liposomes containing an ASP49-phospholipase A2 from Bothrops jararacussu snake venom as experimental therapy against cutaneous leishmaniasis. Int Immunopharmacol. 2016;36:225–31.
- Batista CM, Carvalho CM, Magalhães NS. Lipossomas e suas aplicações terapêuticas: estado da arte. Revista Brasileira de Ciências Farmacêuticas. 2007;43(2):167–79.
- Lopes NA. Desenvolvimento de lipossomas nanométricos para armazenamento e liberação controlada de peptídeos antimicrobianos. Porto Alegre; 2018.
- Deodhar S, Dash AK. Long circulating liposomes: challenges and opportunities. Ther Deliv. 2018;9(12):857–72.
- Bozzuto G, Molinari A. Liposomes as nanomedical devices. Int J Nanomedicine. 2015;975.
- Neves MT, Santos FR, Gonçalves DJR, Fernandes JG, Justino HFM, Júnior BRC, et al. Uso da tecnologia de lipossomas no encapsulamento de compostos bioativos – Revisão. The Journal of Engineering and Exact Sciences. 2021;7(4).
- Pinilla CMB. Estudo da estabilidade em longo prazo e aplicação de nanolipossomas contendo nisina e extrato de alho. Porto Alegre: Universidade Federal do Rio Grande do Sul; 2020.
- Bertolini D. Coemcapsulação em lipossomas de compostos bioativos provenientes de cultivo de Chryseobacterium sp. kr6. Porto Alegre; 2019.
- Maherani B, Arab-Tehrany E, R. Mozafari M, Gaiani C, Linder M. Liposomes: A review of manufacturing techniques and targeting strategies. Curr Nanosci. 2011;7(3):436–52.
- Heckler C. Avaliação do potencial inibitório de timol e carvacrol livres e encapsuladosem nanovesículas sobre um pool de Staphylococcus aureus aderido em aço inoxidavel. Disponível em: https://www.lume.ufrgs.br/bitstream/handle/10183/175456/Poster_52062.pdf?sequence=2. 2017.
- Oliveira JÉ. Estudos de caracterização e aplicação de lipossomas associados à peptídeos antifúngicos derivados de histitina-5 visando o combate de candida albicans. Universidade Estadual Paulista “Júlio de Mesquita Filho”; 2022.
- Melo AC. Sistemas de nanopartículas de base lipídica para a entrega de ácidos nucleicos. [Coimbra]: Universidade de Coimbra; 2022.
- Bangham AD, Standish MM, Watkins JC. Diffusion of univalent ions across the lamellae of swollen phospholipids. J Mol Biol. 1965;13(1):238-IN27.
- Terra ALM, Contessa CR, Rasia TA, Vaz BS, Moraes CC, Burkert JFM, et al. Nanotechnology Perspectives for Bacteriocin Applications in Active Food Packaging. Industrial Biotechnology. 2022;18(3):137–46.
- Malheiros PS, Daroit DJ, Brandelli A. Inhibition of Listeria monocytogenes in minas frescal cheese by free and nanovesicle-encapsulated nisin. Brazilian Journal of Microbiology. 2012;43(4):1414–8.
- Malheiros PS, Sant’Anna V, Micheletto YM, da Silveira NP, Brandelli A. Nanovesicle encapsulation of antimicrobial peptide P34: physicochemical characterization and mode of action on Listeria monocytogenes. Journal of Nanoparticle Research. 2011;13(8):3545–52.
- Jiao D, Liu Y, Liu Y, Zeng R, Hou X, Nie G, Sun L, Fang Z. Preparation of phosphatidylcholine nanovesicles containing bacteriocin CAMT2 and their anti-listerial activity. Food Chem. 2020;314:126244. doi: 10.1016/j.foodchem.2020.126244. Epub 2020 Jan 18. PMID: 31982854.
- Soto KM, Hernández-Iturriaga M, Loarca-Piña G, Luna-Bárcenas G, Mendoza S. Antimicrobial effect of nisin electrospun amaranth: pullulan nanofibers in apple juice and fresh cheese. Int J Food Microbiol. 2019;295:25–32.
- Eghbal N, Viton C, Gharsallaoui A. Nano and microencapsulation of bacteriocins for food applications: A review. Food Biosci. 2022;50.
.
