
MICROPLÁSTICO NO TRATO INTESTINAL DO PEPINO DO MAR Holothuria (Halodeima) grisea Selenka 1867
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-1
Este trabalho foi escrito por:
Anna Rafaela Rodrigues dos Santos*; Maria Helena Sousa Lima
*Anna Rafaela Rodrigues dos Santos (Corresponding author) – Email: [email protected]
Resumo: Com o crescimento da pesca comercial do pepino mar Holothuria (Halodeima) grisea, principalmente para o consumo de países asiáticos, tem sido fundamental compreender a ecologia trófica desse animal. Com isso, objetivou-se verificar se o conteúdo intestinal de Holothuria (Halodeima) grisea coletados na Praia de Barra Grande, Cajueiro da Praia, Piauí possui microplástico. Nesta região H. grisea é encontrada em costões rochosos, substratos moles e em pradarias de capim agulha (Halodule wrigthii). Os pepinos foram coletados em três áreas, denominadas: pradaria, área 1 (mais próximo a pradaria) e área 2 (mais distante da pradaria), essas duas últimas sendo áreas de recife de arenito intertidal. Os indivíduos foram dissecados, retirados os intestinos e submetidos a digestão química utilizando um ácido (HNO3, 22,5 M) para realizar após, a análise microscópica para identificação dos fragmentos de plásticos. Estes dados foram analisados através do teste não-paramétrico de Kruskal-Wallis com nível de significância de 5% (0,05). A digestão química do conteúdo intestinal revelou microplásticos nos intestinos em todas as áreas de coletas, pertencentes as seguintes classes: fibras, péletes e filmes. Principalmente dos pepinos do mar que habitam regiões próximas a ocupação urbana, presença de turistas, ambulantes e pescadores.
Palavras-chave: Fragmentos de plásticos; ingestão; digestão química; Equinodermata; recife de arenito.
Abstract: With the growth of commercial fishing of the sea cucumber Holothuria (Halodeima) grisea, mainly for consumption in Asian countries, it has been essential to understand the trophic ecology of this animal. The aim of this study was to identify the presence of passively ingested microplastic from the local pollution in the intestinal contents of these animals collected at Praia de Barra Grande, Cajueiro da Praia, Piauí. At the study area, H. grisea is found in rocky shores, soft substrates and in seagrass (Halodule wrightii). Cucumbers were collected in three sites, named: named: seagrass, area 1 (closest to the seagrass meadow) and area 2 (further from the seagrass meadow), the latter two being areas of intertidal sandstone reef. The individuals were dissected, the intestines removed, and subjected to chemical digestion using an acid (HNO3, 22.5 M) to perform afterwards, the microscopic analysis for identification of the plastic fragments. These data were analyzed using the Kruskal-Wallis non-parametric test with a significance level of 5% (0.05). Chemical digestion of the gut contents revealed microplastics in the intestines in all collection sites, belonging to the following classes: fibers, pellets and films. Mainly from sea cucumbers that inhabit regions near urban occupation, presence of tourists, peddlers and fishermen.
Key words: Plastic fragments; ingestion; chemical digestion; Echinodermata; sandstone reef.
INTRODUÇÃO
Um dos problemas ambientais mais recorrentes nas últimas décadas nos mares é a poluição por plástico, item bastante corriqueiro em absolutamente tudo que utilizamos no dia a dia, desde nossas roupas até acidentalmente na alimentação, e no ar inalado (1) tanto dos seres humanos quanto dos animais marinhos em si. Pesquisas mais recentes já fizeram a detecção de microplásticos na placenta e sangue humano (2,3). De acordo com os dados da União Internacional para a Conservação da Natureza (IUCN), a produção de plástico oceânico é superior a 8 milhões de toneladas por ano (4), o que vem causando numeroso impacto ambiental e econômico.
Um dos mais relevantes riscos ambientais dos microplásticos é a sua biodisponibilidade para os organismos marinhos, pois devido a sua semelhança a alimentos, podem ser ingeridos e comprometer a funcionalidade dos sistemas digestivos (5). No entanto, microplásticos já foram encontrados no trato intestinal de diferentes animais, como em mamíferos marinhos: toninha Phocoena phocoena , golfinho de Risso Grampus griseus, baleia de bico de Cuvier Ziphius cavirostris e cachalote Physeter macrocephalus (6), em decápodes: Nephrops norvegicus (7), em tartarugas Caretta caretta (8), em invertebrados: Mytilus galloprovincialis (bivalve marinho), (9) em copépodes marinhos como Acartia tonsa (10)entre diversos outros animais, incluindo várias espécies costeiras utilizadas na alimentação humana (11).
Outro fator de risco é que, embora o consumo de microplásticos raramente mate os animais como observado por Galloway et al. (12), é possível dizer que muitos, principalmente invertebrados bentônicos, fazem a acumulação desses fragmentos em seus organismos e podem transferi-los na cadeia alimentar (13,14). Desta forma, ressaltamos que se trata de uma ameaça para toda cadeia trófica, pois além da toxicidade de contaminantes químicos, esses fragmentos podem transportar de outros poluentes.
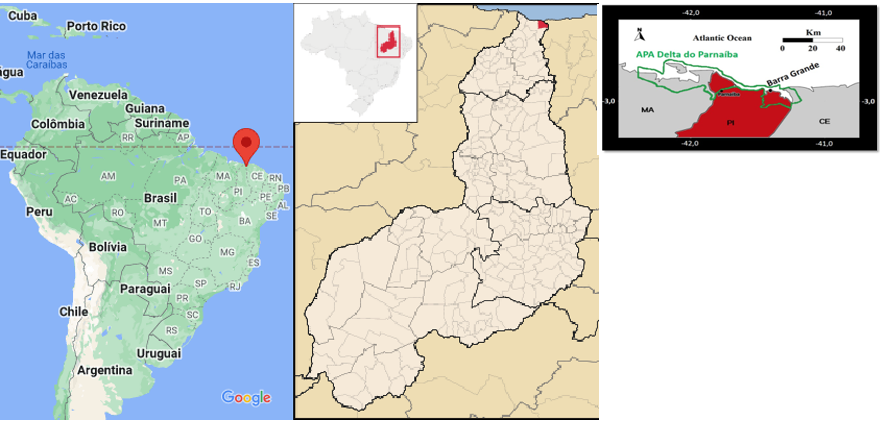
Os pepinos do mar da espécie Holothuria (Halodeima) grisea, são equinodermos detritívoros bentônicos, comedores de depósito e sem seletividade alimentar (15). Na costa brasileira é a espécie mais abundante de pepino do mar, sendo encontrada desde o sul do estado de Santa Catarina até a região Nordeste, e registrada principalmente na zona litoral entremarés (16,17). No Piauí, pode ser encontrada nas áreas de recife de arenito ao longo da costa, incluído a Praia de Barra Grande, no município de Cajueiro da Praia-PI, onde a espécie ocorre em recifes de arenito e em vegetação marinha no mesolitoral. (18)
Esses animais estão sujeitos a ingerir acidentalmente microplásticos presentes nos depósitos disponíveis para sua alimentação no ambiente natural, afinal, os sedimentos são considerados os maiores depósitos desses plásticos (19), e encontram-se atualmente contaminados em todos os oceanos, inclusive nas regiões polares (20). Este fato consiste evidentemente em uma ameaça, não apenas para o animal, mas também para o ser humano que pode sofrer contaminação por transferência trófica, já que diversas espécies de pepino do mar fazem ingestão acidental de microplásticos e são comercializadas para alimentação humana por apresentar significante valor nutricional (21, 22).
Devido a demanda de alto valor comercial nos mercados asiáticos para a gastronomia e farmacêutica, os pepinos do mar chegam custar centenas de dólares/kg. Este grupo vem recebendo crescente atenção de especialistas da aquicultura, e sido explorados através da captura de maneira intensiva e majoritariamente ilegal ou não regulada (23,24,25,26).
Os pepinos do mar vêm exercendo papel de bioindicadores no ambiente, devido a sua característica de não seletividade na alimentação, e aos consequentes riscos de ingestão de poluentes, como foi visto pela presença significativa dos fragmentos microplásticos nas espécies Holothuria floridana, Holothuria mexicana e Actinopyga agassizi analisadas por Plee T.A e Pomory (27), coletadas no ambiente natural Florida Keys, nos EUA.
Sua importância econômica é detectada através da pesca extrativista local em Barra Grande para exportação de países asiáticos gerando renda extra para os pescadores da região do litoral do Piauí, apresentando-se como um dos recursos econômicos mais importantes para a pesca costeira do Brasil (28, 29,30).
É relevante um estudo sobre a identificação de microplásticos presentes nos intestinos de H. grisea, pois servirá de base para o entendimento sobre a transferência trófica de microplástico no ambiente aquático, e na avaliação de processos interativos dos contaminantes em ambientes aquáticos. Além de ser uma utilidade pública para alertar focos de poluição em uma Área de Preservação Ambiental (APA), e precaução quanto quem fará o consumo desses animais.
MATERIAL E MÉTODOS
Área de estudo e coleta dos indivíduos
As amostras dos indivíduos de H. grisea (figura 1) foram coletadas na Praia de Barra Grande, no município de Cajueiro da Praia no litoral do Piauí (figura 2), localizada a uma latitude 02º55’40” sul e a uma longitude 41º20’10” oeste, estando a uma altitude de 10 metros. As coletas foram realizadas durante a maré de sizígia, período de máxima amplitude de maré em abril/2018, onde a espécie ocorre em recifes de arenito e em vegetação marinha no mesolitoral (pradaria).

O estudo foi feito em duas áreas de recife de arenito próximas a pradaria existente no local, e na própria pradaria, formada pela fanerógama marinha Halodule wrightii (figura 3a, 3b). A área de coleta para cada um dos pontos foi de 1 m².

Denominadas de área 1, que se encontra mais próxima a pradaria sendo coberta pela maré quando ela sobe, possui ainda uma maior densidade de indivíduos e com os menores comprimentos. A área 2 estando mais distante da pradaria, na qual nunca é coberta pela maré, ocorrendo indivíduos maiores e com menor densidade dos mesmos (31). (figura 4)

Análise dos microplásticos
Foram selecionados 5 intestinos de cada área em estudo de um lote de coleta (abril/2018), que após agrupadas as amostras o processo de digestão foi realizado baseado na metodologia de Claessens et al. (32) que resumindo se tratava no desenvolvimento da técnica de extração envolvendo a digestão química do tecido mole, utilizando um ácido (HNO3, 22,5 M) em temperatura ambiente, seguido por 2 h de ebulição (∼100° C). A mistura resultante foi então diluída com água deionizada filtrada morna (∼80° C) e filtrada a vácuo em um filtro de membrana de nitrato de celulose de 5μm imediatamente após a diluição.
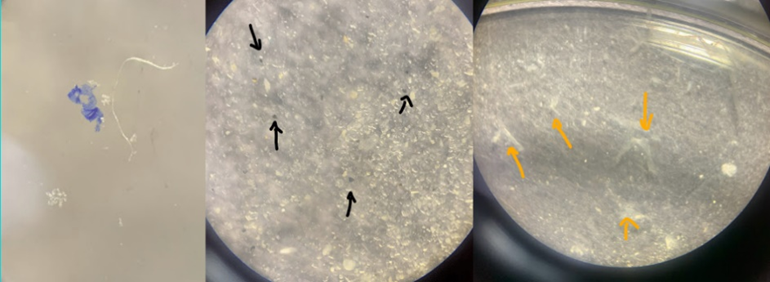
Neste estudo, os intestinos foram dissecados e colocados seus conteúdos em tubos de ensaio de 10 ml. Em seguida, foi adicionado 5 ml de ácido nítrico 65% P.A em cada tubo que ficou agindo por 24 horas. Após esse tempo, para garantir que todo o microplástico fosse retirado dos tubos, o material foi drenado com solução salina para as placas de petri. Porém, as adaptações no método consistiram no uso da solução salina com o objetivo de ajudar na visualização dos microplásticos que ficaram suspensos pela menor densidade. Posteriormente, levadas para a lupa com um papel fotográfico com coloração escura embaixo para classificação e contagem dos microplásticos. (figura 7 a,b,c,d,e, e f).

Tratamento de dados e análise estatística
Os microplásticos foram agrupados em uma tabela por conseguintes classes: fibras (transparentes, azuis e vermelhas), peletes e filmes, com seus respectivos cálculos da média e desvio padrão de acordo com as respectivas áreas de coleta.
Foi utilizado o teste de Kruskal-Wallis para verificar as possíveis diferenças estatísticas dos microplásticos entre as áreas de estudo. Para as análises estatísticas foi considerado o nível de significância de 5% (p < 0,05). Todas as análises foram realizadas com o auxílio do programa Software Statistica 8.0.
RESULTADOS E DISCUSSÃO
Na análise microplástica apenas com o uso do microscópio estereoscópico houve limitações, na qual só foi possível identificar a ocorrência de fibras na dieta (Figura 14). Pois as fibras apresentavam maior visibilidade em virtude de seu maior comprimento e colorações chamativas como: azul e vermelha. A dificuldade da visualização dos fragmentos de forma mais abrangente estava relacionada com a grande quantidade de itens não digeridos dos intestinos dos indivíduos.

Com isso, foi realizada a digestão do conteúdo intestinal com o uso de ácido nítrico (HNO³) para isolar as partículas de microplásticos e melhorar a visualização, para que então fosse possível contabilizar além de fibras, péletes e filmes. (Figura 15). A presença de microplásticos no trato intestinal pode ser possível detectar com mais quantidade nesses animais de hábito bentônico, do que os pelágicos devido sua prática de buscar alimentos no próprio sedimento, assim ingerindo acidentalmente os detritos de microplásticos que estão presentes no ambiente.
O trabalho mostrou que todos os habitats em estudo estão afetados por estes detritos, devido ao fato de o ambiente haver vínculo da proximidade de fontes antrópicas. Segundo a tabela 1 e figura 16, a quantidade de microplásticos da classe de péletes foram onipresentes e abundantes em todos os hábitats sem haver diferença significativa, com as seguintes médias: área 1= ( ) 18,5; área 2= ( ) 14,6 e pradaria ( ) 28,8. Os péletes que são esferas utilizadas para produção de plásticos menores (já vem bem degradado para o oceano) como microesferas esfoliantes em cosméticos e pellets (33), podendo ser proveniente de águas residuais das habitações existentes na praia de Barra Grande que podem ser descartadas no mar sem anteriormente o devido tratamento. A praia está situada em uma região que hospedam várias instalações de pousadas e chalés para os turistas, na qual concentra muitas pessoas e com isso, maior o uso de utensílios plásticos. Como também pode ser proveniente aglomerado com o principal item da dieta do H.grisea, a areia. Pois as maiores quantidades de pellets são encontradas nas areias das praias (34), que se mostrou presentes em todos os exemplares analisados independente da área de coleta, semelhante a areia.
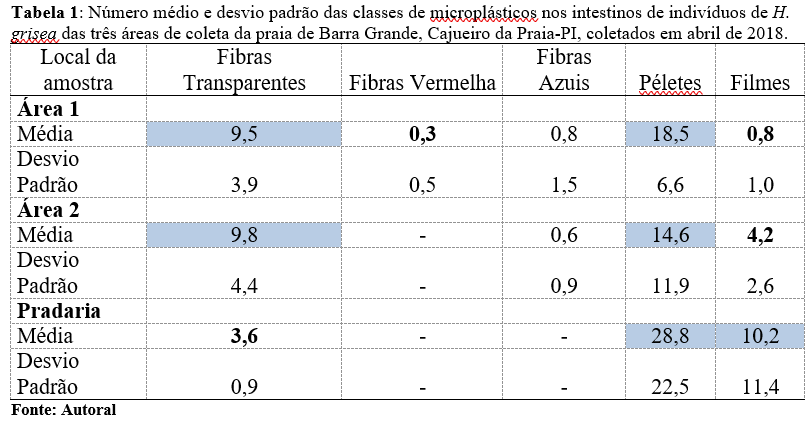
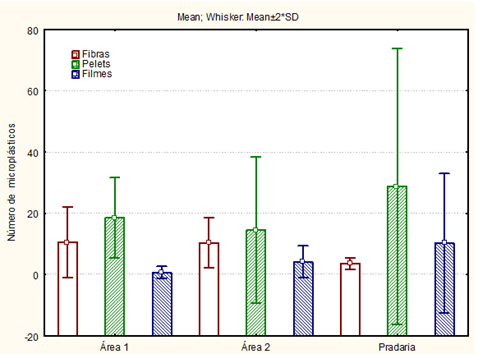
Os testes de Kruskal-Wallis indicaram que houve variação na abundância média de fibras e filmes em intestinos entre as áreas de coleta, mas não na abundância de pellets. O número médio de fibras na área 1 e 2 apresentando medianas maiores (H= 9,312245 p =,0095) foi significativamente maior, que estão relacionadas, por exemplo, aos materiais de pesca, fragmentos de sacolas, garrafas pets, que foram mais presentes nas áreas de recife (área 1 e área 2) que apresenta recorrente presença de turistas. Foi encontrado a presença de redes de pesca abandonadas e plástico de utensílios descartáveis em degradação pela radiação solar. Havendo ainda próximo a área de amostragem de coleta dos pepinos do mar um curral de pesca, podendo ser a fonte de origem das fibras.
Enquanto os filmes foram significantemente mais presentes na pradaria e área 2 (H =6,760000 p =,0340), em razão da degradação de embalagens proveniente dos turistas que frequentam o ambiente, como sacolas plásticas, que podem ficar retidas na vegetação da pradaria. Os filmes são de uso mais acentuado na agricultura, porém, quando fragmentados são facilmente escoados pela chuva e posteriormente escoados para o ambiente marinho (35)
CONCLUSÕES
O presente trabalhou mostrou que microplástico estão presentes no conteúdo intestinal de Holothuria (Halodeima) grisea coletados na Praia de Barra Grande, Cajueiro da Praia, Piauí. Principalmente dos pepinos do mar que habitam regiões próximas a ocupação urbana, presença de turistas, ambulantes e pescadores.
Fibras, péletes e filmes são as categorias de microplásticos presentes no conteúdo instestinal de H. grisea.
REFERÊNCIAS
- GASPERI, Johnny et al. Microplastics in air: are we breathing it in?. Current Opinion in Environmental Science & Health, v. 1, p. 1-5, 2018.
- RAGUSA, Antonio et al. Plasticenta: First evidence of microplastics in human placenta. Environment International, v. 146, p. 106274, 2021.
- Leslie, Heather A., et al. “Discovery and quantification of plastic particle pollution in human blood.” Environment international 163 (2022): 107199.
- IUCN, 2020. Disponível em: https://www.iucn.org/theme/marine-and-polar. Acesso em: 26/08/2022 às 21:32.
- GALL, Sarah C.; THOMPSON, Richard C. The impact of debris on marine life. Marine pollution bulletin, v. 92, n. 1-2, p. 170-179, 2015.
- ALEXIADOU, Paraskevi; FOSKOLOS, Ilias; FRANTZIS, Alexandros. Ingestion of macroplastics by odontocetes of the Greek Seas, Eastern Mediterranean: Often deadly!. Marine pollution bulletin, v. 146, p. 67-75, 2019.
- HARA, Jenevieve; FRIAS, João; NASH, Róisín. Quantification of microplastic ingestion by the decapod crustacean Nephrops norvegicus from Irish waters. Marine pollution bulletin, v. 152, p. 110905, 2020.
- DUNCAN, Emily M. et al. Microplastic ingestion ubiquitous in marine turtles. Global change biology, v. 25, n. 2, p. 744-752, 2019.
- TRESTRAIL, Charlene et al. Microplastics alter digestive enzyme activities in the marine bivalve, Mytilus galloprovincialis. Science of The Total Environment, v. 779, p. 146418, 2021.
- BAI, Zhuoan; WANG, Nan; WANG, Minghua. Effects of microplastics on marine copepods. Ecotoxicology and Environmental Safety, v. 217, p. 112243, 2021.
- HANTORO, Inneke et al. Microplastics in coastal areas and seafood: implications for food safety. Food Additives & Contaminants: Part A, v. 36, n. 5, p. 674-711, 2019.
- GALLOWAY, Tamara S.; COLE, Matthew; LEWIS, Ceri. Interactions of microplastic debris throughout the marine ecosystem. Nature ecology & evolution, v. 1, n. 5, p. 1-8, 2017.
- SFRISO, Andrea Augusto et al. Microplastic accumulation in benthic invertebrates in Terra Nova Bay (Ross Sea, Antarctica). Environment international, v. 137, p. 105587, 2020.
- FARRELL, Paul; NELSON, Kathryn. Trophic level transfer of microplastic: Mytilus edulis (L.) to Carcinus maenas (L.). Environmental pollution, v. 177, p. 1-3, 2013.
- SANTOS, Anna Rafaela Rodrigues dos et al. Dieta do pepino do mar Holothuria grisea Selenka 1867 na Praia de Barra Grande em Cajueiro da praia, Piauí. Aquaciência, Natal-RN, 2018.
- MENDES, Fabricio M. et al. Population patterns and seasonal observations on density and distribution of Holothuria grisea (Holothuroidea: Aspidochirotida) on the Santa Catarina Coast, Brazil. SPC Beche-de-mer Information Bulletin, v. 23, p. 5-10, 2006.
- PAWSON, David L.; PAWSON, Doris J.; KING, Rachael A. A taxonomic guide to the Echinodermata of the South Atlantic Bight, USA: 1. Sea cucumbers (Echinodermata: Holothuroidea). Zootaxa, v. 2449, n. 1, p. 1-48, 2010.
- AQUINO-SOUZA R., GOMES-FILHO J.G.F. Are seagrass meadows nursery areas for the sea cucumber Holothuria grisea? 17o Congresso Latino-Americano de Ciências do Mar, Camboriú-SC, 2017.
- VAN CAUWENBERGHE, Lisbeth et al. Microplastics in sediments: a review of techniques, occurrence and effects. Marine environmental research, v. 111, p. 5-17, 2015.
- OBBARD, Rachel W. Microplastics in polar regions: the role of long-range transport. Current Opinion in Environmental Science & Health, v. 1, p. 24-29, 2018.
- LI, Yuli et al. Sea cucumber genome provides insights into saponin biosynthesis and aestivation regulation. Cell discovery, v. 4, n. 1, p. 1-17, 2018.
- ROCHMAN, Chelsea M. et al. Rethinking microplastics as a diverse contaminant suite. Environmental toxicology and chemistry, v. 38, n. 4, p. 703-711, 2019.
- PURCELL, S.W et al. Sea cucumber fisheries: global analysis of stocks, management measures and drivers of overfishing. Fish and Fisheries, 14:34-59, 2013.
- PURCELL, Steven W.; WILLIAMSON, David H.; NGALUAFE, Poasi. Chinese market prices of beche-de-mer: Implications for fisheries and aquaculture. Marine Policy, v. 91, p. 58-65, 2018.
- PAWSON, D.L. Phylum Echinodermata. Zootaxa. 1668: 749-764. 2007.
- MOURA, R. D. et al. Holothuria grisea agglutinin (HGA): the first invertebrate lectin with antiinflammatory effects. Fundam.Clin.Pharmacol, 2012.
- PLEE, Tara A.; POMORY, Christopher M. Microplastics in sandy environments in the Florida Keys and the panhandle of Florida, and the ingestion by sea cucumbers (Echinodermata: Holothuroidea) and sand dollars (Echinodermata: Echinoidea). Marine Pollution Bulletin, v. 158, p. 111437, 2020.
- JUNIOR, José Souza et al. Sea cucumber fisheries in Northeast Brazil. SPC Beche-de-mer Information Bulletin, v. 37, p. 43-47, 2017.
- ANDERSON, Sean C. et al. Rapid global expansion of invertebrate fisheries: trends, drivers, and ecosystem effects. PLOS one, v. 6, n. 3, p. e14735, 2011.
- LEITE-CASTRO, Liliane Veras et al. Reproductive biology of the sea cucumber Holothuria grisea in Brazil: importance of social and environmental factors in breeding coordination. Marine Biology, v. 163, n. 3, p. 67, 2016.
- GOMES-FILHO, J. G. F.; AQUINO-SOUZA, R. Population structure of Holothuria grisea in a fishery area: baseline data for future comparisons and evidence of variations linked to seagrass presence. 17o Congresso Latino-Americano de Ciências do Mar, Camboriú-SC, 2017.
- CLAESSENS, Michiel et al. New techniques for the detection of microplastics in sediments and field collected organisms. Marine pollution bulletin, v. 70, n. 1-2, p. 227-233, 2013.
- BROWNE, Mark Anthony et al. Accumulation of microplastic on shorelines woldwide: sources and sinks. Environmental science & technology, v. 45, n. 21, p. 9175-9179, 2011.
- EPA. Plastics Pellets in the Aquatic Environment: Sources and recommendations. Environmental Protection Agency. 1992. Disponível em: http://www.globalgarbage.org/13%20EPA%20Plastic%20Pellets.pdf. Acessado em: 19 ago 2022.
- ANDERSON, A. et al. Sources, fate and effects of microplastics in the environment: a global assessment. 2015
Tag:CBPAV



