
ENRAIZAMENTO DE ESTACAS CAULINARES DE Mucuna Bennettii E Strongylodon Macrobotrys TRATADAS COM ÁCIDO INDOL BUTÍRICO
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-12
Este trabalho foi escrito por:
Leandro Miranda de Almeida*; João Sebastião de Paula Araujo; Tarcisio Rangel do Couto
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: A flor de jade vermelha (Mucuna bennettii) pertence ao gênero Mucuna, que reúne uma centena de espécies entre arbustos e trepadeiras. Já a flor de jade azul (Strongylodon macrobotrys) é uma planta trepadeira muito admirada e procurada. Ambas as espécies possuem grande interesse para fins ornamentais. Diante da dificuldade na propagação das plantas, este trabalho objetivou avaliar o efeito da aplicação de ácido indol butírico (AIB) no enraizamento de estacas caulinares. Foram utilizadas estacas herbáceas, semilenhosas e lenhosas coletadas de ramos de plantas adultas e bem desenvolvidas de flor de jade azul e jade vermelha, submetidas à imersão em soluções de AIB (0; 2.000 e 4.000 mg.L-1), durante 15 segundos. A base dessas estacas foi plantada em um canteiro que continha areia como substrato e mantidas em câmara com nebulização intermitente. Foram avaliadas a porcentagem de sobrevivência, porcentagem de enraizamento, estacas com calo, estacas com brotação, número de raízes e comprimento da maior raiz. Pode-se concluir que é possível rizogênese a partir de estacas caulinares com folhas de M. bennettii e S. macrobotrys. Observou-se percentuais de 20 e 4% de enraizamento para M. bennettii e S. macrobotrys, respectivamente. Os resultados corroboram com dados da literatura que tais espécies apresentam baixo percentual de enraizamento através de segmentos destacados de caule. Ensaios adicionais com essas duas espécies devem ser realizados, considerando ajustes nos tipos de estacas e número de folhas, redução nas concentrações de ácido indol butírico e ambiência do propagador.
Palavras–chave: estaquia; floricultura; propagação
Abstract: The red jade flower (Mucuna bennettii) belongs to genus Mucuna, which includes a hundred species among shrubs and vines. The blue jade flower (Strongylodon macrobotrys) is a much admired and sought after climbing plant. Both species are great interest for ornamental purposes. Given the difficulty in plant propagation, this study aimed to evaluate the effect of application indolebutyric acid (IBA) on rooting of stem cuttings. Herbaceous, semi-hardwood and woody cuttings were collected from branches of mature and well-developed blue and red jade flowers plants, submitted to immersion in IBA solutions (0; 2,000 and 4,000 mg.L-1) for 15 seconds. The base of these cuttings was planted in a bed that contained sand as substrate and kept in a chamber with intermittent mist. The percentage of survival, percentage of rooting, cuttings with callus, cuttings with sprouting, number of roots and length of the largest root were evaluated. Concluded that rhizogenesis is possible from stem cuttings with leaves of M. bennettii and S. macrobotrys. Rooting percentages of 20% and 4% were observed for M. bennettii and S. macrobotrys, respectively. Results corroborate with data from the literature that such species present a low percentage of rooting through detached stem segments. Additional tests with these species should be carried out, considering adjustments in the types of cuttings and number of leaves, reduction in IBA concentrations and propagator environment.
Key Word: cuttings; flower shop; propagation
INTRODUÇÃO
As espécies flor de jade vermelha (Mucuna bennettii) e flor de jade azul (Strongylodon macrobotry) pertencem à família Fabaceae, e são plantas ornamentais, perenes, trepadeiras, com flores vistosas. Apesar de poucos estudos acerca da utilização destas espécies em projetos paisagísticos, em virtude exuberância de suas flores estas são muito apreciadas (1).
De acordo com Gibbs (2), as espécies apresentam autoincompatibilidade reprodutiva do tipo LSI (Late-acting selfincompatibility), ou ação tardia de autoincompatibilidade. Além disso, o estigma possui uma estrutura semelhante a um pincel para evitar a autopolinização espontânea, sendo esta possivelmente feita por pássaros e morcegos, que originam frutos de pequeno tempo de viabilidade, situada em torno de semanas.
Diante do exposto, uma das alternativas para multiplicar estas espécies seria a propagação vegetativa por estaquia. Agustí (3) salienta que a estaquia é um processo de propagação vegetativa no qual ocorre a indução ao enraizamento adventício em segmentos destacados da planta matriz, que, submetidos a condições favoráveis originam uma muda. Sendo os métodos de propagação mais utilizados para produção de mudas dessas espécies a enxertia e alporquia, destacando-se este último método, vez que, no Brasil, a flor de jade não produz sementes em virtude da falta de polinizadores.
Entretanto, de acordo com Hartmann et al. (4), apesar da estaquia ser um método mais facilmente conduzido e capaz de produzir maior número de mudas, a alporquia possui como principal vantagem a produção de mudas de maior porte, já adaptadas a condições ambientais externas.
Assim, como o enraizamento de estacas é dependente de muitos fatores, tanto internos quanto externos, como a formação de raízes iniciais a partir das células do câmbio próximas dos feixes vasculares ou dos tecidos vasculares, que se tornam meristemáticas por diferenciação, a técnica de alporquia para ambas as espécies estudadas é a mais indicada. Dentre estes, citam-se a condição nutricional e fitossanitária da planta matriz, o potencial genético, o balanço hormonal, a época de realização, a temperatura e umidade. Sendo importante também o teor de reservas e nutrientes, e que a estaca varia com a espécie e cultivar (4).
Nesse contexto, Dexana et al. (5) complementam que o sucesso na propagação por estaquia também depende da distribuição de hormônios, da condição fisiológica e nutricional da planta matriz, do hábito de crescimento da planta (herbáceo ou lenhoso) e das condições ambientais (substratos, luminosidade, temperatura e umidade relativa do ar).
Entretanto, têm sido observados que a condição fisiológica e a posição no ramo de onde se obtém as estacas são fatores preponderantes ao enraizamento. Pois, ao longo do ramo ocorrem variações nos conteúdos de reservas e substâncias promotoras e inibidoras do crescimento (6; 7).
Com objetivo de acelerar e promover o enraizamento de estacas, bem como maior porcentagem de formação de raízes, melhor uniformidade de enraizamento, qualidade do enraizamento a aplicação de reguladores de crescimento tem sido comum na produção de plantas ornamentais. Assim, Hinojosa (8) afirma que pelo fato da auxina ser um fitorregulador endógeno, quando esta é aplicada de forma exógena, pode haver um estímulo ao enraizamento, sendo o ácido indol acético (AIA) e o ácido indol butírico (AIB) os mais empregados.
Diante do exposto e considerando a escassez de estudos e resultados sobre a propagação vegetativa de flor de jade azul e de flor de jade vermelha objetivou-se avaliar o efeito da aplicação de ácido indol butírico (AIB) sobre a rizogênese de estacas herbáceas, semilenhosas e lenhosas dessas duas espécies.
MATERIAL E MÉTODOS
As estacas de flor de jade vermelha (Mucuna bennettii) foram coletadas de uma planta matriz adulta no Sitio Raíz, propriedade localizada em Barra de Guaratiba, RJ. Por sua vez, as estacas de flor de jade azul (Strongylodon macrobotrys) foram coletadas de uma planta matriz no campus da UFRRJ (figura 1).

O delineamento experimental foi em blocos casualizados com três repetições, em esquema fatorial 3 x 3. Os tratamentos consistiram na combinação de três concentrações do fitorregulador ácido indol butírico – AIB (0; 2.000 e 4.000 mg.L-1), conforme recomendações de Muniz et al. (1), com três tipos de estacas (herbácea, semilenhosa e lenhosa), totalizando 9 tratamentos. As parcelas experimentais foram constituídas de 10 estacas por tratamento, que resultou em 90 estacas por bloco, totalizando 270 estacas para a realização do experimento.
As estacas das duas espécies foram preparadas, deixando-se algumas folhas cortadas a 1,0 cm da sua base (Figura 2), evitando assim o excesso de transpiração e a dificuldade da água atingir o substrato.

As estacas das duas espécies foram desinfestadas sob imersão em hipoclorito de sódio 1% por um minuto, seguida de lavagem tripla em água. Para avaliação do efeito do AIB no enraizamento, os tratamentos utilizados foram 0, 2.000 e 4.000 mg.L-1.
Para o preparo do fitorregulador via solução diluída, foi utilizada uma balança analítica de alta precisão para pesagem do AIB. Em seguida, foi utilizado um becker para obtenção de 1L de álcool 98%. O AIB 2.000 mg.L-1 e 4.000 mg.L-1 foram diluídos separadamente em 500 mLde álcool 98% + 250 mL de água destilada, soluções estas que foram misturadas até a completa homogeneização.
As estacas, após o estaqueamento, foram levadas à casa de vegetação (CV) coberta com polietileno transparente e sombrite 50% de redução da luminosidade no teto, temperatura variando de 25°C a 35°C e umidade relativa do ar 90% (Figura 3A).

As estacas das duas espécies foram plantadas em canteiros contendo substrato de textura arenosa (Figura 3B), não esterilizado e mantidas sob irrigação por nebulização automática programada com intermitência de 1 minuto de aspersão e intervalos de 30 minutos, vazão do aspersor varia 25-140 l/h visando manter a temperatura e umidade relativa do ar ideal para os material propagado.
Após 45 dias, foram avaliadas as variáveis porcentagem de estacas vivas, porcentagem de estacas enraizadas, porcentagem de estacas com calo, porcentagem de estacas com brotação, porcentagem de número de raízes por estaca e o comprimento da maior raiz (cm).
Nos dados obtidos da estaquia, foram realizadas as análises de variância com a aplicação do teste F, ao nível de 5 % de probabilidade, com o auxílio do programa estatístico SISVAR (9).
RESULTADOS E DISCUSSÃO
Ao se verificar a análise de variância, em função das concentrações do AIB e dos tipos de estacas utilizadas, não foram observados efeitos significativos (p = 0,05) nas variáveis analisadas de Mucuna bennettii e Strongylodon macrobotrys (Tabela 1).
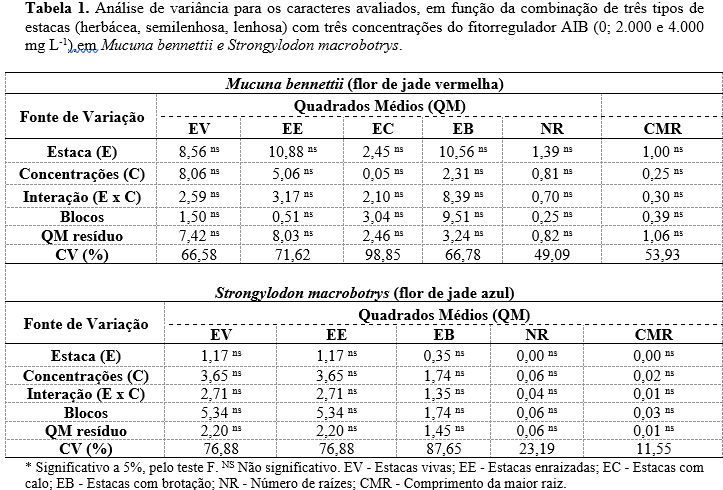
Com base nos dados acima apresentados, pode se observar que a concentração de AIB não proporcionou um aumento do enraizamento das estacas de flor de jade azul (Figura 4).

Deste modo, verifica-se que a época de coleta dos propágulos pode ter influenciado no enraizamento das estacas, tendo em vista que no momento da coleta as matrizes se encontravam em período de floração, que de acordo com Oliveira et al. (10), em virtude dos desvios metabólitos para a floração/frutificação, há uma redução nas concentrações necessárias ao enraizamento.
Nessa conjuntura, Zuffellato-Ribas & Rodrigues (11) afirmam que outro fator a ser considerado é a melhor época de coleta do material vegetativo, a qual varia de acordo com o perfil de cada espécie. Fatores ambientais pelos quais a planta matriz é submetida influenciam diretamente a capacidade de enraizamento da mesma, devido a maior ou menor síntese de hormônios como as auxinas. Entretanto, alguns estudos enfatizam o efeito positivo da permanência de folhas nas estacas das duas espécies sobre o percentual de enraizamento e sobrevivência das mesmas, como exibido na Figura 5.

Com base no fator tipo de estacas, notou-se que não houve diferenças significativas (p = 0,05), para as variáveis analisadas (Tabela 1). Neste contexto, Bastos et al. (12), ainda que trabalhando com diferentes tipos de estacas de lichieira, obtiveram maior porcentagem de enraizamento em estacas semilenhosas quando comparada com as lenhosas.
Como visto, a Mucuna bennettii e Strongylodon macrobotry não tiveram diferença significativa no tratamento em que se aplicou o AIB. Porém, Muniz et al. (1) avaliaram o efeito da aplicação de ácido indol butírico (AIB) no enraizamento de estacas de flor de jade azul e recomendaram a utilização de estacas herbáceas com folhas, tratadas com a concentração de 2.000 mg.L-1 de AIB para a produção de mudas.
Das 270 estacas coletadas, que corresponderam a 135 de cada uma das espécies, apenas 56 estacas da flor de jade vermelha e 11 estacas da flor jade azul enraizaram, tendo como porcentagem de enraizamento de 20% e 4,0%, respectivamente. De acordo com Nicoloso et al. (13), a perda de umidade mais acentuada nas estacas herbáceas pode explicar esse baixo enraizamento. Além disso, os autores supracitados afirmam que tais estacas também possuem limitada reserva de nutrientes orgânicos e inorgânicos em seus tecidos, sendo esta uma causa do baixo índice de sobrevivência. O teor de carboidratos contido na estaca é outro fator que influencia na capacidade de enraizamento.
Ao final do experimento, foi avaliada a qualidade das mudas formadas e, independentemente da dose de AIB utilizada e do tipo de estaca. Em Strongylodon macrobotry a sobrevivência não foi alterada em relação à encontrada na fase de enraizamento.
Gratieri-Sossella et al. (14) também não verificaram diferenças significativas na porcentagem de enraizamento de miniestacas herbáceas de corticeira-do-banhado (Erythrina crista-galli L.), também da família Fabaceae e de uso ornamental, nas concentrações de 0, 1.000, 2.000, 3.000 e 4.000 mg.L-1, cujos valores variaram de 75 a 100%.
Santos et al. (15) avaliando a influência de diferentes concentrações de AIB, épocas de coleta e tipos de estacas no enraizamento de mulungu (Erythrina velutina Willd) da família Fabaceae, só verificaram resultados eficientes para a variável número de raízes em estacas semilenhosas tratadas com concentrações crescentes de AIB, de 0 a 6000 mg.L-1. Além disso, estes autores não observaram nenhuma formação de raízes em estacas herbáceas, sendo este último resultado diferente do observado para estacas herbáceas de flor de jade, as quais formaram raízes.
Ferriani et al. (16), avaliando a propagação vegetativa de estaquia de azaleia arbórea (Rhododendron thomsonii H.) da família Ericaceae, com estacas semilenhosas (coletadas na primavera) e com diferentes concentrações de AIB (0; 2.000 e 4.000 mg.L-1), não observaram enraizamento para este tipo de estaca.
Desta maneira, a aplicação de auxina exógena em estacas pode favorecer o enraizamento, porém altas concentrações podem inibir a formação das mesmas, sendo o teor adequado deste fitorregulador dependente da espécie e da concentração endógena de AIB nos tecidos (17).
Nesse contexto, Hartmann et al. (4) mencionam que a aplicação de auxina pode apresentar resultados que divergem entre si, pois a resposta à aplicação de auxina difere conforme o genótipo, a espécie e o tipo de estaca utilizada. Como observado no presente estudo, que a aplicação do fitorregulador não apresentou diferenças significativas entre os tratamentos.
Enquanto, Ramos et al. (18) afirmam que o fornecimento exógeno de auxina, em certas quantidades, pode promover uma alteração hormonal, favorecendo ou não o enraizamento de estacas. Nesse sentido, Tofanelli et al. (19) salientam que a resposta à aplicação de auxinas depende da facilidade de enraizamento da espécie.
Por fim, pode-se observar que não foi possível inferir neste estudo efeito estatisticamente significativo da aplicação de AIB sobre a potencialização do enraizamento das estacas de ambas as espécies. Haja vista que, como as mudas de ambas as espécies são de difícil enraizamento, e uma alternativa para obter uma maior percentagem de estacas enraizadas seria alterar o tempo de nebulização, já que o atual sistema funciona com 24 programações, assim, de 30 em 30 minutos ele é acionado por 1 minuto, o mesmo passaria a ser acionado de 15 em 15 minutos com o mesmo tempo de funcionamento. Dessa forma, menos estacas sofreriam com a desidratação e abscisão foliar.
Além disso, espera-se que novos estudos acerca estaquia caulinar como alternativa para a propagação de Mucuna bennettii e Strongylodon macrobotrys tratadas com ácido indol butírico sejam realizados.
CONCLUSÕES
É possível rizogênese a partir de estacas caulinares de Mucuna bennettii e Strongylodon macrobotrys.
As espécies apresentam baixo percentual de enraizamento através de segmentos destacados de caule (método de estaquia).
A rizogênese de flor de jade vermelha, a partir de caules com folhas, pode ser uma alternativa promissora, por ser mais rápida e econômica quando comparado ao método de alporquia, usualmente utilizado na produção de mudas.
Ensaios adicionais com essas duas espécies devem ser realizados, considerando ajustes nos tipos de estacas e número de folhas, redução nas concentrações de ácido indol butírico e ambiência do propagador.
AGRADECIMENTOS
À UFRRJ. Ao curso de graduação em Agronomia e ao Curso de Pós-Graduação em Fitotecnia da UFRRJ. Ao Instituto de Agronomia – Departamento de Fitotecnia.
REFERÊNCIAS
- Muniz FR, Rodrigues PHV, Silva SR. Enraizamento de estacas de flor de jade (Strongylodon macrobotrys A. Gray) tratadas com ácido indolbutírico. Ornamental Horticulture. 2015;21(3),363–367.
- Gibbs PE. Late acting self-incompatibility – the pariah breeding system in flowering plants. New Phytologist. 2014;203(3),717–734.
- Agustí M. Fruticultura. Ediciones Mundi-Prensa; 2004.
- Hartmann HT, Kester DE, Davies Junior FT, Geneve RL. Plant propagation: principles and practices. 8 ed. Prentice Hall; 2011.
- Denaxa NK, Vemmos SN, Roussos PA. The role of endogenous carbohydrates and seasonal variation in rooting ability of cuttings of an easy and a hard to root olive cultivars (Olea europaea L.). Scientia Horticulturae. 2012;143(16),19–28.
- Guo XF, Fu XL, Zang DK, Ma Y. Effect of auxin treatments, cuttings’ collection date and initial characteristic son Paeonia ‘Yang Fei Chu Yu’ cutting propagation. Scientia Horticulturae. 2009;119,177–181.
- Zerche S, Druege U. Nitrogen contente determines adventitious rooting in Euphorbia pulcherrima under adequate light independently of pre-rooting carbohydrate depletion of cuttings. Scientia Horticulturae. 2009;121,340–347.
- Hinojosa GF. Auxinas. In: Cid LPB. (ed). Introdução aos hormônios vegetais. EMBRAPA; 2000.
- Ferreira DF. Sisvar: a computer statistical analysis system. Ciência e Agrotecnologia. 2011;35(6),1039–1042.
- Oliveira MC, Ribeiro JF, Rios MNS, Rezende ME. Enraizamento de estacas para produção de mudas de espécies nativas de matas de galerias. EMBRAPA Cerrados; 2001.
- Zuffellato-Ribas KC, Rodrigues JD. Estaquia: uma abordagem dos principais aspectos fisiológicos. Curitiba; 2001.
- Bastos DC, Pio R, Scarpare Filho JA, Libardi MN, Almeida FP, Galuchi TPD, Bakker ST. Propagação da Pitaya “vermelha” por estaquia. Ciência e Agrotecnologia. 2006;30(6),1106–1109.
- Nicoloso FT, Fortunato RP, Fogaça MAF. Influencia da posição da estaca no ramo sobre o enraizamento de Pfaffia glomerata (Spreng.) Pedersen em dois substratos. Ciência Rural. 1999;29(2),277–283.
- Gratieri-Sossella A, Petry C, Nienow AA. Propagação da corticeira do banhado (Erythrina cristagalli L.) (Fabaceae) pelo processo de estaquia. Revista Árvore. 2008;32(1),163–171.
- Santos LW, Coelho MFB, Dombroski JLD, Azevedo RAB. Propagação vegetativa de mulungu (Erythrina velutina Willd. – Fabaceae). Revista Brasileira de Ciências Agrárias. 2014;9(3),420–426.
- Ferriani AP, Bortolini MF, Zuffellato-Ribas KC, Koehler HS. Propagação vegetativa de estaquia de azaleia arbórea (Rhododendron Thomsonii HOOK. f.). Semina: Ciências Agrárias. 2006;27(1),35–42.
- Fachinello JC, Hofffmann A, Nachtigal JC. Propagação de plantas frutíferas. Embrapa Informação Tecnológica; 2005.
- Ramos JD, Matos LES, Gontijo TCA, Pio R, Junqueira KP, Santos FC. Enraizamento de estacas herbáceas de ‘Mirabolano’ (Prunus cerasifera Ehrn) em diferentes substratos e concentrações de ácido indolbutírico. Revista Brasileira de Fruticultura. 2003;25(1),189–191.
- Tofanelli MBD, Chalfun NNJ, Hoffmann A, Chalfun JRA. Efeito do ácido indolbutírico no enraizamento de estacas de ramos semilenhosos de pessegueiro. Pesquisa Agropecuária Brasileira. 2002;37(7),939–944.
Tag:CBPAV

