
EFEITOS DA NUTRIÇÃO SOBRE A FUNÇÃO TIREOIDIANA E DESEMPENHO DE ANIMAIS DE PRODUÇÃO: REVISÃO DE LITERATURA
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-30
Este trabalho foi escrito por:
Antônio Daniel Lima do Nascimento*; Juliano Martins Santiago; Rossana Herculano Clementino
1Graduando em zootecnia, Universidade Federal Rural de Pernambuco, Unidade Acadêmica de Serra Talhada-PE, UFRPE/UAST- Email: [email protected]
2Médico veterinário e Docente do Curso de zootecnia, Universidade Federal Rural de Pernambuco, Unidade Acadêmica de Serra Talhada-PE, UFRPE/UAST
3Zootecnista e Docente do curso de zootecnia, Universidade Federal Rural de Pernambuco, Unidade Acadêmica de Serra Talhada-PE, UFRPE/UAST
Resumo: A nutrição é um fator relevante para a otimização do desempenho e promoção do bem-estar animal nos sistemas de criação intensivo e semi-intensivo, através da formulação e fornecimento de dietas capazes de suprir as necessidades nutricionais. Os efeitos do fornecimento de dietas desbalanceadas ou que contenham substâncias bociogênicas são refletidos através da ocorrência de disfunções metabólicas como exemplo das endocrinopatias da glândula tireoide (hipotireoidismo, hipertireoidismo e bócio). Tais patologias são responsáveis por retardar o desempenho animal quanto a conversão alimentar, sem falar que estão diretamente ligadas a maior ocorrência de problemas reprodutivos como retenção de placenta, abortos e natimortalidade. Tendo em vista a importância da nutrição sobre a produtividade e equilíbrio metabólico, objetivou-se reunir informações sobre alimentos bociogênicos, destacar a sua influência sobre a função tireoidiana e os reflexos na produção animal. Concluiu-se que as disfunções tireoidianas são comuns a todas as espécies animais e provocadas por diversos fatores como excesso ou carência de iodo dietético, presença de substâncias bociogênicas nos alimentos, privação energética, carência de zinco, selênio e excesso de cálcio.
Palavras-chave: Bócio; Metabolismo; Substâncias bociogênicas; Tetraiodotironina; Triiodotironina
Abstract: Nutrition is a relevant factor for performance optimization and promotion of animal welfare in intesive and semi-intensive farming systems, through the formulation and supply of diets capable of meeting nutritional needs. The effects of providing unbalanced diets or those containing goitrogenic substances are reflected through the occurrence of metabolic dysfunctions, for example endocrinopathies of the thyroid gland (hypothyroidism, hyperthyroidism and goiter). Such pathologies are responsible for delaying animal performance in terms of feed conversion and milk and egg production, which are directly linked to a greater occurrence of reproductive problems such as retained placenta, abortions and stillbirths. In view of the importance of nutrition on productivity and metabolic balance, the objective was to gather information about goitrogenic food, to highlight its influence on thyroid function and the reflections on animal production. It was concluded that thyroid dysfunctions are common to all animal species and they are caused by several factors such as excess or lack of dietary iodine, presence of goitrogenic substances in food, energy deprivation, lack of zinc, selenium and excess calcium.
Key-words: Goiter; Metabolism; Goitrogenic substances; Tetraiodothyronine; Triiodothyronine
INTRODUÇÃO
A nutrição apresenta grande influência sobre a reprodução, desempenho zootécnico e saúde dos animais (1), pois uma vida saudável está intimamente relacionada com a qualidade da alimentação (2). Muitos estudos vêm sendo desenvolvidos acerca do valor nutricional dos alimentos destinados ao consumo animal, uma vez que muitos desses são conhecidos pelo seu alto valor nutricional, entretanto quando analisados bromatologicamente podem apresentar baixa biodisponibilidade (3,4).
A presença de fatores antinutricionais, antinutrientes e anticrescimento reduz a disponibilidade dos nutrientes presentes nos alimentos e dessa forma podem ser causadores de efeitos deletérios a fisiologia animal (5). A maioria dos fatores antinutricionais estão presentes nos vegetais de forma natural, com a finalidade de proteção contra o ataque de fungos, bactérias e insetos (6). Nesse sentido, avaliar os alimentos a partir da bromatolgia é fundamental para que seja possível o seu uso na formulação de dietas balanceadas e seguras para os animais de produção.
Dieta balanceada é aquela capaz de prover, para um animal, os diversos nutrientes, numa proporção compatível com determinado nível de produção diária (7). Dentre os micronutrientes, destaca-se o iodo que apesar de se encontrar em outros tecidos como ovários, rins, placenta, glândula mamária e tecidos do trato digestório, 80% está concentrado na glândula tireoide tendo como única função fisiológica ser componente dos hormônios tireoidianos (8), sendo fundamental para a normal produção de tirosina (T4) e triiodotironina (T3) (9).
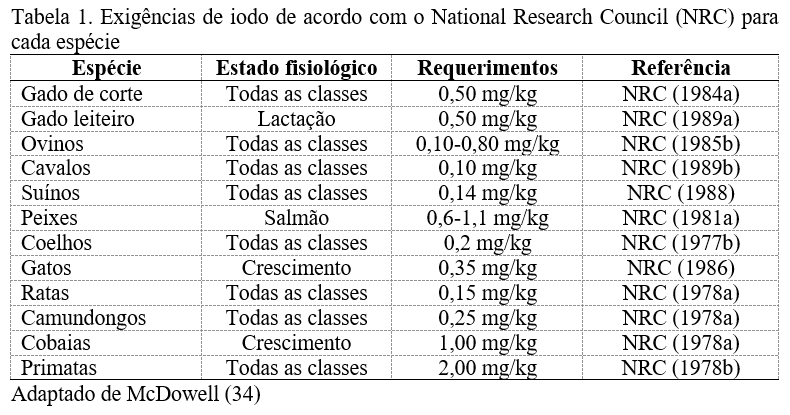
A necessidade de iodo varia de acordo com a espécie, estado fisiológico, clima, assim como o ambiente, e sua carência é apontada como uma das principais causas da ocorrência de bócio, não só em animais, como também em humanos (9,10).
O bócio consiste no aumento do volume da glândula tireoide sem envolvimento de processo inflamatório ou neoplásico em virtude da redução basal dos hormônios (T3) e (T4) pela ausência de iodo disponível para utilização, gerando-se uma hiperestimulação tireoidiana através da ação do hormônio tiroestimulante (TSH) (11,12,13). Segundo Martins et al. (14), vários fatores podem estar relacionados a baixa concentração de iodo na circulação sanguínea como a deficiência do mineral na alimentação, ingestão de substâncias bociogênicas presentes em espécies vegetais ou silagens a base de soja, deficiência de selênio ou elevado nível de cálcio.
De fundamental importância para a espécie animal e humana, a deficiência do mineral iodo leva a uma anomalia clínica, que na maioria das vezes provoca alterações no metabolismo da água, proteínas, carboidratos, lipídeos e de outros minerais, com consequências que refletem sobre a reprodução, produção de leite, ovos, lã, ganho de peso e desempenho dos animais (10). Em vacas gestantes, a baixa concentração de iodo provoca o nascimento de crias com bócio congênito, o qual se caracteriza pelo aumento do volume da glândula tireoide (15,16,17,18). Essa anomalia congênita provoca crescimento deficiente, anorexia, mixedema e intolerância ao frio (19,20).
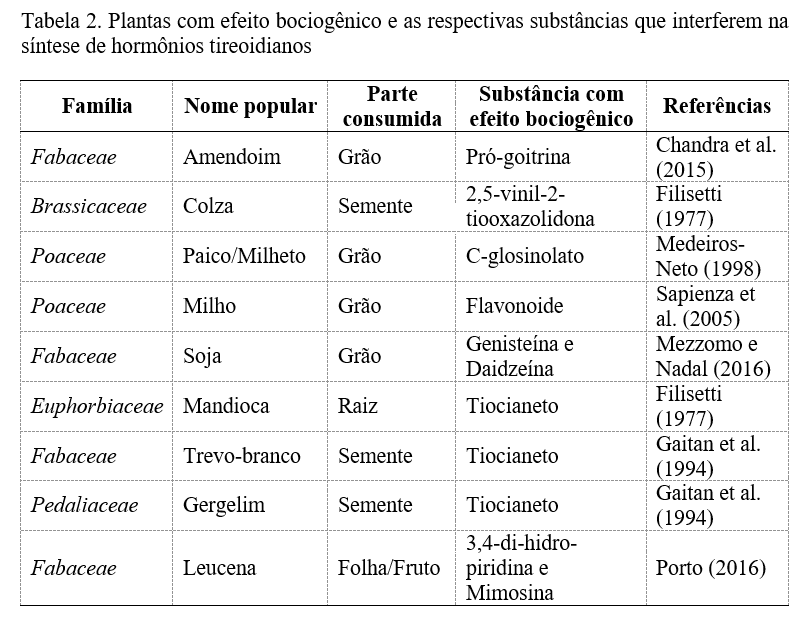
O consumo de alimentos com baixo teor de iodo é o fator apontado como principal responsável pela maior frequência da ocorrência de bócio no Brasil (21,22,18). A concentração de iodo nos alimentos de origem vegetal terrestre é baixa (23) e, além disso, existem plantas com alto conteúdo de precursores bociogênicos, como as da família Brassicaceae, Poaceae, Leguminosae, Euphorbiaceae, Leucaena leucocephala. De acordo com Gonzalez (23), substâncias bociogênicas são aquelas que alteram a síntese, a liberação ou ação dos hormônios tireoidianos, causando uma disfunção no funcionamento da tireoide.
Devido ao sistema de criação intensivo que visa a exploração máxima do potencial produtivo, através do fornecimento de dietas padronizadas, menos diversificadas e que tem o milho, a soja e outros alimentos bociogênicos como constituintes básicos da dieta, os animais de produção tornam-se bastante vulneráveis as disfunções metabólicas. De acordo com Mezzomo e Nadal (24) as isoflavonas presentes na soja são capazes de inibir a tireoperoxidase (TPO), enzima importante para a oxidação do iodeto e síntese dos hormônios tireoidianos.
Tendo em vista a importância da nutrição sobre a produtividade, entendimento das disfunções metabólicas relacionadas a alimentação, identificação de substâncias presentes nos alimentos que alteram o funcionamento da glândula tireoide, saúde e consequentemente o bem-estar animal, objetivou-se com essa revisão reunir informações sobre alimentos bociogênicos, destacar a sua influência sobre a função tireoidiana e os reflexos na produção animal.
IMPORTÂNCIA DO IODO PARA A SÍNTESE DE TRIIODOTIRONINA (T3) E TIROSINA (T4)
O iodo é um oligoelemento essencial para os animais e o único elemento mineral cuja carência ocasiona uma anomalia clínica específica e de fácil reconhecimento: o bócio ou hiperplasia da glândula tireoide (2). A ingestão desse micromineral é indispensável para a produção de tirosina (T4) e de triiodotironina (T3), os quais são hormônios tireoidianos (2) sintetizados pela junção de duas moléculas de tirosina (25) que por sua vez é composta por quatro moléculas de iodo.
A liberação dos hormônios tireoidianos na circulação é regulada pelo eixo hipotálamo-hipófise-tireoide (25), entretanto para síntese desses é essencial a presença de duas moléculas: a tirosina, que faz parte da tireoglobulina, e o iodo (I2), que é convertido em iodeto (I_) no trato gastrointestinal (12). O iodeto circula no plasma ligado à proteínas plasmáticas, sendo rapidamente distribuído, e em seguida é transportado para a glândula tireoide (2) através de um transportador específico (co- transportador sódio-iodeto (Na+/I simport-(NIS), dependente de ATP (26,27). A proteína NIS (sodium iodide symporter) possibilita a entrada do iodeto nas células foliculares.
De modo geral, o iodeto captado pela bomba de iodeto através do estímulo gerado pelo TSH (Hormônio Tireoestimulante) é oxidado a tirosina. Essa molécula, posteriormente será convertida em tireoglobulina pela ação da enzima peroxidase, sendo armazenada no coloide folicular (28). Para que os hormônios tireoidianos sejam liberados pela glândula especializada, a tireoglobulina deve ser translocada para a célula folicular (2) onde sofrerá hidrólise pelas enzimas lisossomais, ocorrendo desse modo a liberação de T3 e T4 no sangue (28).
A disponibilidade de iodo no organismo promove a regulação neuroendócrina e exerce função de controlar os efeitos fisiológicos dos hormônios tireoidianos (2). Além disso, a hormoniogênese e o crescimento da glândula tireoide por processo de auto-regulação são controlados conforme a disponibilidade de iodo na célula e, desse modo, em um estado de deficiência desse no organismo, o seu transporte é aumentado uma vez que o mecanismo auto-regulatório é ativado para manter um equilíbrio fino no estoque de hormônios tireoidianos na glândula sem que haja, entretanto, mudança detectável nos níveis de TSH (29).
A carência ou excesso da concentração de iodo no organismo induz a ativação de uma série de mecanismos reguladores para a promoção do equilíbrio metabólico. Em seus estudos, Kimura (29) relata que o excesso de iodo bloqueia a enzima Duox (dual oxidase) que é importante para a geração de H2O2 (peróxido de hidrogênio),o qual é indispensável para a organificação desse oligomineral, possibilitando a sua conversão em uma forma utilizável. O efeito inibitório do iodo que ocorre na glândula tireoide é caracterizado pela diminuição da atividade do transportador de iodo, redução da organificação do iodo (efeito Wolf-Chaikoff), inibição da secreção de T4 e T3 armazenados no coloide folicular e, consequentemente, ocorre a diminuição dos hormônios tireoidianos liberados pela glândula na circulação.
Para reforçar a importância do iodo sobre a ativação de mecanismos reguladores, Mezzomo e Nadal (24) relataram que o baixo consumo desse micronutriente faz com que a tireoide se adapte a essa condição, aumentando a secreção de TSH pela hipófise. Esse aumento eleva a depuração plasmática de iodeto inorgânico pela tireoide, através da estimulação da expressão do NIS (Sodium Iodide Symporter). Knobel e Medeiros Neto (30) afirmaram que a glândula tireoide, face à carência de iodo, se adapta por incremento da captação deste halogênio, aumenta a sua massa glandular (hipertrofia/bócio), induz secreção preferencial de T3 e eleva a síntese e liberação de TSH. Tais estudos ratificam a influência do iodo sobre o funcionamento da tireoide.
A baixa concentração de iodo nos alimentos, assim como no organismo e o seu impacto sobre a reprodução é bastante significativo. A carência de iodo afeta a atividade reprodutiva pois esse é responsável por 20% da carga global para as mulheres e 14% para os homens (31). Desse modo, a prevenção da deficiência desse mineral tem um papel importante sobre a redução da ocorrência de problemas reprodutivos em humanos e animais. Segundo Dugassa e Negassa (32), um documento produzido pelo Ministério Etíope da Saúde mostrou que para cada dia de atraso no consumo do sal iodado, mais de 50.000 crianças nasceram com capacidade mental reduzida e 50.000 mortes pré-natais ocorrem todos os anos em virtude da carência de iodo.
De acordo com Hetzel (33), a deficiência de iodo nos animais domésticos além de causar uma síntese subnormal dos hormônios tireoidianos, também é responsável por desencadear falhas reprodutivas tais como elevada incidência de abortos espontâneos, natimortalidade e nascimento de bezerros fracos. Mcdowell (34) citou outros problemas reprodutivos associados a carência de iodo como ciclismo irregular, baixas taxas de concepção, placentas retidas e diminuição da libido. Who (35) afirmou que em ovinos os efeitos da falta de iodo vão além de maior incidência de abortos e natimortalidade, associando-a também a redução de peso dos fetos, comprometimento do crescimento da lã, puberdade tardia e período de gestação prolongado.
O tratamento para suprir a deficiência de iodo é a suplementação via dieta, em que se recomenda a inclusão de 0,45 mg/Kg de matéria seca (MS) de iodo para vacas em lactação e 0,33 mg/Kg de MS para vacas que não estão em lactação (36). Com a iodação do sal é menos frequente encontrar bócio nos animais e no homem e, nesse sentido, o iodo deve ser incorporado no sal na proporção de 10 a 100 ppm de sal (23). De acordo com o mesmo autor, a quantidade diária recomendada de iodo na dieta é de 35 mg/Kg de peso corporal (PC) para adultos e de 70 mg /Kg de PC para neonatos, uma vez que o leite não é considerado uma fonte adequada de iodo, contribuindo com apenas 5% dos requerimentos.
Conforme Martins et al. (14), a deficiência de iodo em ruminantes é um fenômeno que tem sido relatado em diferentes países da América do Sul, e no Brasil há relatos de bócio no Estado do Mato Grosso, onde foi identificado três surtos nos quais houve manifestação clínica da deficiência principalmente em bezerros. Micheloud et al. (37) relataram no noroeste argentino três surtos da deficiência de iodo em bovinos, caracterizados por bezerros natimortos ou que morreram poucas horas após o parto e, após a realização da necropsia, observaram achados compatíveis com bócio congênito, em que os bezerros nasceram com um aumento de volume na glândula tireoide, enquanto nenhuma das mães manifestaram sinais clínicos associados à deficiência de iodo. Em animais adultos, os efeitos dos baixos níveis de iodo na alimentação são, na maioria das vezes, subclínicos (14).
Altas concentrações de iodo nos alimentos é apontada como uma possível causa para o aumento do hipertireoidismo em felinos domésticos, pois como afirma Scarlett (38), em gatos fatores nutricionais foram sugeridos como potenciais agentes indutores dessa anomalia. Além disso, a deficiência ou o excesso de iodo têm sido indicados por diferentes autores como um importante fator para o desenvolvimento de disfunção tireoidiana, em especial hipertireoidismo mediante dietas contendo níveis elevados desse elemento (39). Entretanto, o papel do iodo no hipertireoidismo felino não está bem esclarecido, levando em consideração que existem outras substâncias presentes nos alimentos que alteram o sistema endócrino, como metais pesados e hidrocarboneto clorado.
A ingestão diária adequada de iodo é dificultada, tendo em vista que o conteúdo desse mineral contido nos alimentos para gatos é extremamente variável (40,41), além de que a sua concentração nos alimentos de origem vegetal é baixa (42) e, dessa forma, torna-se difícil o consumo balanceado pelos animais. Para humanos a necessidade de iodo na dieta é de 150 a 200 μg/dia, uma vez que o consumo de quantidades menores que 50 μg/dia levam à carência deste elemento, com consequente hipofunção tireoidiana (30). Esses autores ainda afirmam que quantidades maiores que 1.000 μg/dia podem levar à maior prevalência de doenças tireoidianas autoimunes. As recomendações de iodo para cães e gatos, segundo o NRC (43), USA, foi para a ingestão de 250 kcal de uma dieta contendo 350µg/I/1.000 kcal. Segundo Castillo et al. (44), a ingestão diária de iodo por cães não deve superar 250μg.
Ainda que vários fatores estejam associados ao surgimento de disfunções da tireoide, tornando-a uma anomalia multifatorial, a principal hipótese é que na deficiência de iodo a estimulação crônica da glândula para produzir hormônios leva à hipertrofia, eventual hiperplasia nodular e hipertireoidismo (45). Somado a isso, segundo Oliveira (2), no Brasil a conformidade no que se refere aos teores de nutrientes informados no rótulo dos alimentos para cães e gatos não permite avaliar os níveis de iodo, além de que na literatura nacional não foi evidenciado nenhum artigo que especifique a concentração de iodo em rações para gatos. A legislação estabelece apenas os limites máximos e mínimos de cálcio e fósforo (2). De acordo com Coffman (46), não há legislação ou regras para controle dos teores de iodo nas dietas comerciais para cães e gatos no Brasil, embora praticamente todas as dietas comerciais para gatos são suplementadas com iodo.
Para a avaliação do status de suficiência ou deficiência de iodo em animais e humanos, diferentes testes têm sido propostos levando-se em consideração parâmetros bioquímicos, anatômicos e histopatológico (47). Concentrações menores que 100 µg/L na urina e 20 µg/L no leite, são indicativos de deficiência de iodo tratando-se de bovinos (48). Em humanos, Who (49) estabeleceu diferentes níveis de suficiência de acordo com a concentração de iodo presente na urina e afirmou que quantidades menores que 20 µg/L representam uma deficiência severa. O mesmo autor ainda relata que valores entre 100-199 µg/L compreendem um status nutricional adequado de iodo e que valores maiores que 300 µg/L significam uma ingestão excessiva desse mineral com risco de consequências adversas sobre o funcionamento da tireoide.
Vale lembrar que intoxicações por excesso de iodo em ruminantes foram reportadas após uma ingestão superior a 50 mg/kg MS (50) e que as causas que possibilitam a ocorrência desse fato incluem o consumo de dietas com suplementação excessiva, suplementos minerais formulados inadequadamente e uso prolongado de produtos iodados no tratamento e prevenção de doenças respiratórias (51). Os sinais clínicos de intoxicação por excesso de iodo são tosse, lacrimejamento e secreção nasal em adultos. Os bezerros, além de manifestar os mesmos sintomas clínicos que os adultos, também podem apresentar dermatite seborreica seca, principalmente na cabeça e no pescoço uma vez que são mais susceptíveis a intoxicação.
NUTRIÇÃO E FUNÇÃO TIREOIDIANA
As concentrações sanguíneas dos hormônios tireoidianos são consideradas melhores indicadores da nutrição animal e consumo de alimentos do que o status de adiposidade, tendo em vista que a qualidade e quantidade de alimentos ingeridos são fatores importantes que influenciam nos níveis de hormônios produzidos pela tireoide (52). O estado de restrição alimentar, além de aumentar as concentrações plasmáticas de cortisol, também promove a diminuição do nível de T3, hormônio que estimula diretamente o consumo de alimento a nível de hipotálamo (52). Somado a isso, os autores afirmam que o pastoreio de gramíneas de baixa qualidade diminui os níveis de T3 e T4, uma vez que as plantas apresentam apenas traços de iodo e, portanto, possuem baixa concentração desse mineral (42) tão importante para a produção de hormônios tireoidianos.
A carência dietética de iodo é a principal causa de hipotireoidismo primário em algumas regiões (24). Além disso, a deficiência de selênio tem sido um achado constante em doenças da tireoide, visto que a sua escassez promove a redução das selenoproteínas as quais protegem a tireoide de danos causados por radicais livres. Nesse sentido, percebe-se que o selênio desempenha papel importantíssimo na regulação da função da tireoide, assim como na homeostase dos hormônios produzidos por esta glândula (24). Segundo Osorio e Correa (52), o selênio nos estágios pré-natais melhora a concentração de T3 no sangue e a deficiência desse mineral prejudica a conversão de T4 em T3, sem falar que também leva a diminuição periférica da síntese de T3 e destruição da ID1 (iodotironinadeiodinase), enzima que catalisa a conversão de T4 em T3 (24).
A atividade tireoidiana é reduzida em função da deficiência de iodo (23), zinco (24), como também o elevado nível de cálcio em dietas promove a diminuição da absorção de iodo a nível de intestino com consequente aparecimento de bócio (20). O pesquisador Cheeke (9) afirmou que uma causa comum de bócio é a presença de goitrógenos em alimentos para animais, que são substâncias que interferem na síntese de hormônios tireoidianos. Segundo estudos com animais, a deficiência de zinco resulta em diminuição de aproximadamente 30% nos níveis de T3 e T4 livres, associando-a como uma possível causa para o surgimento do hipotireoidismo subclínico (24).
Quantidades excessivas ou deficitárias de alguns macros ou micronutrientes contribuem para alterações tireoidianas e, de acordo com Mezzoma e Nadal (24), dietas restritivas ou alimentação desequilibrada em qualquer fase da vida colaboram com a diminuição da produção de hormônios tireoidianos. A privação energética diminui as concentrações de T3 e T4 livre em ovelhas adultas, enquanto a superalimentação subsequente aumenta (52). Entretanto, o fator subjacente responsável pela disfunção da tireoide permanece obscuro (2) e, desse modo, a influência dos nutrientes sobre a função tireoidiana ainda é de difícil compreensão pela ciência (24), o que reforça a ideia de que as disfunções tireoidianas são de fato multifatoriais.
O hipertireoidismo, considerado uma enfermidade multissistêmica (53) que ocorre com mais frequência em gatos com mais de oito anos de idade (54), ainda não tem sua patogenicidade definida de forma clara, todavia pressupõe-se que fatores circulatórios como imunoglobulinas, nutricionais como a presença de iodo na dieta e ambientais como toxinas bociogênicas podem influenciar na sua gênese (55,56). De acordo com Mooney (57) e Edinboro et al. (58), a concentração de iodo presente em rações enlatadas é bastante variável, além de que sua inclusão é dez vezes maior do que o necessário e, dessa forma, gatos que consomem dietas enlatadas têm aumento significativo da chance de desenvolver hipertireoidismo.
SUBSTÂNCIAS BOCIOGÊNICAS
Nos alimentos existem várias substâncias que agem direta e indiretamente sobre a tireoide de modo que alteram o seu funcionamento. A presença de substâncias bociogênicas na dieta é importante, assim como a deficiência de iodo na ocorrência de bócio nos animais, pois interferem na síntese de hormônios da tireoide (42). A maioria delas são conhecidas, possuem estrutura química definida e pertencem ao grupo dos cianatos, tiocianatos, isotiocianatos, nitrilas, tiooxazolidonas, nitratos e nitritos, dissulfetos ou dos flavonoides (59). Além disso, essas substâncias estão presentes em uma grande variedade de alimentos de origem vegetal, os quais são usados na alimentação animal como farelo de soja, farelo de algodão, amendoim e leucena (42), alfafa e mandioca (10).
Nas plantas do gênero Brassica existe uma substância, a 2,5-vinil-2-tiooxazolidona, a qual é capaz de desencadear hiperplasia da tireoide, especialmente em condições de baixa ingestão de iodo na dieta, entretanto, encontra-se inativa até o momento que é convertida para sua forma ativa por uma enzima glicosidase, a mirosinase (60). Outras substâncias como a 5,5-dimetil-2-tiooxazolidona e 3-indol-acetonitrila podem ser encontradas em plantas do gênero Brassica. De acordo com Underwood (61), as espécies desse gênero possuem em sua constituição substâncias denominadas de pró-goitrina, forma biologicamente ativa a nível de intestino delgado. Esse autor ainda afirma que após absorção, esse composto irá para a corrente sanguínea o qual vai interferir na formação dos hormônios tireoidianos T3 e T4 através da inibição da organização do iodo.
As substâncias bociogênicas causam bócio, pois influenciam na produção de T3 e T4 (42). Essas substâncias, segundo os mesmos autores, podem atuar em diferentes pontos, de modo que inibem a formação e liberação de hormônios pela tireoide. A partir disso, a glândula pituitária libera TSH (hormônio tiroestimulante) o qual é responsável por estimular a captação de iodeto da circulação pela tireoide, mecanismo desenvolvido numa tentativa de aumentar a produção de hormônios T3 e T4, entretanto, ocorre o aumento do volume da glândula tireoide em virtude do estímulo excessivo provocado pelo hormônio estimulador (TSH). Além disso, alguns agentes bociogênicos como o tiurácil ou tiuréia podem antagonizar a oxidação do iodeto em iodo, sem falar que demais compostos como sulfas, tiuréias e o ácido paraaminobenzóico têm efeito bloqueador sobre a produção dos hormônios tireoidianos (42).
Os glicosinolatos, conhecidos como metabólitos secundários presentes nas plantas do gênero Brassica, interferem negativamente na obtenção de iodo dietético, e o consumo prolongado destes compostos produz aumento na concentração plasmática de tiocianato e diminuição na concentração da tiroxina, além de promover alterações a nível histológico da glândula tireoide (62). Estudos feitos com ratos que ingeriram pigmento glicosídico demonstraram a existência de atividade bociogênica de modo que ocorre uma iodação preferencial dos metabólitos formados após a ingestão desse pigmento e, nesse sentido, acarretará na diminuição da quantidade de iodo disponível para ligar-se a tirosina (60). Nas cebolas também se encontram compostos sulfurados que bloqueiam a captação de iodo, como o n-propildissulfeto.
A soja (Glycine max L), alimento muito utilizado na dieta humana e animal, tem gerado preocupação sobre a função da glândula tireoide, pois estudos in vitro em animais demonstraram que as isoflavonas, principalmente a genisteína e daidzeína presentes na soja apresentam a capacidade de inibir a enzima tireoperoxidase, a qual promove a iodação da tireoglobulina, importante para a síntese dos hormônios tireoidianos. A inibição dessa enzima provoca diminuição da produção de hormônios T3 e T4, aumenta a produção de TSH endógeno e pode induzir ao bócio e ao hipotireoidismo (24). O pesquisador Mc Carrison (63) relata que ratos alimentados com soja crua apresentaram hiperplasia da tireoide, mesmo com quantidades superiores de iodo contidas na ração, assim como Filisetti (60, 59) afirmou que a ingestão por 16 dias de soja crua autoclavada causou aumento de 40% no peso da tireoide.
Assim como a soja faz parte da dieta animal, a Leucena (Leucaena Leucocephala) é uma leguminosa de alta qualidade e importância forrageira para a produção animal, uma vez que é usada como suplemento protéico, principalmente no período de seca, já que é pouco exigente quanto ao solo e de rápida dispersão. Entretanto, a L-mimosina, aminoácido não proteico presente nessa espécie vegetal, apresenta potencial de causar hiperplasia tireoidiana, hipotireoidismo e morte (28). Segundo Jones (64), esse princípio tóxico é uma substância não bociogênica. A degradação da L-mimosina através da mastigação com saliva alcalina e especialmente a incubação no rúmen em ruminantes promove formação do 3,4-di-hidro-piridina (65,66,64), metabólito primário que é considerado responsável pela ação bociogênica em animais que se alimentam da leucena (65,67,68).
Estudo realizado por Porto (28) para investigar as alterações clínicas de equinos intoxicados natural e experimentalmente com Leucaena leucocephala mostrou que houve declínio significativo nos níveis totais de T3 e T4 na terceira semana de ingestão da planta e que os achados clínico-patológicos em equinos são semelhantes aos observados em ruminantes. A pesquisadora afirmou que a intoxicação experimental por leucena evidenciou acentuado declínio nos níveis de hormônios produzidos pela tireoide e que tal fato revela efeito bociogênico da L-mimosina e dos compostos derivados dela, como o 3,4-di-hidro-piridina e 2,3-di-hidro-piridina. Para reforçar a influência da L-mimosina sobre a função tireoidiana, Osorio e Correa (52) afirmam que este composto reduz as concentrações séricas de T4, apesar que de forma parcial.
A alfafa (Medicago sativa L.), espécie vegetal que também é muito usada para a alimentação de animais, contém um composto potencialmente bociogênico, o perclorato (CLO4–), o qual tem sido identificado em produtos dessa planta. Leung et al. (69) afirmaram que o CLO4– é um ânion que exerce inibição competitiva no NIS (Sodiun-iodine symportter) e interfere no transporte de iodo para o interior da tireoide. A captação de iodeto pela tireoide é bloqueada pelo perclorato (42), mas os efeitos dele sobre a saúde de vacas leiteiras e dos bezerros não têm sido estudados. Os riscos de consumo do perclorato por consumidores e, consequentemente, as disfunções tireoidianas provocadas pelo efeito bociogênico desse ânion são reduzidas, tendo em vista que a sua concentração no leite é influenciada pela quantidade ingerida pelos animais, além de que 80% dele é metabolizado no rúmen (70).
Na mandioca (Manihot utilíssima), existe um alto conteúdo de glicídios cianogênicos, o que a torna uma espécie vegetal limitante para uso na alimentação animal (10). Para complementar, Filisetti (60) declarou que a linamarina e a loto-australina são dois glicosídeos presentes na mandioca capazes de liberar cianeto pela ação de uma enzima beta glicosidase e que, porventura, o cianeto pode ser detoxicado pela ação da rodanase hepática a tiocianeto, substância bociogênica. De acordo com Bernadá e Gonzalez (10) este composto interfere na produção dos hormônios tireoidianos pela inibição da iodação da tirosina, ou seja, a ligação do iodo no resíduo de Tyr da tireoglobulina.
CONCLUSÕES
A disfunção da glândula tireoide é comum em todas as espécies de animais e provocada por diversos fatores como excesso ou carência de iodo dietético, presença de substâncias bociogênicas nos alimentos, privação energética, carência de zinco, selênio e excesso de cálcio, tornando-a uma endocrinopatia multifatorial e de grande importância para a produção animal principalmente pelo fato de provocar alterações multissistêmicas as quais vão refletir no desempenho produtivo, reprodutivo e bem-estar dos animais. Além disso, a presença de substâncias bociogênicas em uma grande variedade de espécies vegetais terrestres utilizadas na alimentação animal, é fator que merece atenção quanto ao desenvolvimento de estratégias de manejo nutricional com a finalidade de ofertar alimentos seguros, isentos de substâncias tóxicas para os animais de produção, evitando-se efeitos negativos sobre o desempenho, saúde e bem-estar dos mesmos.
AGRADECIMENTOS
Agradeço a Deus por toda coragem, força e persistência que tem me dado para suportar a caminhada percorrida até o momento. Agradeço também aos meus pais por me darem todo o suporte para que eu progrida na carreira acadêmica e possa permanecer nela alçando voos cada vez mais altos. Agradeço ao professor Doutor Juliano Martins Santiago por ter acreditado no meu potencial, pois ele foi um dos únicos que me recepcionou de forma acolhedora desde o início e graças a sua contribuição, o trabalho foi construído da melhor forma. Por fim, deixo também expressa a minha gratidão a professora Doutora Rossana Herculano Clamentino por ter contribuído com todo o seu conhecimento sobre fisiologia animal para a construção deste trabalho.
REFERÊNCIAS
- ARAÚJO ICS, FURTADO AP, ARAÚJO GCP, ROCHA CG. Efeito do tipo de alimentação de cães saudáveis sobre análises clínicas e aspectos comportamentais. Arq. Bras. Med. Vet. Zootec. 2018; 70: 689-698.
- OLIVEIRA PC. Teores de iodo na dieta e função da tireóide em gatos. Seropédica, RJ. Universidade Federal Rural do Rio de Janeiro; 2011.
- PATRA AK, SAXENA J. The effect and mode of action of saponins on the microbial populations and fermentation in the rumen and ruminant production. NRR. 2009; 204-219.
- PATRA A K, SAXENA JÁ. New perspective on the use of plant secondary metabolites to inhibit methanogenesis in the rumen. Phytochemistry. 2010; 71(11–12):1198-1222.
- SILVA MR, SILVA MAAP. Fatores antinutricionais: inibidores de proteases e lecitinas. Rev. de Nutrição. 2000; 13: 3-9.
- NUNES RV, BUTERI CB, VILELA CG, ALBINO LFT, ROSTAGNO HS. Fatores antinutricionais dos ingredientes destinados à alimentação animal. In: Enciclopédia biosfera. 2001; 8 :235-269.
- RUIZ ME, THIAGO LRLS, COSTA FP. Alimentação de bovinos na estação seca: princípios e procedimentos. Campo Grande, MS 1984.
- TEIXEIRA JC. Nutrição de ruminantes. ed. LAVRAS UFLA/FAEPE; 2001.
- CHEEKE PR. Rabbit Feeding and Nutrition. Orlando: editora Academic Press; 1987
- BERNADÁ MHG, GONZÁLEZ FHD. Metabolismo do iodo. Rio Grande do Sul ;2004.
- CAPEN CC. The endocrine glands. In: JUBB KVF, KENNEDY PC, PALMER NC. (Eds). Pathology of domestic animals. Academic press. 1993; 3. Disponível em http://dx.doi.org/10.1016/B978-0-12-391607-5.50011-X. Acesso em: Setembro. 2021.
- CUNNINGHAM JG, KLEIN BG. Glândulas endócrinas e suas funções. In: Ibid. (Eds), 4ª ed. Rio de Janeiro: Elsevier; 2008.
- EILER H. Glândulas endócrinas. In: Reece W.O. 12ª ed. Rio de janeiro: Guanabara Koogan; 2012.
- MARTINS KPF, FONSECA TRS, SILVA ES, MUNHOZ TCP, DIAS GHS, GALIZA GJN, OLIVEIRA LGS, BOABAID FM. Bócio em bovinos. Pesquisa Veterinária Brasileira. 2018.
- WITHER SE. Congenital goiter in cattle. Can. Vet. J. 1997; 38(3):178.
- PEZZUTI IL, LIMA PP, DIAS VMA. Hipotireoidismo congênito: perfil clínico dos recém-nascidos identificados pelo programa de triagem neonatal de Minas Gerais. J. Pediat. 2009.
- CAMPBELL AJD, CROSER EL, MILNE ME, HODGE PJ, WEBB WARE JK. An outbreak of severe iodine-deficiency goiter in a sheep flock in north-east Victoria. Aust. Vet. J. 2012. Disponível em . Acesso em: Novembro. 2021.
- PANZIERA W, KOWALSKI AP, GALIZA GJN, BIANCHI RM, ESPÍNDOLA JP, CARDOSO MM, VARGAS AC, FIGHERA RA. Bócio congênito em caprinos no noroeste do Rio Grande do Sul, Brasil. Ciência Rural. 2014; 12: 2217-2220. Disponível em http://dx.doi.org/10.1590/0103-8478cr20140413. Acesso em: Outubro. 2021.
- RADOSTITS OM, GAY CC, BLOOD DC, HINCHCLIFF KW. Doenças causadas pela herança de caracteres indesejáveis. 9ed. Rio de Janeiro: Guanabara Koogan; 2002.
- TOKARNIA CH, PEIXOTO PV, BARBOSA JD, BRITO MF, DÖBEREINER J. Iodo. In: Ibid. (Eds). Deficiências minerais em animais de produção. Rio de Janeiro: Helianthus; 2010.
- MARTINS EO. Bócio congênito em cabritos. Revta. Faculdade med. vet. USP. 1946; 3:123-126. Disponível em http://dx.doi.org/10.11606/issn.2318-5066.v3i3p123-126. Acesso em: Dezembro. 2021.
- TOKARNIA CH, DÖBEREINER J, PEIXOTO PV. Deficiências minerais em animais de fazenda, principalmente bovinos em regime de campo. Pesq. Vet. Bras. 2000; 3:127-138. Disponível em http://dx.doi.org/10.1590/S0100-736X2000000300007. Acesso em: Novembro. 2021.
- GONZALEZ FHD. Indicadores sanguíneos do metabolismo mineral em ruminantes. Porto Alegre- RS. Universidade Federal do Rio Grande do Sul; 2000.
- MEZZOMO TR, NADAL J. Efeito dos nutrientes e substâncias alimentares na função tireoidiana e no hipotireoidismo. Curitiba-PR; 2016. Disponível em . Acesso em: Outubro. 2021.
- ESTIEBE AW, BERLEZI AC, BECK C. Hipotireoidismo em cães. Salão do conhecimento; 2020.
- KANECO JJ. Thyroid function. In: KANECO JJ, HARVEY JW, BRUSS ML. Clinical Biochymisttry of domestic animals. 2008; 671-588
- GUYTON AC, HALL JE. Tratado de Fisiologia Médica. 13ª ed. Editora Elsevier; 2017.
- PORTO MR. Intoxicação natural e experimental de equinos por Leucaena leucocephala. Brasília-DF. Faculdade de Agronomia e Medicina Veterinária; 2016.
- KIMURA ET. In: Fisiologia. Glândula tireóide. Margarida de Melo Aires. Editora Guanabara Koogan; 2008.
- KNOBEL M, MEDEIROS NETO G. Moléstias associadas à carência. Arquivo Brasileiro Endocrinologia Metabolismo. 2004; 48.
- WHO. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 2nd ed. World Health Organization; 2001. Disponível em https://apps.who.int/iris/handle/10665/61278. Acesso em: Outubro. 2021.
- DUGASSA BF, NEGASSA A. Understanding the ecology of iodine deficiency and its public health implications: The case of oromia region in Ethiopia. Journal of community nutrition e health. 2012; 1.
- HETZEL BS, MABERLY G.F. Iodine. Trace elements in human and animal nutrition. 5th edition. New York: Academic press; 1986.
- MCDOWELL LR. Iodine minerals in animal and human nutrition. New York: Academic press; 1992.
- WHO. Trace elements in human nutrition and health. Geneva; 1996. Disponível emhttp://www.who.int/nutrition/publications/micronutrients/9241561734/en/index.html. Acesso em: Novembro.2021.
- NATIONAL RESEARCH COUNCIL. Nutrient Requirements of Dairy Cattle. Seventh Revised Addition 2001. National academy press; 2001.
- MICHELOUD JF, OLMOS LH, GARCIA JÁ, MATTIOLI GA, UZAL FA. Perinatal mortality in cattle associated with goitre. Brazilian Journal of Veterinary Pathology. 2019.
- SCARLETT JM. Epidemiology of thyroid diseases of dogs and cats. Small animal practice. 1994; 24.
- TARTTELIN MF, FORD HC. Dietary iodine level and thyroid function in the cat. Journal of Nutrition. 1994; 124.
- JOHNSON LA, FORD HC, TARTTELIN MF, FEEK CM. Iodine content of commercially-prepared cat foods. The New Zealand Veterinary Journal. 1992; 40: 18-20.
- MARTIN KM, ROSSING MA, RYLAND LM, DIGIACOMO RF, FREITA G WA. Evaluation of dietary and environmental risk factors for hyperthyroidism in cats. Journal of the American Veterinary Medical Association. 2000; 217.
- WARKENTIN M, GONZÁLEZ FHD. Bócio: Aspectos nutricionais e toxicológicos. 2003.
- NATIONAL RESEARCH COUNCIL (NRC). Nutrient requirements of laboratory animals. Washington; 2006.
- CASTILLO VA, PISAREV MA, LALIA JC, RODRIGUÉZ MS, CABRINI HL, MÁRQUEZ AG. Commercial diet induce hypothyroidism due to high iodine. Histopathological and radiological analysis. Veterinary Quartely, 2001; 23.
- DELANGE FM, ERMANS AM. Iodine deficiency. In: Braverman LE, Utiger RD, eds. Werner and Ingbar’s the thyroid: a fundamental and clinical text. Philadelphia: Lippincott-Raven; 1996.
- COFFMAN HD. The cat food reference. Nashua: PigDog Press; 1997.
- CONTRERAS LV. Prevalência de deficiência de iodo em vacas leiteiras no Rio Grande do Sul e fatores associados. Porto Alegre. Universidade Federal de Rio Grande do Sul; 2020.
- HERZIG I, PISARIKOVA B, KURSA J, RIHA J. Defined iodine intake and changes of its concentration in urine and milk of dairy cows. Veterinarni Medicina. 1999; 44.
- WHO. UNICEF, ICCIDD Newsletter, Geneve; 2007. Disponível em . Acesso em: Novembro, 2021.
- TROEDSSON M, CHRISTENSEN BW. Alterations in sexual function. In: SMITH, B. Bradford Smith´s Large Animal Internal Medicine. 5 ed. St. Louis: ELSEVIER; 2015.
- PAULÍKOVÁ I, KOVAC G, BIRES J, PAULÍK Š, SEIDEL H, NAGY O. Iodine toxicity in ruminants. Veterinarni Medicina. 2002; 47.
- OSÓRIO JH, CORREA D. Alteraciones de los niveles de hormonas tiroideas y su influencia en la salud y producción de pequeños rumiantes. Manizales. Universidad de Caldas; 2013.
- NELSON RW. Distúrbios da glândula tireoide. In: NELSON RW, COUTO CG. Medicina interna de pequenos animais. Rio de Janeiro: Elsevier; 2010.
- GORDON JM. et al. Juvenile hyperthyroidism in a cat. Jounal of the American Animal Hospital Association. 2003; 39.
- PETERSON ME, KINTZER PP, CAVANAGH PG. Feline hyperthyroidsm: pretreatment clinical and laboratory evaluation of 131 cases. J. Am. Vet. Med Assoc. 1983; 183.
- LURYE JC. Update on treatment of hyperthyroidsm. ln: AUGUST JR. Consultations in feline internal medicine. Missouri: Elsevier Saunders; 2006.
- MOONEY CT. Pathogenesis of feline hyperthyroidsm. journal of feline medicine and surgery. 2002; 4.
- EDINBORO CH et al. Epidemiologic study of relationships between consuption of commercial canned food and risk of hyperthyroidsm in cats. Journal of American Veterinary Medical Association. 2004; 224.
- FILISETTI TMCC. Ação da soja sobre a tireóide de ratos: Influência do iodo da ração. São Paulo. Universidade de São Paulo; 1984.
- FILISETTI TMCC. Efeito da ingestão de derivados de soja (glycine max) sobre a tireóide de ratos: Estudo com o emprego de iodo radioativo. São Paulo. Faculdade de Ciências Farmacêuticas da Universidade de São Paulo; 1977.
- UNDERWOOD EJ. Mineral nutrition of livestock. 1983.
- TRIPATHI MK, MISHRA AS. Glucosinolates in animal nutrition: A review. Animal Feed Science and Technology. 2007; 132.
- MCCARRISON R. The goitrogenic action of soya-bean and ground-nut. Indian.j.med.res. 1933.
- JONES RJ. Leucaena toxicity and the ruminal degradation of mimosine. ln: Plant toxicology- Australia-Usa poisonous plants symphosium, Queensland: Yeerongpilly; 1985.
- HEGARTY MP, COURT RD, CHRISTIE GS, LEE CP. Mimosine in Leucaena leucocephala is metabolized to a goitrogen in ruminants. Aust. Vet. J. 1976.
- MEGARRITY RG, JONES RJ. Toxicity of Leucaena leucocephala in ruminants– The effect of supplemental thyroxine on goats fed on a sole diet of leucaena. Aust. J. Agric. Res. 1983.
- HOLMES JHG, HUMPHREY JD, WALTON EA, O´SHEA JD. Caracts, goitre and infertility in cattle on na exclusive diet of Leucaena leucocephala. Aust. Vet. J. 1981.
- HALLIDAY MJ, PADMANABHA J, MCSWEENEY C, KERVEN G, SHELTON HM. Leucena toxicity: a new perspective on the most widely used forage tree legume. Trop.Grassl. –Forraj. 2013.
- LEUNG AM, PEARCE EN, BRAVERMAN LE. Perchlorate, iodine and the thyroid. Best practice e research. 2010; 24.
- CAPUCO AV, RICE CP, BALDWIN RL6TH, BANNERMAN DD, PAAPE MJ, HARE WR, KAUF AC, MCCARTY GW, HAPEMAN CJ, SADEGHI AM, STARR JL, MCCONNELL LL, VAN TASSELL CP. Fate of dietary perchlorate in lactating dairy cows: Relevance to animal health and levels in the milk supply. Proceedings of the National Academy of Sciences of the United States of America. 2005.
Tag:CBPAV

