
CONSUMO DE DIETAS HIPERLIPÍDICAS ASSOCIADA A INGESTÃO DE FRUTOSE PÓS DESMAME ACARRETA DANOS CARDIOVASCULARES EM RATOS NO INÍCIO DA VIDA ADULTA
Capítulo de livro publicado no livro do I Congresso Internacional em Ciências da Nutrição. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062015-20
Este trabalho foi escrito por:
Franciely Alves da Silva* https://orcid.org/0000-0001-6677-2650; Lorena Silva Freire https://orcid.org/0000-0002-9601-7768; Stephanie Figueiredo Santo https://orcid.org/0000-0001-8725-5468s; Nair Honda Kawashitaǂ https://orcid.org/0000-0001-6286-657X; Mayara Pereira Peron https://orcid.org/0000-0001-8536-971X
ǂ in memorian
Resumo: A condição nutricional imposta em fases críticas do desenvolvimento como a infância e adolescência podem impactar na saúde na idade adulta, com o surgimento de doenças associados ao coração como é o caso da hipertrofia ventricular esquerda (HVE). Dessa forma, objetivou-se com esse estudo avaliar o efeito da ingestão deitas hiperlipídicas associadas a frutose como bebida sobre o desenvolvimento de danos cardiovasculares em ratos adultos, quando introduzidas logo após o desmame. Para isso, foram utilizados24 ratos machos Wistar distribuídos em três grupos: C – dieta controle mais água como bebida; HL45 – dieta hiperlipídica 45 com 45% kcal de lipídeos mais solução de frutose 10% como bebida e HL60 – dieta hiperlipídica 60 com 60% kcal de lipídeos ais solução de frutose 10% como bebida. As deitas e solução de frutose foram oferecidas aos animais durante 70 dias. Após este período, os animais dos grupos HL45 e HL60 apresentaram dano cardiovascular observado pelo aumento dos níveis séricos de CK-MB, aumento da razão do ventrículo esquerdo com o comprimento da tíbia. Além disso, foi observado um quadro leve de inflamação e deposição de colágeno no grupo HL60. O presente estudo fornece indicativo de danos cardiovasculares entre os grupos obesos quando comparados ao grupo controle. Posto isto, para elucidar tais achados, mais investigações acerca da temática são necessárias.
Palavras–chave: dietas hiperlipídica; obesidade; dano cardiovascular; hipertrofia ventricular esquerda
Abstract: The nutritional condition imposed in critical stages of development such as childhood and adolescence can impact health in adulthood, with the emergence of diseases associated with the heart such as left ventricular hypertrophy (LVH). Thus, the objective of this study was to evaluate the effect of the ingestion of high-fat diets associated with fructose as a beverage on the development of cardiovascular damage in adult rats, when introduced soon after weaning. For this, 24 male Wistar rats were divided into three groups: C – control diet plus water as a drink; HL45 – high-fat diet 45 with 45% kcal of lipids plus 10% fructose solution as a drink and HL60 – high-fat diet 60 with 60% kcal of lipids plus 10% fructose solution as a drink. The beds and fructose solution were offered to the animals for 70 days. After this period, the animals of the HL45 and HL60 groups presented cardiovascular damage observed by the increase in the serum levels of CK-MB and the increase of the ratio of the left ventricle to the length of the tibia. In addition, a mild picture of inflammation and collagen deposition was observed in the HL60 group. The present study indicates cardiovascular damage among obese groups when compared to the control group. That said, to elucidate such findings, further investigations on the subject are necessary.
Keywords: obesogenic diets; obesity; cardiovascular damage; left ventricular hypertrophy
INTRODUÇÃO
A qualidade da composição nutricional ofertada durante as fases iniciais do desenvolvimento humano pode impactar na saúde na idade adulta (1). O consumo de dieta ocidental (ou seja, rica em gorduras e açúcares), associada à inatividade física contribuem significantemente para o aumento da obesidade e suas comorbidades como hipertensão, doença hepática gordurosa não alcoólica, hiperleptinemia, hipertrigliceridemia, e desenvolvimento de doenças cardiovasculares como hipertrofia ventricular esquerda (HVE) (2; 3; 4).
A HVE é um mecanismo de adaptação do coração devido à sobrecarga de volume e pressão, progredindo para a insuficiência cardíaca, uma das principais doenças responsáveis por morte mundialmente (5; 6). A HVE é desenvolvida em virtude da obesidade (7) não só em adultos, mas também em períodos críticos do desenvolvimento humano como crianças e adolescentes (8), dessa forma, a má alimentação no início da vida pode impactar na saúde do coração a longo prazo (9).
Diferentes modelos experimentais introduzem o consumo de gordura e/ou de frutose na dieta a fim de mimetizar essa obesidade e eventualmente o surgimento da HVE (10; 11; 12; 13). MELLS et al. (4) observaram que camundongos tratados com dieta (contendo 30% de gordura e 55% de frutose) por 12 semanas apresentaram HVE, avaliados através da relação da massa do ventrículo esquerdo (VE) em gramas (g) e o comprimento da tíbia, A razão entre o peso do coração e de seus ventrículos com o comprimento da tíbia é uma medida estabelecida de hipertrofia cardíaca desde 1982, onde estudo conduzido por YIN et al. (14) demonstram que a tíbia permanece constante apesar da maturidade.
Em modelos de obesidade induzida por dieta já observaram que vias de sinalização como STAT3 e JNK são ativadas em condições obesogênicas, sendo responsáveis pelo desenvolvimento da HVE (15; 16; 17). Contudo, nenhum estudo investigou se o consumo de dietas hipercalóricas/hiperlipídicas associada a ingestão de frutose introduzida logo após o desmame e seu desfecho em ocasionar danos cardiovasculares no início da vida adulta. Dessa forma, o objetivo da presente investigação foi determinar os efeitos do consumo de dietas hiperlipídicas associadas à ingestão de frutose como bebida introduzidas logo após o desmame, no desenvolvimento de danos cardiovasculares.
MATERIAL E MÉTODOS
No presente estudo foram utilizados 24 ratos machos Wistar, recém desmamados, (21 dias de idade, massa corporal aproximada de 43g, n = 8), mantidos 4 animais por gaiola, em sala climatizada (23 ± 1 °C), ciclo claro-escuro invertido a cada 12:12-h. Os procedimentos experimentais foram realizados de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório (Guide for the Care and Use of Laboratory Animals) obtido pelo Instituto Nacional de Saúde dos EUA (U.S. National Institute of Health) e conforme determinado pelas resoluções brasileiras específicas em relação à bioética em experimento com animais de laboratório (Lei n°. 11.794, de 8 de outubro de 2008 sob o Decreto n°. 6.899 de 15 e julho de 2009). O projeto (Nº. 23108.169089/2016-09) foi aprovado pelo Comitê de Ética no Uso de Animais (CEUA) da Universidade Federal de Mato Grosso – UFMT.
Animais e tratamento
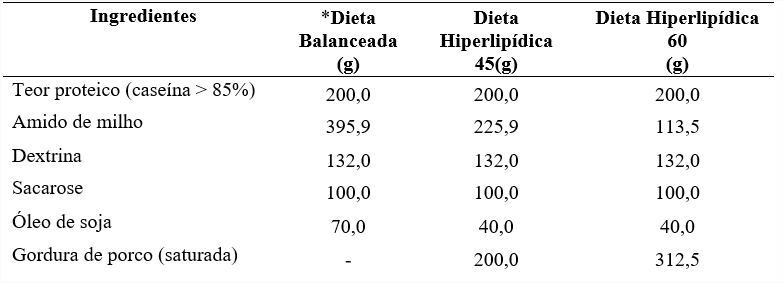
Os ratos foram distribuidos aleatoriamente em três grupos com acesso a ração e água (ou frutose 10%) ad libitum. Os animais do grupo controle (C) receberam dieta balanceada (7% de lipídeo) para roedores na fase de crescimento e água (18). Os animais do grupo HL45 receberam dieta Hiperlipídica 45 (45% das calorias a partir de lipídeo) e hidratação com solução aquosa frutose à 10%, e os animais do grupo HL60 receberam dieta Hiperlipídica 60 (60% das calorias a partir de lipídeo) e hidratação com solução aquosa de frutose à 10% (Tabela 1) (1; 29). Dietas foram preparadas pela empresa PragSoluções, Jaú – SP, Brasil. Os grupos receberam suas respectivas dietas por 70 dias. O peso, a ingestão alimentar e o consumo de água ou frutose foram mensurados três vezes por semana.
Eutanásia
Ao final do período de 70 dias, os animais foram mantidos em jejum por 12 horas, em seguida anestesiados com CO2 e eutanasiados por decapitação. Os tecidos, órgãos e sangue dos animais foram retirados para posterior análise.
Estrutura do coração post mortem
O processo de remodelação cardíaca foi avaliado por análise estrutural macroscópica das câmaras cardíacas post mortem, a fim de identificar a presença de hipertrofia cardíaca a nível ventricular (19; 20). Para avaliar o grau de hipertrofia foi determinada as massas do coração, ventrículo esquerdo (VE), ventrículo direito (VD) e o comprimento da tíbia (mm). Para determinação do comprimento da tíbia foi utilizado paquímetro Macrilan (AC-06), após a retirada dos tecidos circundantes moles. A partir desses dados obteve se a relação damassa do coração (g) com o comprimento da tíbia e da massa dos ventrículos (g) com o comprimento da tíbia.
Parâmetros bioquímicos
A atividade da enzima creatina quinase fração – MB (CK-MB), foi determinada utilizando kits comerciais (Bioclin®, Belo Horizonte, MG).
Immunoblotting
Extratos de células inteiras foram preparadas a partir do ventrículo esquerdo de ratos por homogeinização em tampão específico contendo inibidores de proteases (homogeneizado em tampão Tris-HCl 50 mmol·L-1 (pH 7,4; 4 ° C) contendo 150 mmol L-1 de NaCl, 1 mmol·L-1 de ácido etilenodiaminotetracético, 1% de Triton X-100, 0,1% de dodecil sulfato de sódio (SDS), 10 mmol·L -1 de ortovanadato de sódio, 100 mmol-1 de fluoreto de sódio, 5 μg·mL-1 de aprotinina e 1 mmol-1 – fluoreto de fenilmetilsulfonilo. O homogenato foi centrifugado por 40 minutos à 4ºC a 12000 rpm. O sobrenadante foi utilizado para realização da eletroforese e dosagem de proteína pelo método de Bradford (21). Foram adicionados 100 ml do tampão da amostra a cada 400 ml do sobrenadante obtido. As amostras foram fervidas por 5 minutos e logo em seguida os respectivos volumes foram aplicados nos “poços” do gel de poliacrilamida para separação eletroforética. Ao término da corrida, as proteínas separadas no gel foram transferidas para uma membrana de nitrocelulose e incubada com solução bloqueadora, lavada com solução basal (3 vezes com intervalos de 5 a 10 minutos cada). Logo em seguida, a membrana foi incubada overnight com o anticorpo primário correspondente a cada uma das proteínas pSTAT3 (B-7) (sc8059) e JNK (D-2) (sc-7345) na diluição de 1:200. Após incubação com o anticorpo primário, a membrana foi lavada com solução basal e incubada por mais 2 horas com o anticorpo secundário (1:7500), sob agitação, à temperatura ambiente. O anticorpo ligado foi detectado por quimioluminescencia pelo sistema de foto documentação ChemiDocTM (BioRad), como descrito pelo fabricante. A α-Tubulina foi utilizada como controle interno. As imagens capturadas foram analisadas no software Image Lab 6.0.
Análise Estatística
Os dados são apresentados como média ± SEM. A análise estatística foi realizada usando o software GraphPad Prism (versão 6.0). A normalidade dos dados foi analisada pelo teste de Kolmogorov-Smirnov. Os dados paramétricos foram analisados por ANOVA one-way seguido de testes post hoc de Tukey. Os dados não paramétricos foram analisados pelo teste de Kruskal Wallis seguido do teste post hoc de Dunn. As diferenças foram consideradas estatisticamente significativas em P < 0,05.
RESULTADOS E DISCUSSÃO
Conforme descrito por Silva et al. (1), a massa do coração (CO) e do ventrículo esquerdo foram semelhantes entre os grupos HL45 e HL60. Entretanto, ambos foram maiores quando comparados ao grupo C. Somente no grupo HL45 a massa do ventrículo direito (VD) foi maior que no grupo C. O comprimento da tíbia (TB) não apresentou diferença significativa entre os grupos. A relação CO/TB e a relação VE/TB foram semelhantes entre os grupos HL45 e HL60, e ambos maiores quando comparados ao grupo C. Na relação VD/TB somente no grupo HL45 foi maior do que o grupo C (p<0,02) (Tabela 2).
Tabela 2: Massa (g) do coração, ventrículo esquerdo, ventrículo direito, comprimento da tíbia, relação coração/tíbia, ventrículo esquerdo/tíbia, ventrículo direito/tíbia e atividade enzima da creatina quinase fração MB em ratos alimentados com dieta balanceada (Grupo C), Hiperlipídica 45 (Grupo HL45) e Hiperlipídica 60 (Grupo HL60).
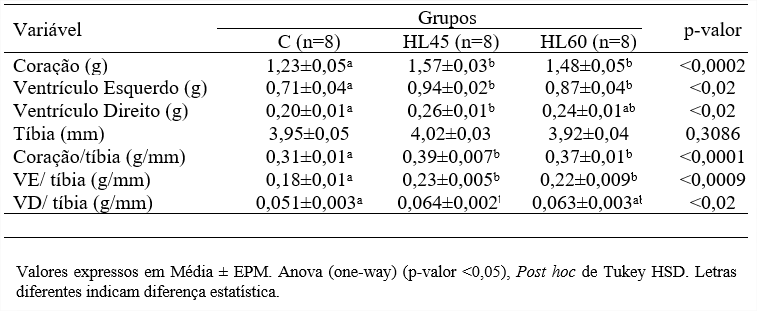
Os dados obtidos mostram que dietas com diferentes níveis de gordura associados à ingestão de frutose, quando administradas em fases iniciais da vida ocasiona danos cardiovasculares em ratos na fase adulta, observados pelo aumento da massa do VE bem como sua relação com a tíbia e aumento da CK-MB sérica (1). A relação CO/TB, LV/TB e VD/TB foi utilizado como marcador de hipertrofia cardíaca, uma vez que o comprimento da tíbia permanece constante mesmo na maturidade. Considerando a hipertrofia cardíaca como um processo de adaptação que depende de diversas vias de sinalização envolvidas no crescimento celular (22; 23) inferimos que as dietas hiperlipídicas associadas à ingestão de frutose, independentemente da proporção de gordura ofertada, induzem a HVE.
A sobrecarga de trabalho cardíaco na obesidade e hipertensão pode levar a alterações morfofuncionais e comprometimento do desempenho do músculo cardíaco com lesão da membrana do cardiomiócito, nessas condições, a liberação de substâncias presentes no interior da célula para o ambiente intersticial, reduzindo seus níveis na corrente sanguínea (24). Foi observado, aumento dos níveis séricos de CK-MB nos grupos Hl45 e HL60, associado ao aumento da relação LV/TB, sugerindo que a HVE nesses animais pode ser, pelo menos em parte, pelo aumento da lesão em nível celular (1).
Os resultados histológicos do VE dos grupos experimentais estão demonstrados na Figura 1. O exame microscópico mostrou estruturas normais do VE de ratos nos grupos HL45 e C em H&E (A, B) e PSR (D, E) manchas. No entanto, no grupo HL60 apresenta um leve processo inflamatório H&E e deposição de colágeno corado por e PSR (I). O processo de deposição de colágeno também foi evidenciado pela colocação de Masson, conforme descrito por Silva et al (1).
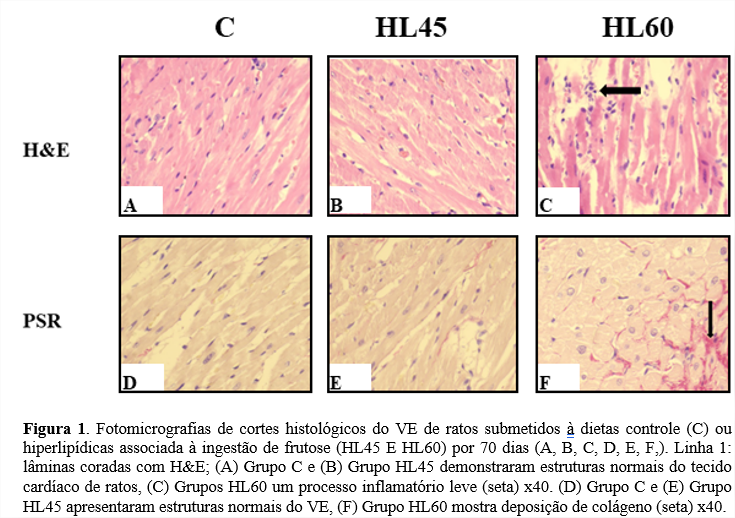
A análise histológica do VE mostrou um leve indício de inflamação e depósito de colágeno no VE dos ratos do grupo HL60. Foi demonstrado que esses animais possuem correlação positiva entre os níveis séricos de leptina e a massa do VE (1). Sendo assim, nossa hipótese é que essa deposição de colágeno seja resultado da alteração da sinalização da leptina nesses animais, uma vez que já foi demonstrado um potencial papel nos níveis de leptina circulante (aumento) no desenvolvimento de fibrose cardíaca em obesos ratos (27). Um estudo recente mostrou que a leptina pode causar essa deposição de colágeno no coração mediada pela proteína lisil oxidase (LOX) e sua inibição pode impedir o aumento da síntese de colágeno induzida pela leptina nas células cardiovasculares, possivelmente por fibrose cardiovascular devido à obesidade (28). Em relação ao grupo HL45 não observamos nenhuma diferença em relação as análises histológicas sendo necessário analisar outros mecanismos que estão atuando para induzir a HVE nesses animais.
O conteúdo das proteínas JNK (3-A) e p-STAT3/STAT3 (Figura 2) não apresentaram diferenças entre os grupos.
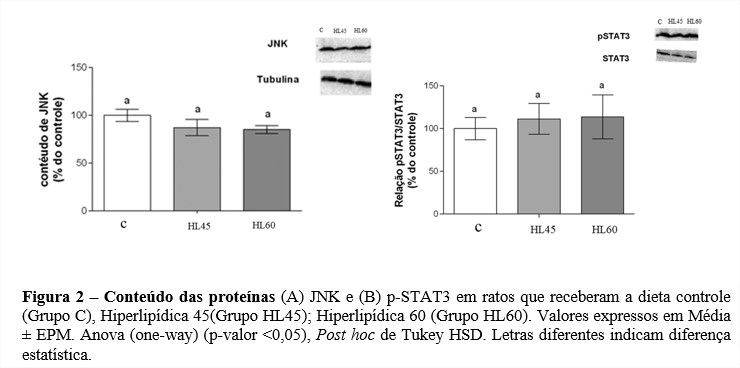
Estudos na literatura já descreveram que a principal via ativada em caso de alteração cardíaca é a via JAK2/STAT3 e JNK (15; 16; 17). Assim, determinamos o conteúdo da proteína p-STAT3 e JNK no VE de ratos. Observamos que não houve alteração no conteúdo dessas proteínas. Entretanto, Silva et al. (1) observaram redução no conteúdo de STAT3 nos grupos HL45 e HL60, quando comparado ao grupo C. Indicando que a sinalização via STAT3 pode estar envolvida com a HVE, mas que outras vias pró e anti-hipertróficas envolvidas no desenvolvimento de danos cardiovasculares devem ser investigadas.
CONCLUSÕES
O consumo precoce da dieta ocidental (rica em gordura associada à ingestão de frutose na bebida) leva à HVE no início da idade adulta.
AGRADECIMENTOS
Este trabalho é dedicado a Nair Honda Kawashita (in memoriam), pela orientação e valioso conhecimento transmitido. Agradecemos também à Bioclin pelo projeto pesquisador.
REFERÊNCIAS
- DA SILVA, F. A.; FREIRE, L. S.; DA ROSA LIMA, T.; SANTOS, S. F.; LEMES, S. A. F.; GAI, B. M. et al. Introduction of the high-fat and very high-fat diets associated with fructose drink in critical development periods causes cardiovascular damage in rats in the beginning of adult life. Nutrition. 2022; p. 1116892022.
- COVIELLO, J. S.; NYSTRÖM, K. V. Obesity and heart failure. Journal of Cardiovascular Nursing. 2003;18(5):360-8.
- HURT, R. T.; KULISEK, C.; BUCHANAN, L. A.; MCCLAVE, S. A. The obesity epidemic: challenges, health initiatives, and implications for gastroenterologists. Gastroenterology & hepatology. 2010;6(12):780.
- MELLS, J. E.; FU, P. P.; SHARMA, S.; OLSON, D.; CHENG, L.; HANDY, J. A. et al. Glp-1 analog, liraglutide, ameliorates hepatic steatosis and cardiac hypertrophy in C57BL/6J mice fed a Western diet. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2011; 302, n. 2, p. G225-G235.
- MILL, J. G.; VASSALLO, D. V. Hipertrofia cardíaca. Rev Bras Hipertens, 2001, 8, n. 1, p. 63-75.
- FRANCHINI, K. Mecanismos moleculares na hipertrofia cardíaca. Hipertensão. 2002; 5, n. 3, p. 112-117.
- WOODIWISS, A. J.; NORTON, G. R. Obesity and left ventricular hypertrophy: the hypertension connection. Current hypertension reports. 2015;17, n. 4, p. 1-9,
- FRIEDEMANN, C.; HENEGHAN, C.; MAHTANI, K.; THOMPSON, M.; PERERA, R.; WARD, A. M. Cardiovascular disease risk in healthy children and its association with body mass index: systematic review and meta-analysis. Bmj. 2012; 345.
- LEIFHEIT-NESTLER, M.; WAGNER, N. M.; GOGIRAJU, R.; DIDIÉ, M.; KONSTANTINIDES, S.; HASENFUSS, G. et al. Importance of leptin signaling and signal transducer and activator of transcription-3 activation in mediating the cardiac hypertrophy associated with obesity. Journal of Translational Medicine. 2013; 11, n. 1, p. 170.
- CHICCO, A. J.; SPARAGNA, G. C.; MCCUNE, S. A.; JOHNSON, C. A.; MURPHY, R. C.; BOLDEN, D. A. et al. Linoleate-rich high-fat diet decreases mortality in hypertensive heart failure rats compared with lard and low-fat diets. Hypertension. 2008; 52, n. 3, p. 549-555.
- ZHANG, Y. B.; MENG, Y. H.; CHANG, S.; ZHANG, R. Y.; CHEN, S. High fructose causes cardiac hypertrophy via mitochondrial signaling pathway. American journal of translational research. 2016; 8, n. 11, p. 4869-4880.
- PARK, J. H.; KU, H. J.; KIM, J. K.; PARK, J. W.; LEE, J. H. Amelioration of High Fructose-Induced Cardiac Hypertrophy by Naringin. Scientific Reports. 2018; 8, n. 1, p. 9464.
- SHIOU, Y.-L.; HUANG, I. C.; LIN, H.-T.; LEE, H.-C. High fat diet aggravates atrial and ventricular remodeling of hypertensive heart disease in aging rats. Journal of the Formosan Medical Association. 2018; 117, n. 7, p. 621-631.
- YIN, F.; SPURGEON, H. A.; RAKUSAN, K.; WEISFELDT, M. L.; LAKATTA, E. G. Use of tibial length to quantify cardiac hypertrophy: application in the aging rat. American Journal of Physiology-Heart and Circulatory Physiology. 1982; 243, n. 6, p. H941-H947.
- MITRA, M. S.; DONTHAMSETTY, S.; WHITE, B.; MEHENDALE, H. M. High fat diet-fed obese rats are highly sensitive to doxorubicin-induced cardiotoxicity. Toxicology and applied pharmacology. 2008; 231, n. 3, p. 413-422.
- CHEN, W. K.; YEH, Y. L.; LIN, Y. M.; LIN, J. Y; TZANG, B. S.; LIN, J. A. et al. Cardiac hypertrophy-related pathways in obesity. Chin J Physiol. 2014; 57, n. 3, p. 111-120.
- PHAN, W. L.; HUANG, Y. T.; MA, M. C. Interleukin-27 protects cardiomyocyte-like H9c2 cells against metabolic syndrome: role of STAT3 signaling. BioMed research international, 2015.
- AIN-93 purified diets for laboratory rodents: Final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76 A rodent diet J Nutr, 123. 1993. pp. 1939-1951.
- MATSUBARA, L. S.; MATSUBARA, B. B.; OKOSHI, M. P.; CICOGNA, A. C.; JANICKI, J. S. Alterations in myocardial collagen content affect rat papillary muscle function. American Journal of Physiology-Heart and Circulatory Physiology. 2000; 279(4):H1534-H9.
- MATSUBARA, L. S., Narikawa, S., Ferreira, A. L. D. A., Paiva, S. A. R. D., Zornoff, L. M., & Matsubara, B. B. Remodelação miocárdica na sobrecarga crônica de pressão ou de volume no coração de ratos. Arquivos Brasileiros de Cardiologia. 2006; v. 86, p. 126-130.
- BRADFORD, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 1976; 72, n. 1-2, p. 248-254.
- BERNARDO, B. C.; WEEKS, K. L.; PRETORIUS, L.; MCMULLEN, J. R. Molecular distinction between physiological and pathological cardiac hypertrophy: experimental findings and therapeutic strategies. Pharmacology & therapeutics. 2010; 128, n. 1, p. 191-227.
- LAZZERONI, D.; RIMOLDI, O.; CAMICI, P. G. From left ventricular hypertrophy to dysfunction and failure. Circulation Journal. 2016; 80, n. 3, p. 555-564.
- EBONG, I. A.; GOFF, J. R. D. C.; RODRIGUEZ, C. J.; CHEN, H.; BERTONI, A. G. Mechanisms of heart failure in obesity. Obesity research & clinical practice. 2014; 8(6):e540-e8.
- DINIZ, Y. S.; BURNEIKO, R. M.; SEIVA, F. R.; ALMEIDA, F. Q; GALHARDI, C. M.; FILHO, J. L. et al. Diet compounds, glycemic index and obesity-related cardiac effects. International Journal of Cardiology. 2008; 124, n. 1, p. 92-99.
- AMIN, K. A.; NAGY, M. A. Effect of Carnitine and herbal mixture extract on obesity induced by high fat diet in rats. Diabetology & metabolic syndrome. 2009; 1, n. 1, p. 1-14, 2009.
- MARTINEZ-ABUNDIS, E.; RAJAPUROHITAM, V.; HAIST, J. V.; GAN, X. T; KARMAZYN, M. The obesity-related peptide leptin sensitizes cardiac mitochondria to calcium-induced permeability transition pore opening and apoptosis. PLoS One. 2012; 7, n. 7, p. e41612.
- MARTÍNEZ-MARTÍNEZ, E.; RODRÍGUEZ, C.; GALÁN, M.; MIANA, M. JURADO-LÓPEZ, R.; BARTOLOMÉ, M. V. et al. The lysyl oxidase inhibitor (β-aminopropionitrile) reduces leptin profibrotic effects and ameliorates cardiovascular remodeling in diet-induced obesity in rats. Journal of molecular and cellular cardiology. 2016; 92, p. 96-104.
- LIMA, T. R.; VOLTARELLI, F.A.; FREIRE, L. S.; SILVA, F. A.; ALMEIDA, P. C.; ÁVILA, E. T. P. et al. High-fat diet and fructose drink introduced after weaning rats, induces a better human obesity model than very high-fat diet, J. Food Biochem. 2021. 45, 1–13.



