
COMPOSTOS FENÓLICOS, BIOATIVOS E POTENCIAL ANTIOXIDANTE DA BIOMASSA MICELIAL DO FUNGO L. theobromae MMPI
Capítulo de livro publicado no livro da III Semana Nacional da Microbiologia de Alimentos na Indústria. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/IIISEMICRO-11
Este trabalho foi escrito por:
Marcelo Luis Kuhn Marchioro *; Gabrielli Aline Pietro Bom Candeia ; Mário Antônio Alves da Cunha
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Biomassas fúngicas são fontes de proteína, lipídios, fibras e carboidratos, além de serem ricas em micro e macronutrientes, compostos fenólicos e substâncias com potencial antioxidante. A produção de biomassa micelial e b-D-glucana extracelular (lasiodiplodana) pelo fungo Lasiodiplodia theobromae MMPI foi estudada como uma plataforma biotecnológica integrada. O presente trabalho buscou avaliar o potencial antioxidante in vitro e o teor de compostos fenólicos presentes nas biomassas miceliais do ascomiceto L. thebromae MMPI produzidas em meios de cultura a base de sacarose comercial e melaço de soja. As biomassas miceliais foram caracterizadas quanto ao teor de fenólicos totais, habilidade antioxidante e compostos bioativos por CLAE-PAD. Os extratos obtidos das biomassas embora contendo baixos conteúdos de fenólicos totais apresentam considerável potencial antioxidante contra os radicais ABTS, DPPH, hidroxila e poder redutor dos íons férrico e molibdênio VI. Ácido gálico e catequina foram os compostos majoritários entre os biocompostos identificados nos extratos. Ácido cinâmico foi identificado em ambos os extratos e ácido p-cumárico no extrato de biomassa produzida em meio com melaço de soja.
Palavras-chave: ascomiceto; bioprocesso; bioprospecção; proteína
Abstract: Fungal biomasses are sources of protein, lipids, fibers, and carbohydrates and are rich in micro and macronutrients, phenolic compounds, and substances with antioxidant potential. Mycelial biomass and extracellular β-D-glucan (lasiodiplodan) production by the fungus Lasiodiplodia theobromae MMPI was studied as an integrated biotechnological platform. The present work aimed to evaluate the in vitro antioxidant potential and the content of phenolic compounds in the mycelial biomass of the ascomycete L. thebromae MMPI cultured in media based on commercial sucrose and soybean molasses. The total phenolic content, antioxidant capacity, and bioactive compounds were characterized in the mycelial biomasses. The extracts obtained from the biomasses, although containing low total phenolics content, presented considerable antioxidant potential against ABTS, DPPH, and hydroxyl radicals, as well as ions reducing powers Ferric and molybdenum VI. Gallic acid and catechin were the major compounds identified in the extracts. Cinnamic acid was identified in both extracts and p-coumaric acid in the biomass extract produced in the medium with soybean molasses.
Keywords: ascomycete; bioprocess; bioprospecting; single-cell-protein
INTRODUÇÃO
Recentemente, com as discussões intensificadas sobre o impacto climático e a escassez de recursos para produção de proteína animal, alguns pesquisadores têm mudado o foco de interesse, voltando-se para a obtenção de novas alternativas com relação a produção de proteínas (1). Há uma demanda crescente por fontes alternativas e sustentáveis de proteínas, como vegetais, insetos e microrganismos, que possam atender às necessidades nutricionais e sensoriais dos consumidores (2).
Embora microrganismos sejam utilizados há séculos pelo homem na produção de alimentos e rações para animais, a tecnologia e a produção em larga escala de proteínas microbianas (Single-Cell Protein – SCP) como alimento foi desenvolvida nos últimos 100 anos, particularmente após a Primeira Guerra mundial. Considerando a grande variedade de microrganismos existentes, estudos visando a condição ideal para a produção de proteína microbiana têm sido conduzidos (3). Estudos reportados na literatura cientifica mostram a produção de biomassa proteica (SCP, proteína de célula única) a partir de fungos filamentosos, empregando tanto processos de fermentação submersa como fermentação semissólida e cultivo em superfície. Desses sistemas de fermentação, o sistema submerso pode levar a maiores rendimentos (4,5).
Diferentes substratos podem ser utilizados como fontes de carbono na produção de proteína microbiana, incluindo resíduos e subprodutos agroindustriais disponíveis em grandes quantidades. Além disso, o processo de produção de proteína microbiana pode ser projetado como um sistema fechado altamente independente de mudanças sazonais, possibilitando o uso eficiente de nutrientes sem escoamento para o ambiente circundante, e o sistema não requer herbicidas ou pesticidas (6).
Neste contexto, biomassas (SCP) do fungo Lasiodiplodia theobromae MMPI obtidas em cultivos submersos com meios a base de sacarose comercial e melaço de soja foram caracterizadas quanto ao conteúdo de fenólicos totais, potencial antioxidante e compostos bioativos por CLAE-PDA.
MATERIAL E MÉTODOS
Extração dos compostos bioativos: Extratos hidroalcoólicos foram obtidos com solução etanólica 80% (v/v). As extrações foram realizadas em frascos Erlenmeyer de 250 mL, empregando a proporção de 1 g de biomassa liofilizada para 10 mL de solução hidroalcoólica, tempo de extração de 1 hora e temperatura de 60 °C em banho ultrassom. Os extratos das biomassas foram filtrados em papel de filtro e empregados nas análises de fenólicos totais, compostos bioativos e atividade antioxidante (7).
Conteúdo fenólicos totais: Os compostos fenólicos totais nos extratos etanólicos foram determinados pelo método de Folin-Ciocalteau, descrito por Singleton, Orthofer e Lamuela-Ravents (8). Um volume de 0,5 mL de extrato etanólico foi transferido para tubos de ensaio contendo 2,5 mL de solução aquosa de Folin-Ciocalteau (1:10, v/v) e após 5 minutos de repouso foram adicionados 2 mL de carbonato de sódio 4% (v/v). Em seguida, os tubos foram mantidos em repouso durante 2 horas, ao abrigo da luz, e realizada leitura em espectrofotômetro a 740 nm. Para o branco substitui-se a amostra por 0.5 mL de água. Os resultados foram calculados com base em uma curva de calibração utilizando ácido gálico nas concentrações de 2,5, 5,0, 10,0, 25,0, 40,0, 70,0, 85,0, 100,0 e 125,0 ppm como padrão de referência. Os resultados foram expressos em mg ácido gálico equivalente.g-1.
Avaliação da atividade antioxidante pelo método DPPH: Em um tubo de ensaio, foram adicionadas as seguintes substâncias: 0,5 mL do extrato de biomassa, 3 mL de etanol e 0,3 mL de solução radical DPPH em etanol (0,5 mmol L-1). A mistura foi mantida ao abrigo da luz à temperatura ambiente durante 45 min. Em seguida, a absorbância da mistura foi medida em um espectrofotômetro a 517 nm. A amostra controle foi preparada com 3,5 mL de etanol: água (80:20 v/v) e 300 µL da solução DPPH (0,5 mmol L-1). A capacidade de eliminação do radical DPPH foi medida por correlação com curva de calibração usando Trolox (ácido 6-hidroxi-2,5,7,8-tetrametilcroman-2-carboxílico) como padrão. Os resultados foram expressos em µmol de equivalentes Trolox por grama (9).
Avaliação da atividade antioxidante pelo método ABTS: O radical ABTS foi obtido a partir da reação de 5 mL de ABTS (7 mmol L-1) com 88 µL de solução de persulfato de potássio (140 mmol L-1), na ausência de luz por 16 horas. A solução do radical ABTS foi diluída em etanol até absorbância de 0,700 a 734 nm. Em um tubo de ensaio, foram adicionados 30 μL de amostra devidamente diluída e 3 mL de solução contendo o radical ABTS. A absorbância foi medida em um espectrofotômetro, a 734 nm após 6 min de reação, e o etanol foi usado como controle em branco. A quantificação foi realizada usando a curva padrão de Trolox e os resultados foram expressos em mmol equivalentes de Trolox por grama (10).
Avaliação da atividade antioxidante pelo método FRAP: O poder redutor do íon férrico foi avaliado segundo Benzie e Strain (11). O reagente FRAP foi obtido a partir de uma mistura de 25 mL de tampão acetato (0,3 mol L-1), 2,5 mL de solução TPTZ (2,4,6-tris (2-piridil)-s-triazina) (10 mmol L-1) e 2,5 mL de solução aquosa de cloreto férrico (20 mmol L-1). Em um tubo de ensaio, foram adicionados 90 µL do extrato de biomassa (200 mg L-1) e 2,7 mL de reagente FRAP. A mistura foi mantida em banho-maria a 37 °C por 30 min e, em seguida, a absorbância foi medida em um espectrofotômetro a 595 nm e o FRAP foi usado como controle em branco. O poder redutor do Fe (III) a Fe (II) foi expressa em mmol FeSO4 por grama.
Sequestro do radical hidroxila: O potencial de sequestro de OH• foi avaliado com base no protocolo descrito por Liu et al. (12). Inicialmente foi obtida uma mistura reacional (2 mL) contendo 0,5 mL de FeSO4 (1,5 mmol L-1), 0,35 mL de H2O2 (6 mmol L-1), 0,15 mL de salicilado de sódio (20 mmol L-1) e 1 mL da amostra em diferentes concentrações (0,10, 0,18 e 0,26 mg mL-1). Como controle positivo foi utilizado ácido ascórbico. Após repouso por 1 hora a 37 °C as leituras de absorbância foram realizadas em espectrofotômetro a 562 nm. As análises foram realizadas em triplicata e o percentual de sequestro do radical hidroxila foi determinado, segundo equação:

Capacidade antioxidante total (CAT): A capacidade antioxidante total foi avaliada utilizando o método de redução do complexo fosfomolibidênio descrito por Sun et al. (13). Foi preparado reagente fosfomolibidênio utilizando ácido sulfúrico 0,6 mol L-1, fosfato de sódio 28 mM e molibdato de amônio 4 mM. Em tubos de ensaio foram adicionados 3 mL do reagente fosfomolibdênio com 0,3 mL de amostra devidamente diluída. Após os tubos foram incubados por 90 min em banho maria a 95 °C. os tubos foram resfriados e realizadas leituras espectrofotométricas a 695 nm. Curva utilizando ácido ascórbico foi construída para quantificar a capacidade antioxidante total.
Análise de compostos bioativos por CLAE-PDA: A análise foi realizada usando um sistema 920 LC (Varian Inc., Walnut Creek, CA, EUA). O software Galaxie foi utilizado para controlar o amostrador automático, configurações de gradiente e aquisição de dados. Uma coluna C18 RP (250 mm x 4,6 mm, 5 µm) (Eclipse Plus, Agilent Technologies, Wilmington, DE, EUA) foi empregue na análise, e mantida a 30 °C. Foram injetados volumes de 10 µL de extratos na concentração de 80 g L-1. A fase móvel foi constituída por uma mistura gradiente de solvente A (solução aquosa de ácido acético a 2%) e solvente B (acetonitrila 40% acidificado com solução aquosa de ácido acético a 2%), com uma vazão de 1 mL.min-1. O gradiente foi iniciado com 5% de solvente B e ajustado para 20% a 2 min; 25% de B aos 15 min; 85% de B aos 25 minutos mantidos por 5 minutos; 20% de B aos 33 min; 5% de B aos 36 min com 8 min de uma etapa de condicionamento. Na análise cromatográfica foram utilizados 16 padrões cromatográficos (ácido gálico, ácido clorogênico, ácido vanílico, ácido cafeico, ácido cumárico, ácido ferúlico, ácido salicílico, ácido cinâmico, catequina, epicatequina, rutina, isoquercitina, astragalina, miricetina, quercetina e canferol) de compostos fenólicos com o objetivo de identificar os principais compostos presentes nos extratos. Os compostos fenólicos foram identificados por comparação dos seus tempos de retenção com o de padrões cromatográficos autênticos e quantificados pela integração dos respectivos picos cromatográficos. Os comprimentos de onda utilizados na detecção dos compostos 280 nm para os ácidos gálico e vanílico, bem como para catequina e epicatequina; 300 nm para os ácidos p-cumárico e salicílico; 320 nm para os ácidos cafeico, cinâmico, clorogênico e ferúlico e 360 nm para astragalina, isoquercitina, quercetina, canferol, miricetina e rutina.
RESULTADOS E DISCUSSÃO
Fenólicos totais e perfil de compostos fenólicos por CLAE-PDA: A presença de compostos fenólicos foi detectada nas biomassas de L. theobromae MMPI produzidas nos meios com melaço de soja (MMS) e sacarose comercial (MSAC). Ambas as biomassas apresentaram quantidades similares de fenólicos totais, expressos em ácido gálico equivalente por grama de biomassa seca (GAE.g-1) e, determinados pelo método Folin-Ciocalteu. As concentrações de fenólicos totais encontradas são relativamente pequenas, principalmente quando comparadas a extratos vegetais, os quais são comumente ricos em compostos fenólicos (14). As quantidades de compostos fenólicos encontradas no presente trabalho foram 4,22 mg GAE.g-1 (biomassa MMS) e 4,14 mg GAE.g-1 (biomassa MSAC). Quantidades superiores foram reportadas em biomassa de Pleurotus ostreatus PBS281009 (35,4 mg GAE.g-1 de biomassa) e P. ostreatus PSI101109 (98,6 mg GAE.g-1 de biomassa) cultivados em meio a base de glicose (15). Importante destacar que valores bastante diferentes de conteúdo de fenólicos em extratos de micélios fúngicos são relatados na literatura científica. Por exemplo, Valu et al., (16) encontraram conteúdos entre 11,1 e 23,1 mg GAE.g-1 de extrato seco do corpo de frutificação do basidiomiceto Hericium erinaceus (cogumelo juba-de-leão).
Em relação ao conteúdo de flavonóides totais quantidades de 3,4 mg QE (quercetina equivalente).g-1 e 3,69 mg QE.g-1 foram encontradas nas biomassas produzidas nos meios MMS e MSAC, respectivamente. Tais resultados são consistentes com os reportados por Valu et al. (16), os quais verificaram valores de 3,26 mg QE.g-1 no cogumelo juba-de-leão. Concentrações de flavonóides entre 0,011 e 1,04 mg QE.g-1 foram reportadas por González-Palma et al. (17) em extratos de Pleorotus ostreatus.
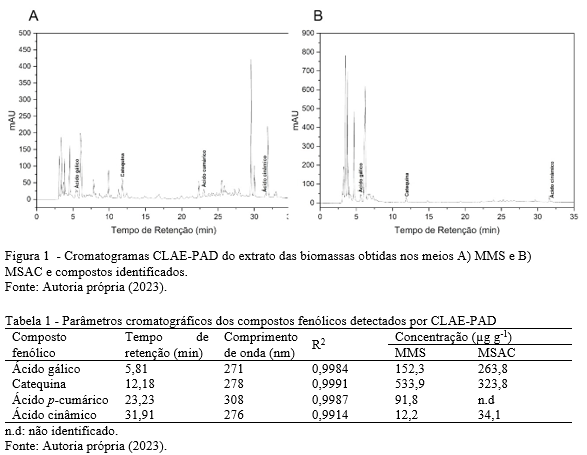
O cromatograma CLAE-PAD descrito na Figura 1 e Tabela 1 revelou a presença de alguns biocompostos nos extratos das biomassas miceliais. No extrato obtido em meio de melaço de soja (Figura 1ª) foi possível identificar os ácidos fenólicos: ácido gálico (152,2 µg g-1), ácido cumárico (91,8 µg g-1) e ácido cinâmico (12,8 µg g-1) e o flavonóide catequina (533,9 µg g-1). Os ácidos gálico (263,8 µg g-1) e cinâmico (34,1 µg g-1) também foram encontrados na biomassa micelial produzida em meio a base de sacarose (Figura 1B) bem como o flavonóide catequina (323,8 µg g-1). O ácido cumárico, por outro lado não foi encontrado na biomassa produzida em meio a base de sacarose. Catequina e ácido gálico foram os compostos majoritários entre os biocompostos identificados nos extratos de biomassa de L. theobromae MMPI. FIjałkowska et al. (18) também verificaram a presença de catequina (58,37 mg / 100 g de extrato) e ácido gálico (0,09 mg / 100 g de extrato) em extratos de micélio do fungo medicinal Fomitopsis ofcinalis.
Estudos demonstram que as catequinas possuem muitos benefícios, como efeitos antioxidante, anticarcinogênico, antiapoptótico, anti-inflamatório, contribui para redução de reações inflamatórias e danos celulares, bem como peroxidação lipídica (19). O ácido gálico (3,4,5-trihydroxybenzoic acid (CAS No.149-91-7)) tem sido reportado como um composto promotor da saúde, incluindo propriedades antioxidantes, anticarcinogênicas, cardioprotetora, anti-inflamatórias e antibacterianas, demonstrando efeitos gastroprotetores e neuroprotetores, podendo inibir a oxidação e rancificação de óleos e gorduras (20,21).
Potencial antioxidante dos extratos das biomassas de L. Theobromae MMPI: Embora os extratos obtidos das biomassas produzidas nos meios MMS e MSAC tenham apresentado concentrações relativamente baixas de compostos fenólicos totais, apreciável capacidade antioxidante foi verificada por ensaios que avaliaram o potencial de captura dos radicais ABTS, DPPH e OH e capacidade de redução do íon férrico e redução do íon molibdênio VI com formação de complexo fosfomolibdênio (CAT).
Todos os extratos miceliais apresentaram efetiva capacidade eliminação dos radicais livres ABTS, DPPH e OH, além de habilidade de redução do íon férrico e do molibdênio VI (Tabela 2).
Os extratos miceliais produzidos em meio MMS (713,9 mM de trolox equivalente (TEq).g-1 de biomassa) e meio MSAC (741,89 mM TEq.g-1) mostraram elevado potencial de eliminação do radical cátion ABTS, não havendo diferenças estatisticamente significativas entre os extratos MMS e MSAC. Em relação ao potencial de eliminação do radical OH e poder redutor do íon férrico o meio de cultivo também não promoveu a produção de micélios com habilidades antioxidantes diferentes. Por outro, a biomassa micelial oriunda do meio formulado com sacarose (187,95 mmol TEq.g-1) demonstrou habilidade de eliminação do radical DPPH um pouco superior à observada no extrato da biomassa obtida em meio com melaço de soja (180,72 mmol TEq.g-1).
A atividade antioxidante total de extratos miceliais pode mostrar variações em relação aos diferentes extratos, processos de extração, meios de cultivo, tempo de fermentação e tipo de cepa (22). Nesse sentido, em relação a atividade antiradicalar contra o radical ABTS, valores entre 25,4 µmol TEq.mg-1 de extrato e 89 µmol TEq.mg-1 de extrato foram encontrados em extratos de biomassa micelial de linhagens de Cladosporium cladospolioides por (23). Estes autores também reportaram atividades entre 23,5 µmol TEq.mg-1 de extrato e 43,4 µmol TEq.mg-1 de extrato nos extratos de micélios de Fusarium sp. e Cladosporium cladospolioides (P.f), respectivamente, contra o radical DPPH. Além disso, o respectivo trabalho mostra variações de concentrações de compostos fenólicos e atividade antiradicalar contra ABTS, DPPH e radical galvinoxil (2,6-Di-terc-butil-α-(3,5-di-terc-butil-4-oxo-2,5-ciclohexadieno-1-ilideno)-p-toliloxi), entre os extratos de micélios e os caldos de cultivos.
A atividade antioxidante total avaliada pela capacidade de redução do íon molibdênio VI e formação do complexo fosfomolibdênio foi bem superior no extrato obtido do micélio produzido em meio MMS (147,72 mmol de ácido ascórbico equivalente.g-1 de biomassa) em relação ao micélio do meio MSAC (84,81 mmol de ácido ascórbico equivalente.g-1 de biomassa). Um maior conteúdo de compostos lipofílicos, possivelmente, pode estar presente no extrato de biomassa produzida no meio MMS, visto que tal biomassa apresenta conteúdos de gordura (Tabela 2) bastante superior ao da biomassa produzida em meio MSAC. Tal condição pode justificar está maior atividade de redução do íon molibdênio VI. O método do complexo fosfomolibdênio é capaz de avaliar o potencial antioxidante de compostos tanto hidrofílicos quanto lipofílicos.
O comportamento de eliminação do radical OH (MMS: 84,56 % e MSAC: 92,1%) bem como o poder redutor do íon férrico (MMS: 244,74 mmol de sulfato ferroso equivalente.g-1 e MSAC: 230,81 mmol de sulfato ferroso equivalente.g-1) foram similares entre os extratos. Outro ponto a ser observado é que a capacidade de eliminação do radical hidroxila foi bastante elevada considerando uma eliminação de 100% de tal radical pelo padrão ácido ascórbico. Da mesma forma foi observado considerável potencial redutor do íon FRAP (MMS: 244,74 mmol de FeSO4 equivalente.g-1 e MSAC: 230,81 mmol de FeSO4 equivalente.g-1). Atividades de 165,5 e 113,9 mmol de FeSO4 equivalente.g-1 foram reportadas em extratos metanólicos de primórdio fresco de Pleorotus ostreatus e em extrato aquoso do corpo de frutificação do fungo, respectivamente (17).

CONCLUSÕES
As biomassas miceliais do fungo L. theobromae MMPI cultivadas nos meios a base de sacarose comercial e melaço de soja não apresentaram elevados conteúdos de fenólicos totais. Por outro lado, os extratos etanólicos obtidos destas biomassas apresentam considerável potencial antioxidante contra os radicais ABTS, DPPH, hidroxila e poder redutor dos íons férrico e molibdênio VI. Ácido gálico e catequina foram os compostos majoritários entre os biocompostos identificados nos extratos. Os resultados sugerem que a SCP do fungo L. theobromae MMPI é rica em compostos bioativos e tem elevado potencial antioxidante, o que a pode tornar um ingrediente atrativo para alimentos e rações.
AGRADECIMENTOS
Os autores agradecem a CAPES (Coordenação Aperfeiçoamento de Pessoal de Nível Superior), a Fundação Araucária (Convênio 282/2022 – NAPI SUDOESTE 3793-1 13539-9).
REFERÊNCIAS
- Aschemann-Witzel J, Peschel AO. Consumer perception of plant-based proteins: The value of source transparency for alternative protein ingredients. Food Hydrocoll [Internet]. 2019 Nov 1 [cited 2020 Feb 13];96:20–8. Available from: https://www.sciencedirect.com/science/article/pii/S0268005X19301055
- Fasolin LH, Pereira RN, Pinheiro AC, Martins JT, Andrade CCP, Ramos OL, et al. Emergent food proteins – Towards sustainability, health and innovation. Food Res Int [Internet]. 2019 Nov 1 [cited 2020 Feb 14];125:108586. Available from: https://www.sciencedirect.com/science/article/pii/S0963996919304648
- Reihani SFS, Khosravi-Darani K. Influencing factors on single-cell protein production by submerged fermentation: A review. Electron J Biotechnol [Internet]. 2019 Jan 1 [cited 2020 Feb 13];37:34–40. Available from: https://www.sciencedirect.com/science/article/pii/S0717345818300484
- Hashempour-Baltork F, Khosravi-Darani K, Hosseini H, Farshi P, Reihani SFS. Mycoproteins as safe meat substitutes. J Clean Prod [Internet]. 2020 Apr 20 [cited 2020 Feb 13];253:119958. Available from: https://www.sciencedirect.com/science/article/pii/S0959652620300056
- Suman G, Nupur M, Anuradha S, Pradeep B. Single Cell Protein Production: A Review. Int J Curr Microbiol Appl Sci [Internet]. 2015 [cited 2020 Feb 18];4(9):251–62. Available from: http://www.ijcmas.com
- Sillman J, Nygren L, Kahiluoto H, Ruuskanen V, Tamminen A, Bajamundi C, et al. Bacterial protein for food and feed generated via renewable energy and direct air capture of CO2: Can it reduce land and water use? Glob Food Sec [Internet]. 2019 Sep 1 [cited 2020 Feb 13];22:25–32. Available from: https://www.sciencedirect.com/science/article/pii/S221191241830141X
- Stoffel F, Santana W de O, Gregolon JGN, Kist TBL, Fontana RC, Camassola M. Production of edible mycoprotein using agroindustrial wastes: Influence on nutritional, chemical and biological properties. Innov Food Sci Emerg Technol [Internet]. 2019 Dec 1 [cited 2020 Feb 13];58:102227. Available from: https://www.sciencedirect.com/science/article/pii/S1466856419306836
- Singleton VL, Orthofer R, Lamuela-Raventós RM. [14] Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. In: Journal of Food, Agriculture and Environment [Internet]. Academic Press; 1999 [cited 2020 Feb 20]. p. 152–78. Available from: https://www.sciencedirect.com/science/article/pii/S0076687999990171
- Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. LWT – Food Sci Technol [Internet]. 1995 Jan 1 [cited 2020 Feb 20];28(1):25–30. Available from: https://www.sciencedirect.com/science/article/pii/S0023643895800085
- Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med [Internet]. 1999 May 1 [cited 2020 Feb 20];26(9–10):1231–7. Available from: https://www.sciencedirect.com/science/article/pii/S0891584998003153?via%3Dihub
- Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the frap assay. Anal Biochem [Internet]. 1996 Jul 15 [cited 2020 Feb 20];239(1):70–6. Available from: https://www.sciencedirect.com/science/article/pii/S0003269796902924
- Liu W, Wang H, Pang X, Yao W, Gao X. Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies of Ganoderma lucidum. Int J Biol Macromol [Internet]. 2010 May 1 [cited 2020 Feb 20];46(4):451–7. Available from: https://www.sciencedirect.com/science/article/pii/S0141813010000565?via%3Dihub
- Sun L, Zhang J, Lu X, Zhang L, Zhang Y. Evaluation to the antioxidant activity of total flavonoids extract from persimmon (Diospyros kaki L.) leaves. Food Chem Toxicol. 2011 Oct 1;49(10):2689–96.
- Iurckevicz G, Dahmer D, Santos VAQ, Vetvicka V, Barbosa-Dekker AM, Dekker RFH, et al. Encapsulated microparticles of (1→6)-β-D-Glucan containing extract of Baccharis dracunculifolia: production and characterization. Molecules [Internet]. 2019 Jun 3 [cited 2022 Feb 20];24(11):2099. Available from: https://www.mdpi.com/1420-3049/24/11/2099/htm
- Vamanu E. Antioxidant properties of mushroom mycelia obtained by batch cultivation and tocopherol content affected by extraction procedures. Biomed Res Int. 2014;2014.
- Valu MV, Soare LC, Sutan NA, Ducu C, Moga S, Hritcu L, et al. Optimization of ultrasonic extraction to obtain erinacine a and polyphenols with antioxidant activity from the fungal biomass of Hericium erinaceus. Foods [Internet]. 2020 Dec 18 [cited 2022 Feb 20];9(12):1889. Available from: https://www.mdpi.com/2304-8158/9/12/1889/htm
- González-Palma I, Escalona-Buendía HB, Ponce-Alquicira E, Téllez-Téllez M, Gupta VK, Díaz-Godínez G, et al. Evaluation of the antioxidant activity of aqueous and methanol extracts of Pleurotus ostreatus in different growth stages. Front Microbiol. 2016 Jul 12;7(JUL):1099.
- Fijałkowska A, Muszyńska B, Sułkowska-Ziaja K, Kała K, Pawlik A, Stefaniuk D, et al. Medicinal potential of mycelium and fruiting bodies of an arboreal mushroom Fomitopsis officinalis in therapy of lifestyle diseases. Sci Reports 2020 101 [Internet]. 2020 Nov 18 [cited 2022 Feb 22];10(1):1–12. Available from: https://www.nature.com/articles/s41598-020-76899-1
- Zhao Y, Fang C, Jin C, Bao Z, Yang G, Jin Y. Catechin from green tea had the potential to decrease the chlorpyrifos induced oxidative stress in larval zebrafish (Danio rerio). Pestic Biochem Physiol. 2021 Dec 28;105028.
- Xu HJ, Zhang QY, Wang LH, Zhang CR, Li Y, Zhang YG. Growth performance, digestibility, blood metabolites, ruminal fermentation, and bacterial communities in response to the inclusion of gallic acid in the starter feed of preweaning dairy calves. J Dairy Sci [Internet]. 2022 Jan [cited 2022 Feb 22];0(0). Available from: http://www.journalofdairyscience.org/article/S0022030222000212/fulltext
- Kahkeshani N, Farzaei F, Fotouhi M, Alavi SS, Bahramsoltani R, Naseri R, et al. Pharmacological effects of gallic acid in health and disease: A mechanistic review. Iran J Basic Med Sci [Internet]. 2019 Mar 1 [cited 2022 Feb 22];22(3):225–37. Available from: https://ijbms.mums.ac.ir/article_12251.html
- Hameed A, Hussain SA, Yang J, Ijaz MU, Liu Q, Suleria HAR, et al. Antioxidants potential of the filamentous fungi (Mucor circinelloides). Nutr 2017, Vol 9, Page 1101 [Internet]. 2017 Oct 7 [cited 2022 Feb 22];9(10):1101. Available from: https://www.mdpi.com/2072-6643/9/10/1101/htm
- Couttolenc A, Medina ME, Trigos Á, Espinoza C. Antioxidant capacity of fungi associated with corals and sponges of the reef system of Veracruz, Mexico. Electron J Biotechnol. 2022 Jan 1;55:40–6.


