
AVALIAÇÃO DAS CARACTERÍSTICAS FÍSICO-QUÍMICAS E DOS COMPOSTOS BIOATIVOS DO AZEITE DE PEQUI (Caryocar brasiliensis Camb.) TERMOXIDADO
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Mara Lina Rodrigues1; Ana Carolina da Silva2; Neuza Jorge3*
1Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências – UNESP.
2Docente do Depto de Engenharia de Alimentos, Instituto de Ciências Tecnológicas e Exatas, Universidade Federal do Triângulo Mineiro – UFTM.
3Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected]
Resumo: O pequi, fruto típico do Cerrado, possui em sua polpa alto teor de lipídios, o que permite obter da polpa desse fruto um azeite de coloração variando entre o alaranjado e o vermelho. Entretanto, pouco se sabe sobre as características e possibilidades de utilização deste azeite. Assim, o objetivo deste trabalho foi avaliar a estabilidade do azeite de pequi comercial (APC) e do azeite de pequi extraído em condições controladas (APECC) sob aquecimento em comparação com a gordura de palma comercial (GPC) e o óleo de soja comercial (OSC). As amostras foram submetidas à termoxidação (180°C/16 horas) e avaliadas fisicoquimicamente e quanto à estabilidade dos seus compostos bioativos. As análises físico-químicas mostraram resultados próximos entre os azeites de pequi e a GPC. A estabilidade oxidativa inicial foi alta e semelhante para azeites de pequi e GPC, mas ao longo do tempo, a estabilidade dos azeites de pequi diminuiu e ao final foi baixa e similar à do OSC. Maiores alterações na cor foram observadas para os azeites de pequi depois de 4 horas de termoxidação. Quanto aos compostos bioativos, tanto os carotenoides quantos os compostos fenólicos dos azeites de pequi foram totalmente degradados com 4 horas de termoxidação. Maiores quantidades de fitosteróis foram encontradas nos azeites de pequi e de tocoferóis no OSC. Pode-se concluir que o azeite de pequi apresenta resistência quando submetido ao aquecimento e tem potencial para ser utilizado como meio de fritura.
Palavras-chave: carotenoides; Caryocar brasiliensis Camb.; termoxidação
INTRODUÇÃO
Cobrindo aproximadamente 22% do território nacional, o Cerrado é o segundo maior bioma brasileiro. Neste bioma o pequizeiro destaca-se entre as várias espécies nativas com potencial econômico frutífero, pois é a planta produtora do pequi, fruto bastante consumido pelos nativos da região há muito tempo (HOGAN; CUNHA; CARMO, 2002; SAWYER, 2002).
Das espécies pertencentes à família Caryocaraceae, o pequizeiro tem relevância por ser a planta produtora do pequi, fruto de secular aproveitamento por suas peculiaridades tão apreciadas de cor, aroma e sabor (ALMEIDA; SILVA, 1994). Muitos estudos têm sido realizados com o objetivo de determinar a composição da polpa de pequi (AZEVEDO-MELEIRO, RODRIGUEZ-AMAYA, 2004; LIMA et al., 2007; MORAIS et al., 2013). Os resultados obtidos nesses estudos vêm comprovando que a composição da polpa do pequi sofre amplas variações, que dependem do clima e do solo, envolvendo ainda fatores como a região de ocorrência da planta e a altitude.
Entre os componentes quantificados na polpa do pequi, os lipídios merecem destaque. Lima et al. (2007) afirmaram que a polpa do pequi é rica em lipídios, com um percentual de 33,4%, enquanto Vera et al. (2007) encontraram para as polpas de pequi um valor médio de 20,02% de lipídios. Porém, devido à falta de recursos para o armazenamento do pequi e de tecnologia para o processo de extração, o rendimento da produção do azeite de pequi é baixo. Para cada 100 dúzias de pirênios são obtidos, aproximadamente, dois litros de azeite pelos agricultores familiares. Além disso, o processo artesanal consome muitas horas de trabalho, levando-se, em média, dez horas para a produção de um litro de azeite de pequi (AQUINO, 2007).
O azeite de pequi possui coloração entre alaranjado e vermelho devido à presença de carotenoides, um grande grupo de pigmentos presentes na natureza com mais de 600 estruturas caracterizadas. Os carotenoides são substâncias que desempenham várias funções nos alimentos e no metabolismo: atuam como corantes naturais, podem possuir atividade provitamina A e apresentam capacidade antioxidante (AZEVEDO-MELEIRO; RODRIGUEZ-AMAYA, 2004; OLIVEIRA et al., 2006; LIMA et al., 2007; ALVES et al., 2008).
Assim, a composição diferenciada do azeite de pequi em relação aos óleos geralmente utilizados para os processos de fritura em imersão, como o óleo de soja e a gordura comercial de palma, desperta interesse, pois a presença dos carotenoides nesse azeite pode impactar nas alterações que ocorrem nos óleos durante o aquecimento. Desta maneira, faz-se necessário investigar o comportamento do azeite de pequi quando submetido ao aquecimento por meio de avaliações físico-químicas. Para realizar uma ampla avaliação do efeito dessa composição diferenciada do azeite de pequi nas alterações que os óleos sofrem durante o aquecimento, a gordura de palma e o óleo de soja foram escolhidos para serem igualmente aquecidos e avaliados, servindo como pontos de comparação.
MATERIAL E MÉTODOS
Material
O azeite de pequi comercial (APC)foi extraído da polpa de forma artesanal, por meio de sucessivas fervuras dos pirênios de pequi seguidas de solidificação com água fria e secagem em chama para eliminação de água residual. Todo o azeite adquirido foi colocado em um recipiente de polietileno com capacidade para 20 L. Em seguida, o APC foi fundido com auxílio de banho-maria a 40 ± 5°C e filtrado empregando-se cinco camadas de tela fina de naylon para a remoção de eventuais resíduos (RODRIGUES et al., 2013). Logo, o APC foi envasado em frascos de vidro âmbar de 1 L, inertizado com nitrogênio gasoso e estocado sob congelamento (-18°C) até o momento do uso.
Para a extração do azeite de pequi extraído em condições controladas (APECC) os frutos foram adquiridos em uma feira da cidade de Catalão, Goiás e transportados até o Laboratório de Processamento de Alimentos do Instituto Federal de Goiás (IFG) Campus Aparecida de Goiânia, Goiás, onde ficaram espalhados nas bancadas durante três dias. Depois desse período, excluiu-se os frutos que apresentavam excesso de injúrias e os que não estavam completamente maduros. Em seguida, os pirênios foram obtidos retirando as cascas dos frutos por meio de corte com faca inox e pressão manual.
Os pirênios foram fervidos em recipiente de alumínio usando chama direta de fogão industrial (Focco, Pagolli, Goiânia, Brasil) durante 5 horas na proporção 1:5 pirênios:água (m/v). Após esse período, o azeite sobrenadante foi retirado e levado à refrigeração (4 ± 2°C) durante 2 horas. Em seguida, o azeite obtido foi aquecido em chama em béquer durante 5 ± 2 minutos para eliminação do excesso de água. O azeite de pequi foi envasado em frascos âmbar e transportado para o Laboratório de Óleos e Gorduras da UNESP de São José do Rio Preto, São Paulo. Fundiu-se o APECC em banho-maria (40 ± 5°C) e este foi filtrado em cinco camadas de nylon para a remoção de eventuais resíduos (RODRIGUES et al., 2013). Em seguida, o APECC foi envasado em frascos de vidro âmbar de 1 L, inertizado com nitrogênio gasoso e estocado sob congelamento (-18°C) até o momento do uso.
A gordura de palma comercial (GPC), embalada em balde de 15 kg com indicação de uso para realização de frituras em estabelecimentos de food service, foi adquirida no comércio local. De acordo com a descrição do rótulo, essa gordura é composta pelo óleo extraído da polpa do fruto da palmeira oleaginosa Elaeis Guineensis por método físicos, sem uso de solventes e submetido a processo de refinação. A GPC depois de homogeneizada foi transferida para frascos de vidro âmbar de 1 L, inertizada com nitrogênio gasoso e estocada sob congelamento (-18°C) até o momento do uso.
O óleo de soja comercial (OSC) em garrafas de 900 mL, tradicionalmente utilizado no Brasil para fritura doméstica de alimentos, foi adquirido no comércio local de São José do Rio Preto, São Paulo. Todo o óleo de soja adquirido foi homogeneizado e, posteriormente, envasado em frascos de vidro âmbar de 1 L, inertizado com nitrogênio gasoso e estocado sob congelamento (-18°C) até o momento do uso.
Ensaio de termoxidação
Para cada amostra (APC, APECC, GPC e OSC), 85 mL de matéria graxa foram colocados em béqueres com capacidade de 250 mL, mantendo uma relação superfície/volume de 0,4/cm (CASAROTTI; JORGE, 2014). As amostras foram mantidas em aquecimento contínuo a 180 ± 5°C em banho termostático com óleo (DF-150/AL, NKS Home, Rio de Janeiro, Brasil) e a temperatura foi monitorada por termômetro (CAMPANELLA et al., 2008).
As amostras foram retiradas nos períodos de tempo 0; 0,5; 1, 2, 4, 8 e 16 horas de aquecimento e transferidas para frascos âmbar, inertizadas com nitrogênio gasoso e acondicionadas à temperatura de -18°C até a realização das análises.
Métodos
As medidas de ácidos graxos livres, índice de peróxidos, ρ-anisidina e dienos conjugados foram determinados segundo métodos da AOCS (2009).
Os compostos polares totais foram determinados por meio da inserção do sensor do instrumento Testo 270 (Campinas, São Paulo, Brasil) nas amostras dos óleos previamente aquecidas a 90 ± 5°C (OSAWA; GONÇALVES; MENDES, 2012). O sensor foi previamente calibrado com óleo fornecido pelo fabricante do instrumento antes da análise das amostras. Entre as medições, o equipamento foi limpo com água morna, detergente neutro e adequadamente seco.
O índice de estabilidade oxidativa foi medido conforme método Cd 12b-92 proposto pela AOCS (2009) utilizando o Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland) por meio da determinação da condutividade elétrica dos produtos voláteis de degradação. A determinação foi realizada a 110ºC, com fluxo de ar de 20 L/h, utilização de 3 g de amostra e volume de água destilada de 60 mL nos frascos contendo os eletrodos. Uma curva de condutividade elétrica x tempo foi automaticamente registrada ao decorrer da reação e do teste. O período de indução derivado desta curva foi determinado em horas.
A avaliação instrumental da cor das amostras foi feita em colorímetro (ColorFlex EZ 45/0, Hunterlab, Virginia, Estados Unidos) conectado a um computador provido de software (Universal Versão 4.10, Hunterlab, Virginia, Estados Unidos) (NYAM; LAU, 2015). A calibração foi feita previamente usando as coordenadas de uma placa preta e depois de uma placa branca. As amostras foram colocadas em cubeta de quartzo com cavidade circular e para cálculo das coordenadas de cor foram estabelecidos o iluminante D65, o ângulo de 10° para o observador e a escala do sistema de cor CIE Lab. As coordenadas medidas foram L*, que representa a luminosidade numa escala de 0 (preto) a 100 (branco); a*, que representa uma escala de tonalidades de -a (esverdeado) a +a (avermelhado) e b*, que representa uma escala de -b (azulado) a +b (amarelado).
O perfil de ácidos graxos foi determinado por cromatografia gasosa a partir das amostras transesterificadas com hidróxido de potássio metanólico em n-hexano, segundo método Ce 2-66 da AOCS (2009). Foi utilizado um cromatógrafo gasoso (GC 3900, Varian Inc., Walnut Creek, Estados Unidos) equipado com detector de ionização de chama, sistema de injeção split de aproximadamente 1:30 e amostrador automático. Os compostos foram separados em coluna capilar de sílica fundida CP-Sil 88 de 60 m, com diâmetro interno de 0,25 mm e espessura de filme de 0,20 μm. A temperatura inicial da coluna foi de 90°C (durante 4 minutos) e programada para alcançar 195°C com incremento de 10°C/min, sendo, então, mantida em isoterma por 16 minutos. A temperatura do injetor foi de 230ºC e a do detector de 250°C. As amostras foram injetadas no volume de 1 μL, adotando-se a razão de divisão de 1:30. O gás de arraste foi o hidrogênio com velocidade linear de 30 mL/min. Os ácidos graxos foram identificados pela comparação dos tempos de retenção de padrões puros de ésteres metílicos de ácidos graxos com os componentes separados das amostras e a quantificação foi feita por normalização de área (%), utilizando-se como padrão uma mistura composta de cinco ácidos graxos (C16:0, C18:0, C18:1, C18:2, C18:3) (Supelco, Bellefonte, Estados Unidos) com pureza entre 99,1 e 99,9%.
Os carotenoides totais foram determinados por espectrofotometria segundo Lin, Sue e Ain (1995) apud Pawlowicz et al. (2013) e MPOB Test Method (2005) apud Mustapa et al. (2011). As amostras (0,1 a 1 ± 0,01 g) foram diluídas em 10 mL de hexano até obtenção de leitura que obedecesse a lei de Lambert-Beer (absorvância entre 0,2 e 0,8) e lidas em espectrofotômetro (modelo Uv-Vis mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão) a 446 nm. O cálculo do teor de carotenoides totais foi feito considerando-se o volume de diluição das amostras e o coeficiente de extinção para os carotenoides (383), cujos resultados foram expressos em mg de β-caroteno/kg de amostra.
Os compostos fenólicos totais foram determinados seguindo a metodologia proposta por Kalantzakis et al. (2006) com algumas adaptações. Para a obtenção do extrato, 2,50 g da amostra foi dissolvida com 5 mL de n-hexano e 5 mL de metanol 60%. Essa mistura foi agitada em vórtex por 2 minutos e, em seguida, centrifugada a 3.500 rpm durante 10 minutos. O sobrenadante (fase apolar) foi descartado e a fase polar foi transferida para um balão volumétrico e o volume completado com água para 5 mL. Uma alíquota de 2,75 mL foi transferida para um tubo âmbar, adicionou-se 2,25 mL de água e agitou-se em vórtex por 30 segundos. Em seguida adicionou-se 0,5 mL do reagente Folin-Ciocalteu, agitou-se em vórtex por 30 segundos e deixou-se em repouso durante 3 minutos. Foi adicionado 1 mL da solução saturada de carbonato de sódio seguido de agitação em vórtex por 30 segundos. Colocou-se 3,5 mL de água e agitou-se por 30 segundos. Por último deixou-se em repouso durante 30 minutos. As leituras foram feitas em espectrofotômetro (modelo Uv-Vis mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão) a 765 nm usando água como branco. Para calcular os compostos fenólicos totais das amostras foi construída uma curva padrão com ácido gálico com concentrações variando entre 0,50 e 3 µg/mL. A equação da reta gerada foi y = 0,247x + 0,042 e o coeficiente de determinação foi (R2) 0,9985. Os resultados foram expressos em mg de ácido gálico/kg de amostra.
Os fitosteróis foram determinados por cromatografia gasosa a partir da matéria insaponificável. A preparação da amostra foi feita conforme metodologia proposta por Duchateau et al. (2002). A determinação dos fitosteróis nas amostras foi feita de acordo com método Ch 6-91 (AOCS 2009) utilizado cromatógrafo gasoso (Plus-2010, Shimadzu, Toquio, Japão) equipado com detector de ionização de chama, sistema de injeção split e coluna capilar de sílica fundida (Restek RTX 5, Shimadzu, Toquio, Japão) com 30 m, 0,25 μm de espessura de filme e 0,25 μm de diâmetro interno. A temperatura inicial do forno foi de 300°C por 12 minutos, a temperatura do injetor foi de 280°C e a do detector de 320°C. O gás de arraste foi o hidrogênio com velocidade linear de 40 mL/min e amostra foi injetada em 1 µL na razão de 1:50. Os isômeros campesterol, estigmasterol, β-sitosterol e estigmastanol foram identificados por comparação com o tempo de retenção dos padrões puros (Supelco, Bellefonte, Estados Unidos) analisados sob as mesmas condições da amostra. E a quantificação foi realizada padronização interna (5α-cholestano-3β-ol grau de pureza de 95% em terc-butil-metil-éter, na concentração de 3 mg/mL) baseada na área de cada pico. Os teores de fitosteróis foram expressos em mg/100 g e os limites de detecção foram: campesterol ≤ 5,20 mg/100 g; estigmasterol ≤ 5,60 mg/100 g; estigmastanol ≤ 4,25 mg/100 g e brassicasterol ≤ 2,70 mg/100 g.
Os tocoferóis foram analisados por cromatografia líquida de alta eficiência segundo método Ce 8-89 AOCS (2009). Foi utilizado um cromatógrafo (210-263, Varian, Walnut Creek, Estados Unidos) equipado com detector de fluorescência e injetor manual. Na preparação foram pesadas 0,40 g de amostra posteriormente diluídas em 10 mL de n-hexano. Foi utilizada coluna de sílica de 250 x 4,60 mm com poro de 100 Å e tamanho de partícula 5 µm (Microsorb 100-5 Si, Varian, Walnut Creek, Estados Unidos). O fluxo isocrático foi de 1,20 mL/min, o comprimento de onda de excitação em 290 nm, de emissão em 330 nm e como fase móvel, a mistura de 99,50% de n-hexano e 0,50% de isopropanol. Foram injetadas amostras de 20 µL. Os isômeros α-, β-, γ- e δ-tocoferol foram quantificados por comparação com o tempo de retenção dos padrões de tocoferóis (Supelco, Bellefonte, Estados Unidos) sob as mesmas condições de operação. A quantificação foi baseada em padronização externa e os resultados expressos em mg/kg. Os limites de detecção foram α ≤ 3,15 mg/kg, β ≤ 1,10 mg/kg, γ ≤ 8,65 mg/kg e δ ≤ 2,30 mg/kg. A quantidade de vitamina E foi calculada utilizando fatores de conversão para cada isômero, e foi expressa em UI/kg.
Análise estatística
Foram realizadas análises de variância (ANOVA) e teste de Tukey (ao nível de 5% de probabilidade) utilizando o Software R.
RESULTADOS E DISCUSSÃO
Propriedades físico-químicas Óleos brutos, em geral, possuem teores de ácidos graxos livres elevados até passarem pelo processo de refino, quando estes são reduzidos. O Codex Alimentarius Commission (2009) estabelece para óleos brutos o limite de até 2,0% de ácidos graxos livres expressos em ácido oleico. Assim, tanto o APC quanto o APECC apresentaram no tempo 0 teores de ácidos graxos livres dentro desse limite (Figura 1a).
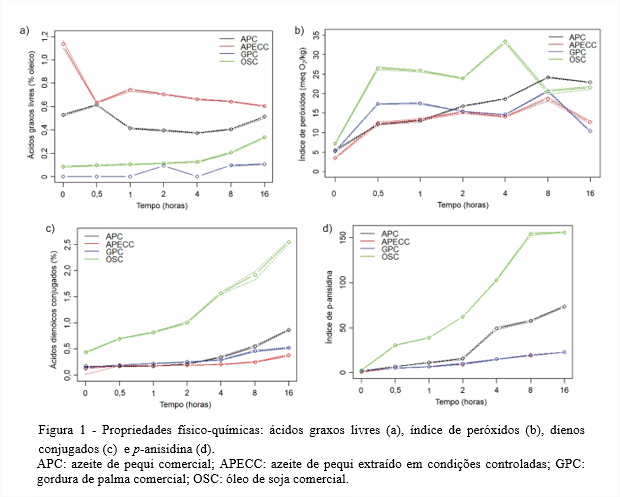
Já, para os óleos refinados, a Resolução ANVISA RDC nº 270 de 22 de setembro de 2005 (ANVISA, 2005) e o Codex Alimentarius Commission (2009) estabelecem limite de 0,3% em ácido oleico e, nesse caso, tanto a GPC quanto o OSC também estão dentro do limite estabelecido.
No azeite de pequi, os pirênios estão protegidos pelo exocarpo e mesocarpo externo (casca e polpa branca, respectivamente). Os pirênios praticamente não sofrem com injúrias na colheita e armazenamento, o que pode explicar os baixos teores de ácidos graxos livres do azeite de pequi quando comparado com outros óleos brutos. Já, a GPC e OSC passam pela etapa de refinação no processo de produção e isso justifica menores teores de ácidos graxos livres no tempo 0, pois uma das funções da refinação é eliminar ácidos graxos livres dos óleos.
Mimura et al. (2016) avaliaram o teor de ácidos graxos livres de quatro amostras de azeite de pequi usando sistema de eletroforese capilar, sendo duas delas de azeite de pequi bruto. Para esses azeites os autores encontraram 4,18 e 2,14% de ácidos graxos livres. Esses resultados superaram os teores de ácidos graxos livres obtidos para o APC e o APECC no tempo 0 neste estudo.
Depois de submetidos ao aquecimento, pode-se observar que o teor de ácidos graxos livres do OSC aumentou durante todo o período de aquecimento, enquanto o teor de ácidos graxos livres dos demais óleos sofreu variações. O aumento no teor de ácidos graxos livres ao longo do período de aquecimento pode ser explicado pelas reações de oxidação e hidrólise sofridas pelos triacilgliceróis. Nos tempos em que houve redução ou que não ocorreu considerável formação de ácidos graxos livres devido à oxidação ou hidrólise induzida pelo calor, essa redução provavelmente decorreu da volatilização desses ácidos graxos durante o aquecimento, bloqueando funções ácidas (NDJOUENKEU; NGASSOUM, 2002).
No tempo 0, tanto o APC quanto o APECC mostraram índices de peróxidos dentro do limite estabelecido para óleos brutos, que é de 15 meq O2/kg, tanto pela legislação brasileira (ANVISA, 2005) quanto pelo Codex Alimentarius Commission (2009), conforme Figura 1b. Essas mesmas legislações estabelecem para os óleos refinados limite de 10 meq O2/kg e, assim, a GPC e OSC também se encontram dentro do limite estabelecido.
Przybylski et al. (1995), assim como neste estudo, encontraram variação no índice de peróxidos ao estudar oleína de palma duplamente fracionada, submetida a aquecimento em temperatura de fritura (180°C/60 h), quando observaram que o índice de peróxidos aumentou até 16 horas de aquecimento, diminuindo em seguida até 44 horas e estabilizando depois até 60 horas de aquecimento.
O índice de peróxidos obtido neste experimento ao final das 16 horas de aquecimento para os azeites de pequi é semelhante ao obtido para os demais óleos estudados, indicando que mesmo sem passar pelo processo de refinação como os outros óleos, o azeite de pequi foi bastante resistente à formação dos peróxidos no processo de termoxidação.
Todos os óleos submetidos à termoxidação, neste estudo, apresentaram aumento no teor de ácidos dienóicos conjugados ao longo do aquecimento, conforme Figura 1c. Pode-se destacar o aumento observado para o OSC, que foi bastante superior ao dos demais óleos. Esse aumento é devido aos ácidos graxos poli-insaturados encontrados em grande quantidade no OSC, o que não acontece nos demais óleos estudados (KIM et al., 2013).
Luzia e Jorge (2009) ao estudarem a ação antioxidante do extrato de sementes de limão, TBHQ e misturas desses antioxidantes adicionados ao óleo de soja submetido à termoxidação (180 ± 5°C), encontraram ao final de 15 horas de aquecimento teor de ácidos dienóicos conjugados para o óleo de soja de 2,19%, valor semelhante ao obtido nesse estudo ao final de 16 horas (2,6%). Os demais óleos estudados por essas autoras mesmo adicionados de antioxidantes formaram mais ácidos dienóicos conjugados que o APC e o APECC avaliados neste estudo.
Assim, pode-se observar que há grande formação de ácidos dienóicos conjugados nas amostras de OSC, uma vez que este contém grande quantidade de ácidos graxos poli-insaturados. O APC, APECC e a GPC, por terem menores quantidades de ácidos graxos poli-insaturados apresentam maior resistência à formação dos ácidos dienóicos conjugados, minimizando as alterações primárias da oxidação lipídica.
A análise de p-anisidina revelou que no tempo 0, todos os óleos estudados apresentavam valores bastante baixos e que no decorrer da termoxidação todos os óleos tiveram aumento nesse índice como observado na Figura 1d. O aumento observado é explicado pela baixa estabilidade dos produtos primários de oxidação em altas temperaturas, que se decompõem e formam produtos secundários de oxidação, incluindo aldeídos e cetonas (MALHEIRO et al., 2013).
De acordo com os resultados obtidos, o APC e o APECC foram mais resistentes e tiveram ao final das 16 horas índices de p-anisidina bastante inferiores aos alcançados pela GPC e pelo OSC. Na legislação brasileira não há limites legais para o índice de p-anisidina para óleos brutos. Para óleos refinados há uma indicação de que índices abaixo de 10 permitem considerar esses óleos como de boa qualidade (HAMILTON et al., 1983).
No aquecimento do azeite de oliva (180°C/20 h), Labrinea, Thomaidis e Georgiou (2001) obtiveram índices de p-anisidina de aproximadamente 90 e 140 para os tempos 10 e 20 horas, respectivamente, valores muito superiores aos obtidos para APC e APECC ao final das 16 horas de aquecimento.
Assim, o índice de p-anisidina obtido para o azeite de pequi termoxidado está compatível com dados encontrados na literatura, ficando inclusive abaixo dos valores obtidos para alguns óleos tradicionalmente utilizados em procedimentos de fritura.
De acordo com a Figura 2a, todas as amostras apresentaram aumento no teor de compostos polares totais ao longo da termoxidação a 180°C por 16 horas. Esse aumento é esperado, uma vez que a exposição dos óleos a altas temperaturas e prolongados períodos provoca degradação e decomposição dos triacilgliceróis formando compostos polares (CUVELIER; LACOSTE; COURTOIS, 2012).
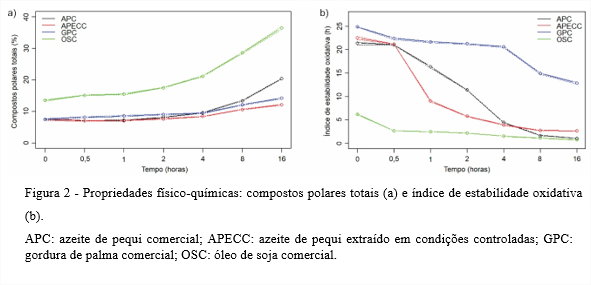
Não há parâmetros determinados pela ANVISA ou pelo Codex Alimentarius quanto a compostos polares totais para óleos ou gorduras vegetais (OSAWA; GONÇALVES; MENDES, 2010).
Estudando as diferenças na repetibilidade entre experimentos de fritura e termoxidação, Machado et al. (2007) termoxidaram óleos de palma, soja e soja hidrogenada a 180°C durante 25 horas e encontraram 14,20; 38,50 e 15,40%, respectivamente, de compostos polares totais. O OSC avaliado neste estudo foi mais sensível à formação dos compostos polares totais e com 16 horas de aquecimento já apresentava valor semelhante ao obtido em 25 horas de aquecimento no trabalho citado.
Assim, ao longo das 16 horas de aquecimento, o APC e o APECC se mantiveram com teores de compostos polares totais dentro do limite médio internacionalmente de 25% estabelecido para esses compostos.
Todos os óleos avaliados apresentaram redução da estabilidade oxidativa ao longo da termoxidação, como mostra a Figura 2b. Nos tempos 0 e 0,5 hora, os azeites de pequi tiveram comportamento similar à GPC. Os óleos brutos, como no caso do azeite de pequi, em geral, possuem elevados valores de estabilidade oxidativa, uma vez que os antioxidantes naturalmente presentes nesses óleos não foram eliminados pelo processo de refinação. Já os óleos refinados possuem menor estabilidade oxidativa, uma vez que o processo de refinação remove a maior parte dos seus antioxidantes (TRIPOLI et al., 2005; FARHOOSH; EINAFSHAR; SHARAYEI, 2009).
A partir de 0,5 hora de termoxidação, a estabilidade oxidativa dos azeites de pequi começou a se distanciar da estabilidade oxidativa da GPC. Essa diminuição nos azeites pode estar relacionada com a redução do teor de carotenoides. Com 0,5 hora de aquecimento, mais da metade do teor de carotenoides dos azeites de pequi foram degradados (Figura 4a). Assim, à medida que o efeito antioxidante dos carotenoides foi reduzido, consequentemente houve diminuição na estabilidade oxidativa dos azeites de pequi. Estudos de Gertz, Klostermann e Kochhar (2000) mostraram que os óleos brutos têm maior estabilidade a elevadas temperaturas do que os óleos refinados mostrando, assim, que a estabilidade dos lipídios em temperaturas de fritura é depende de múltiplos fatores além da composição em ácidos graxos.
Dentre os óleos avaliados neste estudo, a GPC apresentou ao longo da termoxidação aproximadamente 50% de diminuição na estabilidade oxidativa, enquanto nesse mesmo período a redução da estabilidade oxidativa dos azeites de pequi foi de cerca de 90%. A maior resistência da estabilidade oxidativa da GPC pode estar associada ao seu perfil de ácidos graxos, onde predominam os saturados, reconhecidamente mais resistentes às alterações provocadas pelo aquecimento (O’BRIEN, 2010).
Como pode ser observado nas Figuras 3a e 3b, a cor amarelada de APC e APECC, respectivamente, permaneceram até duas horas. Depois desse período, as coordenadas de cor passaram para o quadrante esverdeado. A perda da coloração amarelada desses azeites está diretamente relacionada com a degradação dos carotenoides, que são pigmentos termo sensíveis e que foram degradados ao longo do aquecimento a 180°C (Figura 4a) (RODRIGUEZ-AMAYA; RODRIGUEZ; AMAYA-FARFAN, 2006).
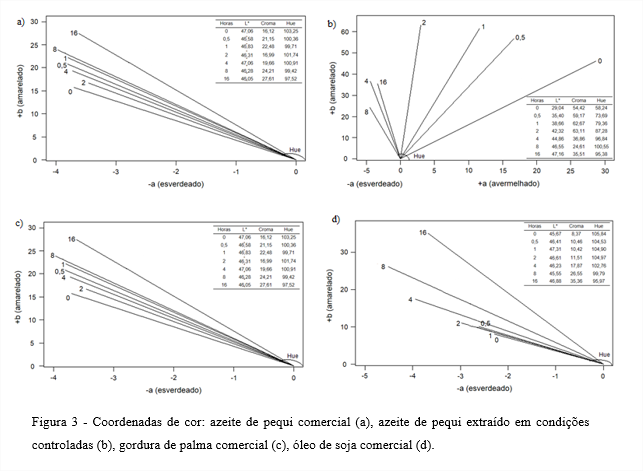
Com a degradação dos carotenoides e diminuição da cor amarelada do APC e APECC, pode-se verificar também aumento da luminosidade desses óleos entre os tempos 0 e 16 horas de termoxidação.
Nas Figuras 3c e 3d observam-se as alterações de cor sofridas pela GPC e pelo OSC. As coordenadas mostram que em ambos os óleos houve escurecimento entre o tempo 0 e 16 horas de termoxidação, ao mesmo tempo em que houve pequena diminuição de luminosidade.
O escurecimento de óleos submetidos a elevadas temperaturas está relacionado aos fosfolipídios que possuem em sua molécula ácidos graxos insaturados. As carbonilas conjugadas são os principais produtos oxidados para reações de escurecimento, de forma similar ao que acontece na reação de Maillard entre a carbonila do açúcar e os aminoácidos (HUSAIN; TERAO; MATSUSHITA, 1986).
As propriedades químicas e físicas dos óleos e gorduras são amplamente determinadas pelos ácidos graxos que os formam e pela posição dos ácidos graxos na molécula de triacilglicerol. Estatisticamente, todos os óleos avaliados diferem em cada um dos ácidos graxos estudados (p < 0,05), enquanto os diferentes tempos de aquecimento não influenciaram no percentual de cada um dos ácidos graxos (p > 0,05) (Tabelas 1 e 2).
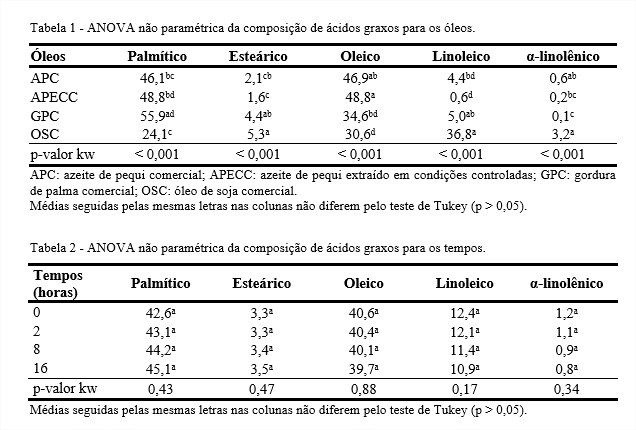
De maneira geral, a composição de ácidos graxos do APC e do APECC apresentou quantidades próximas de ácidos graxos saturados e insaturados, enquanto a GPC apresentou maiores quantidades de ácidos graxos saturados e o OSC apresentou maiores quantidades de ácidos graxos insaturados. As diferenças na composição de ácidos graxos dos óleos estudados têm implicações diretas, tanto nas questões relacionadas à resistência dos óleos quanto a efeitos na saúde (CLARK; SERBIA, 1991; BRADLEY; MIN, 1992; EUNJOO, 1994; ST. ANGELO, 1996; ZAMBIAZI; ZAMBIAZI, 2000).
No perfil de ácidos graxos do azeite de pequi extraído por Soxhlet, a maior parte dos ácidos graxos dos azeites obtidos dos pirênios de diferentes genótipos foram oleico e palmítico, variando entre 48,6-65,9% e 24,3-46,3%, respectivamente (FARIA-MACHADO et al., 2015). Assim como nesse trabalho, esses também foram os ácidos graxos encontrados em maior quantidade nos azeites de pequi avaliados.
Compostos bioativos
A cor amarelo-alaranjada do azeite de pequi indica a presença de carotenoides neste azeite. No tempo 0 (azeite de pequi in natura), os teores de carotenoides totais foram 260,2 mg/kg para o APC e 283,8 mg/kg para o APECC, Figura 4a. Já o OSC e a GPC passaram por processos de refinação, em que um dos objetivos é eliminar pigmentos (PRZYBYLSKI et al., 2005). Assim, para o OSC no tempo 0 obteve-se apenas 2,4 mg β-caroteno/kg e a GPC não apresentou carotenoides.
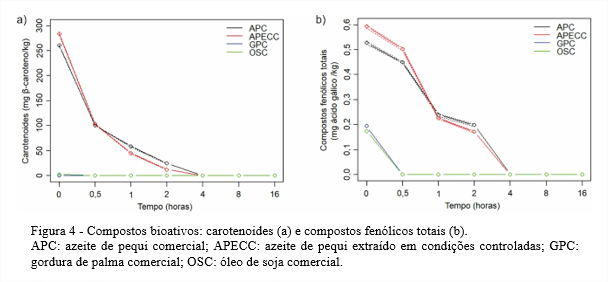
Nos estudos de Rodrigues et al. (2013), o teor de carotenoides do azeite de pequi no tempo 0 foi de aproximadamente 160 µg/g e, ao final de uma hora de termoxidação, praticamente o total de carotenoides já havia sido degradado. Assim, os carotenoides dos azeites de pequi avaliados neste estudo, além de estarem presentes em maior quantidade foram mais resistentes permanecendo até 4 horas de termoxidação.
Dessa maneira, em 0,5 hora de aquecimento a 180°C, mais de metade dos carotenoides do APC e do APECC já haviam sido degradados, enquanto os carotenoides do OSC foram totalmente degradados nesse mesmo período. Para o APC e o APECC, os carotenoides foram totalmente degradados até quatro horas de aquecimento, quando não foram mais detectados.
A degradação (isomerização e/ou oxidação) dos carotenoides dos azeites de pequi, pode, por outro lado, ter minimizado outras alterações comuns aos lipídios durante o processo de aquecimento, como aumento acentuado de ácidos graxos livres, peróxidos, p-anisidina, ácidos dienóicos conjugados e compostos polares totais, devido a sua ação antioxidante, evidenciada em diversos estudos (WOODALL et al., 1997; DIMAKOU; OREOPOULOU, 2012; SMYK, 2015). Consequentemente houve modificação na cor do APC e do APECC e diminuição das funções biológicas.
O óleo da polpa de jerivá, um fruto típico do Cerrado brasileiro, apresenta 1219 µg/g de carotenoides totais, quantidade 20 vezes superior ao encontrado na polpa do fruto. O maior conteúdo de carotenoide no óleo deve-se ao caráter apolar destes compostos (JORGE; SILVA; VERONEZI, 2021).
A determinação dos compostos fenólicos totais apresentou valores mais elevados para os azeites de pequi do que para a GPC e o OSC, que apresentaram valores semelhantes e bastante baixos mesmo no tempo 0, Figura 4b. Esses baixos valores são justificados pelo processo de refinação pelo qual passam tanto a GPC quanto o OSC. Na etapa de extração, o tipo de solvente utilizado influencia na obtenção dos compostos fenólicos totais, pois sua polaridade interfere na quantidade de compostos fenólicos extraídos. Em seguida, na etapa de neutralização, onde se aplica a lavagem, os compostos fenólicos presentes no óleo extraído, que são muito polares, se dissolvem na água utilizada nesta etapa para remoção dos sabões, levando à sua redução (FARHOOSH; EINAFSHAR; SHARAYEI, 2009; SZYDŁOWSKA-CZERNIAK et al., 2011). Devido à baixa quantidade de compostos fenólicos totais na GPC e no OSC, depois de 30 minutos de termoxidação, a totalidade dos fenólicos já havia sido degradada.
A quantidade de compostos fenólicos no azeite de pequi pode ser considerada baixa quando comparada com a de outros óleos – apesar dessa quantidade variar, dependendo de diversos fatores – como o azeite de oliva, óleos de linhaça e de açaí, dentre outros. Essa baixa quantidade de compostos fenólicos do azeite de pequi pode estar associada ao método de extração utilizado na sua obtenção, que utiliza água em temperatura elevada. Grande parte dos compostos fenólicos são hidrofílicos e podem, assim, ter migrado para água utilizada na fervura (GOLDSMITH et al., 2014). Uma outra parte, ainda que pequena, dos compostos fenólicos totais dos azeites de pequi, pode ter sido perdida devido à exposição contínua dos pirênios e do azeite de pequi a temperaturas em torno de 100°C no processo de fervura para extração do azeite (PALMA; PIÑEIRO; BARROSO, 2001).
Os azeites de pequi apresentaram valores de tocoferóis totais estatisticamente iguais aos do OSC. Por outro lado, o tempo não influenciou os isômeros de tocoferóis (Tabelas 3 e 4).
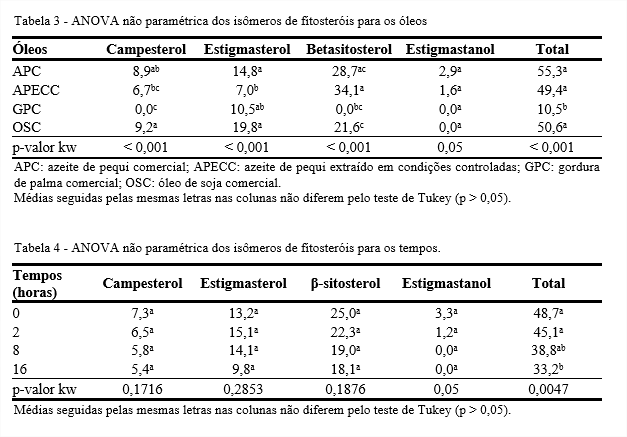
Os fitosteróis de plantas são sensíveis quando aquecidos a 180°C, devido a reações oxidativas e termolíticas durante as quais uma grande variedade de produtos de oxidação são formados. No óleo de colza termoxidado a 180°C, Lampi et al. (2002) identificaram teor de fitosteróis totais de 893 mg/100 g e os três isômeros encontrados em maior quantidade foram sitosterol, campesterol e brassicasterol, com 416, 314 e 88 mg/100 g, respectivamente. Depois de 24 horas de aquecimento, os autores obtiveram valor maior para o sistosterol (646 µg/g) do que do campesterol (452 µg/g). Os produtos de oxidação do brassicasterol não puderam ser identificados como os dos demais isômeros por cromatografia gasosa com espectrômetro de massa.
Os tocoferóis são constituídos quimicamente por um núcleo básico (cromanol) formado por dois anéis (um fenólico e um heterocíclico) que são ligados a uma cadeia lateral isoprenoide alifática. De acordo com o número e a posição dos substituintes metila ligados às posições 5, 7 e 8 do anel aromático, formam-se isômeros distintos, denominados α-, β-, γ- e δ-tocoferol (SAINI; KEUM, 2016).
Em nenhum dos óleos foi identificado o isômero β-tocol e no APECC nenhum dos isômeros de tocoferol foram identificados (Tabelas 5 e 6). No tempo 0, o APC apresentou aproximadamente 87 mg/kg de tocoferóis totais, enquanto no APECC não havia tocoferóis.
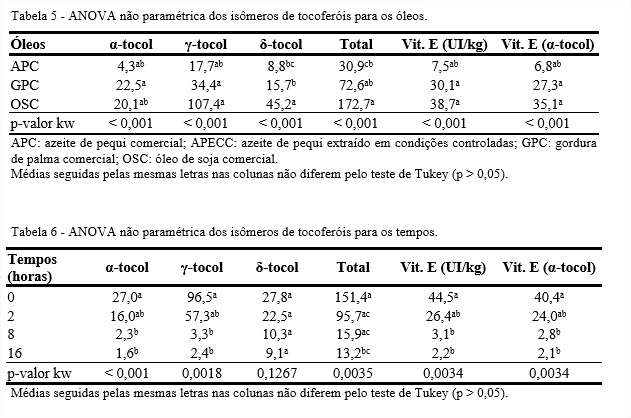
Essa diferença na quantidade de tocoferóis dos azeites de pequi pode estar relacionada com o teor de carotenoides. Tanto os carotenoides quanto os tocoferóis são biosintetizados a partir de um precursor comum, o geranilgeranil-pirofosfato. Quando há ação da enzima fitoeno sintase ocorre a formação de carotenoides e se há atuação da enzima geranilgeranil redutase associada à dioxigenase hidroxifenilpiruvato ocorre a formação dos tocoferóis. Como o APECC apresentou maior teor de carotenoides que o APC, pode-se inferir que o precursor comum foi totalmente utilizado para a formação dos carotenoides, ficando, assim, indisponíveis para formar os tocoferóis, ao contrário do APC, onde os precursores não foram totalmente transformados em carotenoides e, assim, puderam ser transformados em tocoferóis (KOCH; GOLDMAN, 2005).
No início do processo, a GPC apresentou 146,1 mg/kg de tocoferóis totais e ao final da termoxidação essa quantidade foi reduzida para 22,1 mg/kg de tocoferóis, o que representa uma perda de 85%. Trata-se de uma gordura derivada do óleo de palma bruto que passou por refinação. O óleo de palma bruto possui entre 600 e 1.000 mg/kg de tocoferóis (LAI; TAN; AKOH, 2012), mas o processo de refinação reduz seus teores de tocoferóis. A refinação química por ser realizada em temperatura mais baixa e em menor período de tempo, degrada menos os tocoferóis que a refinação física, principalmente se houver contato com ar (CHONG, 2012; DUNFORD, 2012).
A redução dos tocoferóis ao longo da termoxidação pode ainda estar relacionada às funções antioxidantes, pró antioxidantes e de eliminação de radicais que estes compostos possuem. O isômero α-tocoferol funciona como antioxidante (doador de átomo de hidrogênio) quebrando a cadeia do lipídio, interceptando os radicais peroxila durante a oxidação lipídica (ROO•) (SAINI, KEUM, 2016).
CONCLUSÕES
Os resultados obtidos para os óleos submetidos ao ensaio de termoxidação mostraram características físico-químicas dos azeites de pequi semelhantes às da GPC ao longo do aquecimento. O OSC apresentou os maiores aumentos nos índices analisados quando comparado com os demais óleos. A estabilidade oxidativa inicial dos azeites de pequi foi alta e semelhante à GPC, mas durante a termoxidação diminuiu e ao final foi baixa e semelhante à do OSC. Alterações de cor foram observadas em todos os óleos. Depois de 4 horas, as coordenadas de cor dos azeites de pequi passaram do quadrante amarelado para o esverdeado.
Apesar da grande quantidade de carotenoides dos azeites de pequi no tempo inicial, depois de 4 horas de termoxidação foram totalmente degradados. Os azeites de pequi foram os que apresentaram as maiores quantidades de fitosteróis. O OSC foi o que apresentou as maiores quantidades de tocoferóis.
Diante dos resultados obtidos nas análises físico-químicas e de compostos bioativos para as amostras aquecidas, pode-se concluir que o azeite de pequi tem potencial para ser utilizado como meio de fritura.
AGRADECIMENTOS
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa produtividade em pesquisa.
REFERÊNCIAS
ALMEIDA, S. P.; SILVA, J. A. Pequi e buriti: importância alimentar para a população dos cerrados. Planaltina: EMBRAPA – CPAC, 1994. 38p.
ALVES, C. C. O.; RESENDE, J. V.; CRUVINEL, R. S. R.; PRADO, M. E. T. Estabilidade da microestrutura e do teor de carotenoides de pós obtidos da polpa de pequi (Caryocar brasiliense Camb.) liofilizada. Ciência e Tecnologia de Alimentos, Campinas, v. 28, n. 4, p. 830-839, 2008.
ANVISA. Agência Nacional de Vigilância Sanitária. Resolução nº 270, de 22 de setembro de 2005. Regulamento técnico de identidade e qualidade de óleos vegetais, gorduras vegetais e creme vegetal, Brasília, DF, ANVISA, 2005.
AOCS. AMERICAN OIL CHEMISTS’ SOCIETY. Oficial Methods and Recommended Practices of the American Oil Chemists’ Society. 6 ed. Champaign: AOCS, 2009.
AQUINO, L. P. Extração do óleo da polpa de pequi (Caryocar brasiliense): influência das variáveis operacionais. 2007. 95 f. Dissertação (Mestrado em Ciência de Alimentos) – Departamento de Ciência dos Alimentos, Universidade Federal de Lavras, Lavras, 2007.
AZEVEDO-MELEIRO, C. H.; RODRIGUEZ-AMAYA, D. B. Confirmation of the identify of the carotenoids of tropical fruits by HPLC-DAD and HPLC-MS. Journal of Food Composition and Analysis, San Diego, v. 17, n. 3-4, p. 385-396, 2004.
BRADLEY, D. G; MIN, D. B. Singlet oxygen oxidation of foods. Critical Review Food Science and Nutrition, London, v. 31, n. 3, p. 211-236, 1992.
CAMPANELLA, L.; NUCCILLI, A.; TOMASSETTI, M.; VECCHIO, S. Biosensor analysis for the kinetic study of polyphenols deterioration during the forced thermal oxidation of extra-virgin olive oil. Talanta, London, v. 74, n. 5, p.1287-1298, 2008.
CASAROTTI, S. N.; JORGE, N. Antioxidant activity of rosermary extract in soybean oil under thermoxidation. Journal of Food Processing and Preservation, Westport, v. 38, n. 1, p. 136-145, 2014.
CHONG, C. L. Measurement and maintenance of palm oil quality. In: Palm oil –production, processing, characterization, and uses. Urbana: AOCS Press, 2012. P. 431-470.
CLARK, W. L.; SERBIA, G. W. Safety aspects of frying fats and oils. Food Technology, Chicago, v. 45, n. 2, p. 84-89, 1991.
CODEX. CODEX ALIMENTARIUM COMMISSION. Codex Stan 210-1999: codex standard for named vegetable oils. Rome, 2009.
CUVELIER, M.; LACOSTE, F.; COURTOIS, F. Application of a DSC model for evaluation of TPC in termo-oxidized oil. Food Control, Guildford, v. 28, n. 2, p. 441- 444, 2012.
DIMAKOU, C.; OREOPOULOU, V. Antioxidant activity of carotenoids against the oxidative destabilization of sunflower oil-in-water emulsions. LWT – Food Science and Technology, London, v. 46, n. 2, p. 393-400, 2012.
DUCHATEAU, G. S. M. J. E; BAUER-PLANK, C. G.; LOUTER, A. J. H.; HAM, M.; BOERMA, M.; ROOIJEN, J. J. M.; ZANDBELT, P. A. Fast and accurate method for total 4-desmethy sterol’s, content in spreads, fat-blends and raw materials. Journal of the American Oil Chemists’ Society, Chicago, v. 79, n. 3, p. 273-278, 2002.
DUNFORD, N. T. Advancements in oil and oilseed processing. In: NURHAN T. DUNFORD (Ed.). Food and industrial bioproducts and bioprocessing. Iowa: John Wiley and Sons Inc, 2012. p. 115-143.
EUNJOO, H. K. Linoleic acid hydroperoxide induced peroxidation of endotelial cell phospholipids and cutotoxicity. Free Radical Biology & Medicine, New York, v. 17, n. 4, p. 285-295, 1994.
FARHOOSH, R.; EINAFSHAR, S.; SHARAYEI, P. The effect of commercial refining steps on the rancidity measures of soybean and canola oils. Food Chemistry, London, v. 115, n. 3, p. 933-938, 2009.
FARIA-MACHADO, A. F.; TRES, A.; RUTH, S. M.; ANTONIASSI; R. JUNQUEIRA, N. T. V.; LOPES, P. S. N.; BIZZO, H. R. Discrimination of pulp oil and kernel oil from pequi (Caryocar brasiliense) by fatty acid methyl esters fingerprinting, using GC-FID and multivariate analysis. Journal of Agricultural and Food Chemistry, Easton, v. 63, n. 45, p. 10064-10069, 2015.
GERTZ, C.; KLOSTERMANN, S.; KOCHHAR, S. P. Testing and comparing oxidative stability of vegetable oils and fats at frying temperature. European Journal of Lipid Science and Technology, Weinheim, v. 102, n. 8-9, p. 543-551, 2000.
GOLDSMITH, C. D.; STATHOPOULOS, C. E.; GOLDING, J. B.; ROACH, P. D. Fate of the phenolic compounds during olive oil production with the traditional press method. International Food Research Journal, Selangor, v. 21, n. 1, p. 101-109, 2014.
HAMILTON, R. J.; ROSSELL, J. B.; HUDSON, B. J. F.; LÖLIGER, J.; In: ALLEN, J. C.; HAMILTON, R. J. Rancidity in foods. Applied Science Publishers LTD: London, 1983, p. 1.
HOGAN, D. J.; CUNHA, J. M. C.; CARMO, R. L. Uso do solo e mudança de sua cobertura no centro-oeste do Brasil: consequências demográficas, sociais e ambientais. In: HOGAN, D. J.; CARMO, R. L.; CUNHA, J. M. P.; BAENINGER, R. (org.). Migração e ambiente no centro-oeste. Campinas: NEPO/UNICAMP- PRONEX, 2002, p. 149-174.
HUSAIN, S. R.; TERAO, J.; MATSUSHITA, S. Effect of browning reaction products of phospholipids on autoxidation of methyl linoleate. Journal of the American Oil Chemists’ Society, Chicago, v. 63, n. 11, p. 1457-1460, 1986.
JORGE, N.; SILVA, A. C.; VERONEZI, C. M. Syagrus romanzoffiana. In: LIMA, F. F.; LESCANO, C. H.; OLIVEIRA, I. P. (org.). Fruits of the Brazilian Cerrado: composition and functional benefits. Gewerbestrasse: Srpinger Nature, 2021, p. 141-159.
KALANTZAKIS, G.; BLEKAS, G.; PEGKLIDOU, K.; BOSKOU, D. Stability and radical-scavenging activity of heated olive oil and other vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, n. 4, p. 329-335, 2006.
KIM, T. S.; YEO, J.; KIM, J. Y.; KIM, M.; LEE, J. Determination of the degree of oxidation in highly-oxidised lipids using profile changes of fatty acids. Food Chemistry, London, v. 138, n. 2-3, p. 1792-1799, 2013.
KOCH, T. C.; GOLDMAN, I. L. Relationship of carotenoids and tocopherols in a sample of carrot root-color accessions and carrot germplasm carrying Rp and Rp alleles. Journal of Agricultural and Food Chemistry, Easton, v. 53, n. 2, p. 325-331, 2005.
LABRINEA, E. P.; THOMAIDIS, N. S.; GEORGIOU, C. A. Direct olive oil anisidine value determination by flow injection. Analytica Chimica Acta, Amsterdan, v. 448, n. 1-2, p. 201-206, 2001.
LAI, O. M.; TAN, C. P.; AKOH, C. C. Palm oil – production, processing, characterization, and uses. Urbana: AOCS Press, 2012. 852p.
LAMPI, A.; JUNTUNEN, L.; TOIVO, J.; PIIRONEN, V. Determination of thermo-oxidation products of plant sterols. Journal of Chromatography B, Amsterdan, v. 777, n. 1-2, p. 83-92, 2002.
LIMA, A.; SILVA, A. M. O.; TRINDADE, R. A.; TORRES, R. P.; MANCINI-FILHO, J. Composição química e compostos bioativos presentes na polpa e na amêndoa do pequi (Caryocar brasiliense, Camb.). Revista Brasileira de Fruticultura, Jaboticabal, v. 29, n. 3, p. 695-698, 2007.
LUZIA, D. M. M.; JORGE, N. Ação antioxidante do extrato de sementes de limão (Citrus limon) adicionado ao óleo de soja sob processo de termoxidação. Revista do Instituto Adolfo Lutz, São Paulo, v. 68, n. 1, p. 58-63, 2009.
MACHADO, E. R.; MARMESAT, S.; ABRANTES, S.; DOBARGANES, C. Uncontrolled variables in frying studies: differences in repeatability between thermoxidation and frying experiments. Grasas y aceites, Sevilla, v. 58, n. 3, p. 283-288, 2007.
MALHEIRO, R.; RODRIGUES, N.; MANZKE, G.; BENTO, A.; PEREIRA, J. A.; CASAL, S. The use of olive leaves and tea extracts as effective antioxidants against the oxidation of soybean oil under microwave heating. Industrial Crops and Products, Amsterdan, v. 44, p. 37-43, 2013.
MIMURA, A. M. S.; FAZA, L. P.; MARQUES, R.; LE HYARIC, M.; OLIVEIRA, M. A. L.; SILVA, J. C. J. Determination of Cu, Fe, Mn, Zn and free fatty acids in pequi oil. Química Nova, São Paulo, v. 39, n. 5, p. 621-626, 2016.
MORAIS, M. L.; SILVA, A. C. R.; ARAÚJO, C. R. R.; ESTEVES, E. A.; DESSIMONI-PINTO, N. A. V. Determinação do potencial antioxidante in vitro de frutos do cerrado brasileiro. Revista Brasileira de Fruticultura, Jaboticabal, v. 35, n. 2, p. 355-360, 2013.
MUSTAPA, A. N.; MANAN, Z. A.; AZIZI, C. Y.; SETIANTO, W. B.; OMAR, A. K. Extraction of β-carotenes from palm oil mesocarp using sub-critical R134a. Food Chemistry, London, v. 125, n. 1, p. 262-267, 2011.
NDJOUENKEU, A. R.; NGASSOUM, B. M. Etude comparative de la valeur en friture de quelques huiles vegetales (Comparative study of frying behaviour of some vegetable oils). Journal of Food Engineering, Essex, v. 52, n. 2, p. 121-125, 2002.
NYAM, K. L.; LAU, H. W. Effects of microwave pre-treatment on the quality of kenaf (hibiscus cannabinus l.) seed oil. Journal of Food Science and Engineering, Valley Cottage, v. 5, n. 1, p. 14-21, 2015.
O’BRIEN, R. D. Fats and oils: formulating and processing for applications. 3 ed. Boca Raton: CRC Press, 2010, 680 p.
OLIVEIRA, M. N. S.; GUSMÃO, E.; LOPES, P. S. N.; SIMÕES, M. O. M.; RIBEIRO, L. M.; DIAS, B. A. S. Estádio de maturação dos frutos e fatores relacionados aos aspectos nutritivos e de textura da polpa de pequi (Caryocar Brasiliense Camb.). Revista Brasileira de Fruticultura, Jaboticabal,v. 28, n. 3, p. 380-386, 2006.
OSAWA, C. C.; GONÇALVES, L. A. G.; MENDES, F. M. Avaliação dos óleos e gorduras de fritura de estabelecimentos comerciais da cidade de Campinas/SP. As Boas Práticas estão sendo atendidas? Alimentos e Nutrição, Araraquara, v. 21, n. 1, p. 47-55, 2010.
PALMA, M.; PIÑEIRO, Z.; BARROSO, C. G. Stability of phenolic compounds during extraction with superheated solvents. Journal of Chromatography A, Amsterdan, v. 921, n. 2, p. 169-174, 2001.
PAWLOWICZ, R.; GROMADZKA, J.; TYNEK, M.; TYLINGO, R.; WARDENCKI, W.; KARLOVITS, G. The influence of the UV irradiation on degradation of virgin rapseed oils. European Journal of Lipid Science and Technology, Weinheim, v. 115, n. 6, p. 648-658. 2013.
PRZYBYLSKI, R.; MAG, T.; ESKIN, N. A. M.; McDONALD, B. E. Canola oil. In: SHAHIDI, F. Bailey’s industrial oil and fat products. 6. ed. Wiley: Hoboken, 2005. v. 2. Cap. 2, p. 61-122.
PRZYBYLSKI, R.; MAG, T.; ESKIN, N. A. M.; McDONALD, B. E. Canola Oil. In: RADY, A. H.; MADKOUR, M. A. Changes in physical and chemical properties of palm olein during heating. Grasas y Aceites, Sevilla, v. 46, n. 4-5, p. 270-275, 1995.
RODRIGUES, M. L.; SOUZA, A. R. M.; LIMA, J. C. R. de; MOURA, C. J.; GERALDINE, R. M. Cinética de degradação de carotenoides e da alteração de cor do azeite de pequi submetido ao aquecimento em temperatura de fritura. Ciência Rural, Santa Maria, v. 43, n. 8, p. 1509-1515, 2013.
RODRIGUEZ-AMAYA, D. B.; RODRIGUEZ, E. B.; AMAYA-FARFAN, J. Advances in food carotenoid research: chemical and technological aspects, implications in human health. Malaysia Journal of Nutrition, Selangor, v. 12, n. 1, p. 101-121, 2006.
SAINI, R. K.; KEUM, Y. Tocopherols and tocotrienols in plants and their products: a review on methods of extraction, chromatographic separation, and detection. Food Research International, Barking, v. 82, p. 59-70, 2016.
SAWYER, D. População, meio ambiente e desenvolvimento sustentável no cerrado. In: HOGAN, D. J.; CARMO, R. L.; CUNHA, J. M. P.; BAENINGER, R. (org.). Migração e ambiente no centro-oeste. Campinas: NEPO/UNICAMP-PRONEX, 2002, p. 279-299.
SHAHIDI, F. Bailey’s industrial oil and fat products. 6. ed. Wiley: Hoboken, 2005. v. 2. Cap. 2, p. 61-122.
SMYK, B. Singlet oxygen autoxidation of vegetable oils: Evidences for lack of synergy between b-carotene and tocopherols. Food Chemistry, London, v. 182, p. 209-216, 2015.
ST. ANGELO, A. J. Lipid oxidation in foods. Critical Reviews in Food Science and Nutrition, Boca Raton, v. 36, n. 3, p. 175-224, 1996.
SZYDŁOWSKA-CZERNIAK, A.; TROKOWSKI, K.; KARLOVITS, G.; SZŁYK, E. Effect of refining processes on antioxidant capacity, total contents of phenolics and carotenoids in palm oils. Food Chemistry, London, v. 129, n. 3, p. 1187-1192, 2011.
TRIPOLI, E.; GIAMMANCO, M.; TABACCHI, G.; DI MAJO, D.; GIAMMANCO, S.; LA GUARDIA, M. The phenolic compounds of olive oil: structure, biological activity and beneficial effects on human health. Nutrition Research Reviews, Cambridge, v. 18, n. 1, p. 98-112, 2005.
VERA, R.; SOUZA, E. R. B.; FERNANDES, E. P.; NAVES, R. V.; SOARES JR., M. S.; CALIARI, M.; XIMENES, P. A. Caracterização física e química de frutos do pequizeiro (Caryocar brasiliense Camb.) oriundos de duas regiões no estado de Goiás, Brasil. Pesquisa Agropecuária Tropical, Goiânia, v. 37, n. 2, p. 93-99, 2007.
WOODALL, A. A.; LEE, S. W. M.; WEESIE, R. J.; JACKSON, M. J.; BRITTON, G. Oxidation of carotenoids by free radicals: relationship between structure and reactivity. Biochimica et Biophysica Acta (BBA) – General Subects, Amsterdan, v. 1336, n. 1, p. 33-42, 1997.
ZAMBIAZI, R. Z.; ZAMBIAZI, M. W. Vegetable oil oxidation: effect of endogenous componentes. Revista da Sociedade Brasileira de Ciência e Tecnologia de Alimentos, Campinas, v. 34, n. 1, p. 22-32, 2000.
