
FARINHA DE SEMENTE DE ABÓBORA NA ALIMENTAÇÃO DE GALINHAS EM FASE DE POSTURA
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-36
Este trabalho foi escrito por:
Édina de Fátima Aguiar1 *; Talitha Kássia Alves dos Santos Dessimoni2 ; Joashllenny Alves de Oliveira3 ; Amauri Felipe Evangelista4 ; Yasmim Gonçalves Lacerda2 ; Valéria Quintana Cavicchioli5 ; André Gomes Faria2
1 Docente do Programa de Pós-Graduação em Ciência Animal. Universidade José do Rosário Vellano – UNIFENAS, Brasil; * E-mail: [email protected].
2 Discente do Programa de Pós-Graduação em Ciência Animal. Universidade José do Rosário Vellano – UNIFENAS, Brasil;
3 Pós-Graduação em Zootecnia. Universidade Federal de Viçosa – UFV, Brasil.
4 Pós-Graduação em Zootecnia. Universidade Federal do Paraná – UFPR, Brasil.
5 Docente do Curso de Medicina Veterinária. Universidade Federal de Goiás – UFG, Brasil.
Resumo: A avicultura de postura é uma importante atividade agropecuária no Brasil visto que o ovo de galinha é um alimento rico em proteínas de alto valor biológico e baixo custo. As indústrias de alimentos que processam a abóbora para a produção de doces, compotas e alimentos pré-preparados descartam cascas, fiapos e sementes. Estudos científicos relatam que 3,32% do peso de uma abóbora correspondem às suas sementes, representando um considerável desperdício. A farinha de semente da abóbora (FSA) apresenta 36% são ácidos graxos (AG) essenciais, em especial o w3, teor proteico de 30% e de fibras gira em torno de 22 a 32% além de baixos teores de fatores antinutricionais. Portanto, o objetivo deste estudo foi avaliar os efeitos do uso da FSA na dieta de galinhas em fase de postura sobre o desempenho produtivo das aves e a qualidade dos ovos. Foram utilizadas 160 aves poedeiras da linhagem Hisex Brown vermelha, com 33 semanas de idade, em delineamento inteiramente casualizado, com quatro tratamentos e cinco repetições. Os tratamentos corresponderam a uma ração controle e mais três rações contendo níveis crescentes de inclusão (20, 40 e 60g de FSA/kg de ração). A FSA foi incorporada nas rações em substituição ao óleo de soja e farelo de soja. Concluiu-se que a ração com acréscimos de FSA não alterou a qualidade dos ovos, havendo valor significativo para presença de ácido graxo docosahexaenóico (DHA) em especial no acréscimo de 40 g/kg ração onde apresentou maior produção de ovos.
Palavras–chave: alimento alternativo; Cucurbita maxima; Cucurbita mochata; aves de postura; produção de ovos
Abstract: Poultry farming is an important agricultural activity in Brazil since the hen’s egg is a food rich in proteins of high biological value and low cost. Food industries that process pumpkin for the production of jams, jams and pre-prepared foods discard husks, lint and seeds. Scientific studies report that 3.32% of the weight of a pumpkin correspond to its seeds, representing a considerable waste. Pumpkin seed flour (PSF) has 36% essential fatty acids (FA), especially w3, protein content of 30% and fiber content is around 22 to 32%, in addition to low levels of anti-nutritional factors. Therefore, the objective of this study was to evaluate the effects of the use of PSF in the diet of laying hens on the productive performance of the birds and the quality of the eggs. 160 laying hens of the red Hisex Brown lineage, with 33 weeks of age, were used in a completely randomized design, with four treatments and five replications. The treatments corresponded to a control diet and three diets containing increasing levels of inclusion (20, 40 and 60g of PSF /kg of diet). PSF was incorporated into the diets to replace soybean oil and soybean meal. It was concluded that the diet with additions of PSF did not change the quality of the eggs, with a significant value for the presence of docosahexaenoic acid (DHA) fatty acid, especially in the addition of 40 g/kg ration, which showed higher egg production.
Key word: alternative food; Cucurbita maxima; Cucurbita mochata; egg production; laying hen’s
INTRODUÇÃO
A avicultura de postura é uma importante atividade agropecuária no Brasil, pois o ovo de galinha é um alimento rico em proteínas de alto valor biológico e de baixo custo quando comparado com outras fontes proteicas de origem animal. Segundo os últimos dados publicados pela Associação Brasileira de Proteína Animal [1], cada brasileiro consome em média 192 ovos/ano. Porém, espera-se que tal índice se eleve nos próximos anos em função de pesquisas recentes que desmistificam a atuação do ovo como um “vilão da alimentação” e devido ao maior conhecimento da população sobre as propriedades nutricionais do ovo [2]. Portanto, dada a importância do ovo no cenário agropecuário brasileiro, há uma constante demanda por pesquisas que buscam melhorar sua qualidade a partir de melhorias promovidas na alimentação das galinhas.
Em se tratando de investimentos na produção, aproximadamente 70% de todo o custo é referente à alimentação do plantel [3]. Sendo assim, a utilização de subprodutos da indústria de alimentos tem se mostrado uma importante estratégia para diminuir o custo com a alimentação das aves e para reduzir o impacto ambiental que pode ser gerado pelo inadequado descarte desses subprodutos na natureza. As abóboras Cucurbita maxima e mochata, popularmente conhecidas como moranga e abóbora de pescoço pertencem à família Cucurbitaceae, sendo a espécie cultivada no Brasil desde longa data [4]. Atualmente há grande desperdício de sementes desses frutos pelas indústrias produtoras de doces de abóbora. Tais sementes apresentam elevado potencial para serem utilizadas na nutrição de galinhas poedeiras, devido seu alto teor nutritivo e baixo índice de compostos de ação antinutricional [5] [6] [7]. Todavia, o conhecimento que se tem até o presente momento sobre o uso da farinha da semente de abóbora na dieta de galinhas é escasso [8] [9].
Sendo assim, um experimento foi conduzido para se avaliar os efeitos do uso da farinha de sementes de abóbora (FSA) na dieta de galinhas em fase de postura sobre o desempenho produtivo das aves e a qualidade dos ovos.
MATERIAL E MÉTODOS
Procedimentos experimentais: As sementes de abóbora Cucurbita maxima e Cucurbita mochata foram fornecidas por uma indústria localizada em Poços de Caldas, Minas Gerais. As sementes foram retiradas dos frutos e transportadas em caixas térmicas até o Laboratório de Análise de Alimentos da UNIFENAS (Campus em Alfenas) onde foram pré-secas em estufa de circulação de ar a 40°C durante 24 H (horas) [7]. Posteriormente, as sementes foram moídas para a produção da Farinha de Semente de Abóbora (FSA).
A FSA teve sua caracterização química nutricional e antinutricional determinada, em triplicata de acordo com os métodos de análise da Association of Official Analytical Chemistry [10]: (i) para composição centesimal da FSA, o teor de umidade foi determinado pelo aquecimento em estufa a 105°C até massa constante; (ii) o método de Kjeldahl foi usado para dosar a proteína bruta (PB) na FSA, sendo o fator de correção 5,4 [11] aplicado aos dados para converter o nitrogênio total da amostra em nitrogênio proteico; (iii) o teor de fibra alimentar (FA) total e o nível de extrato etéreo (EE) foi quantificado por método/processo gravimétrico-enzimático, enquanto que a análise de cinzas consistiu na incineração da FSA a 550°C, determinando-se a porcentagem do resíduo.
Os polifenóis foram extraídos da FSA em condensador de refluxo com metanol a 50%, por três vezes consecutivas, usando chapa aquecedora a 80°C. Os extratos obtidos foram reunidos, evaporados até o volume de 25 mL e submetidos à dosagem colorimétrica (λ = 760 nm) com o uso do reagente de Folin-Denis (composto por tungstato de sódio, ácido fosfomolíbdico e ácido fosfórico). O ácido tânico foi usado como padrão [12]. A extração dos glicosídeos cianogênicos da FSA foi feita sob agitação horizontal por 15 min (minutos), em temperatura ambiente, utilizando-se solução de ácido clorídrico 0,1 mol.L–1. O extrato obtido teve o pH ajustado para 6,0 e foi centrifugado a 2000 × g/15 min [13] apud [14]. Ao sobrenadante recolhido foi acrescentada a enzima linamarase obtida de folhas de mandioca conforme metodologia em literatura [14]. Em seguida, a mistura foi encubada a 30°C por 1 H e, após esse período, a solução de ácido pícrico saturado/carbonato de sódio foi adicionada. Após repouso de 10 min, adicionou-se água à mistura e os tubos foram submetidos ao banho-maria em ebulição por 12 min, sendo o teor de cianeto medido colorimetricamente em λ = 530 nm. O cianeto de potássio foi usado como padrão [15].
As saponinas da FSA foram obtidas por extração com etanol 99%, sob agitação horizontal por 1 H, em temperatura ambiente. O extrato obtido foi centrifugado a 10000 × g/10 min e o sobrenadante foi recolhido. O nível de saponina foi determinado colorimetricamente (λ = 430 nm) pela reação com o anisaldeído, em meio ácido, usando digitonina como padrão [16]. A FSA foi suspensa em solução de hidróxido de sódio 0,01 mol.L–1 e agitada horizontalmente por 1 H, em temperatura ambiente. Após centrifugação (3000 × g/10 min), uma alíquota do sobrenadante foi usada para o ensaio enzimático empregando-se a enzima tripsina e o substrato BApNA (benzoilDL-arginina-p-nitroanilida) para verificação da existência de inibidor da ação da tripsina sobre o BapNA na amostra pesquisada. A atividade do inibidor de tripsina foi expressa em Unidades de Tripsina Inibida (UTI) [17].
O experimento de campo foi conduzido com galinhas da linhagem Hisex Brown vermelha em fase de postura (33 semanas de idade), na Fazenda Capão Redondo, município de São Tiago, Minas Gerais. O delineamento foi inteiramente casualizado, consistindo de quatro tratamentos avaliados em cinco repetições (gaiolas; unidade experimental) de três galinhas cada, totalizando o uso de 160 aves. Os tratamentos corresponderam a uma ração controle, sem a inclusão da FSA, formulada para atender as exigências nutricionais das galinhas poedeiras, mais três rações contendo níveis crescentes de inclusão da FSA (20, 40 e 60 g de FSA/kg de ração). A FSA foi incorporada nas rações em substituição ao óleo de soja e farelo de soja. As aves foram alojadas em gaiolas de arame galvanizado (com dimensões de 45 x 45 x 30 cm) alocadas em um galpão de alvenaria, convencional para postura. Cada gaiola acomodou três aves, totalizando 40 gaiolas, sendo cada gaiola como uma unidade experimental. As aves receberam ração e água ad libitum em comedouros tipo calha e bebedouros tipo nipple. O fotoperíodo adotado foi de 16 horas (natural + artificial).
O período experimental teve duração de 36 dias, sendo avaliados o consumo de ração e a produção média diária de ovos. Além disso, na 36º e 39º semana de idade das galinhas, os ovos coletados foram destinados para a determinação do perfil de ácidos graxos (AG) na gema. A extração dos lipídios foi realizada segundo o método de Folch [18], sendo que 0,5 g de gema crua foi transferida para balão volumétrico de 100 mL, sendo seu volume completado com solução 2:1 de clorofórmio e metanol. A mistura foi agitada manualmente por dois min e, em seguida, filtrada em funil de separação. Foi adicionado ao funil 20 mL de kcl 0,72% para a primeira separação de fases. Foi adicionado mais 17,5 mL de KCl 0,72% e a mistura agitada manualmente. Após a segunda separação das fases, o extrato clorofórmico foi filtrado com sulfato de sódio anidro (Na2SO4) para um balão de fundo redondo de 200 mL. Secou-se o extrato clorofórmico em rota-evaporador a 25ºC e, em seguida, foi determinada a quantidade de lipídeos totais. A metilação e saponificação dos lipídeos foram realizadas utilizando-se o método de Hartman e Lago [19]. Amostras de 1 mL da solução lipídica do extrato clorofórmico foram transferidas para tubos de tampa esmerilhada, seguida de evaporação do clorofórmio com auxílio de corrente de nitrogênio.
A saponificação resultou da adição de 2 mL de solução metanólica de hidróxido de sódio a 0,5 N e aquecimento em banho-maria a 100ºC por cinco minutos. Para esterificação dos AG foi adicionado ao extrato lipídico 6 mL do reagente de esterificação (60 mL de metanol + 2 g de cloreto de amônio + 3 mL de ácido sulfúrico), com aquecimento dos tubos em água fervente por três minutos. Após o resfriamento, foi adicionado ao extrato 5 mL de água fria, seguida de agitação manual. A fase superior foi transferida para um tubo de ensaio e adicionado 5 mL de solução saturada de carbonato de sódio (NaHCO3). Em seguida, foram aplicadas três porções consecutivas de 1 mL de hexano, para que assim fossem extraídos os ésteres metílicos do composto. Uma alíquota de 1 ¼L do extrato esterificado foi injetada no cromatógrafo à gás, modelo Intecrom G8000 – São Paulo/Brasil, equipado com detector de ionização em chama (FID), injetor split e coluna CP-SIL 88. A identificação dos AG foi realizada através da comparação dos tempos de retenção dos ésteres metílicos das amostras padrões de AG autênticos (Sigma / EUA). A quantificação dos AG foi realizada por área dos picos observados.
Os ovos destinados à análise do perfil de ácido graxo foram também avaliados em relação à unidade de Haugh; percentual de gema, albúmen e casca; pH da gema e do albúmen. Para a determinação de unidades Haugh, os ovos foram quebrados sobre uma superfície plana de vidro e, com auxílio de um micrômetro, realizou-se a medida da altura do albúmen. A unidade Haugh foi calculada segundo a equação a seguir:
UH = 100 x log (H – 1,7 x P0,37 + 7,57)
em que:
UH: unidades Haugh;
H: altura do albúmen denso (em milímetro); e
P = massa do ovo (em gramas).
Após a quebra dos ovos, realizou-se a separação do albúmen e da gema, sendo esta pesada em balança semi-analítica de precisão de 0,01 g. As cascas dos ovos foram lavadas e secas a 15°C por 24 H, e em seguida, estas foram pesadas em balança semi-analítica de precisão de 0,01 g. O peso do albúmen foi obtido por diferença entre os pesos do ovo, da casca e da gema. Os percentuais de gema, casca e albúmen foram obtidos em relação ao peso do ovo íntegro. Já o pH da gema e do albúmen foram mensurados diretamente utilizando-se um pHmetro.
Análise estatística: Os resultados obtidos foram analisados de acordo com o delineamento inteiramente casualizado com quatro níveis de inclusão da FSA. A significância para a análise de variância foi de 5% e quando significativo, os tratamentos foram comparados por meio da análise de regressão polinomial [20]. Estes dados foram avaliados de acordo com o modelo estatístico a seguir:
Yij = µ + ti+ eij
em que:
Yij: observação de cada tratamento i na repetição j de unidade experimental;
µ: média geral;
ti: efeito do tratamento i, sendo i = 1 a 4;
eij: erro associado a cada unidade experimental, assumindo e ~ N (µ, σ2) e estes são i.d.d[1].
RESULTADOS E DISCUSSÃO
Caracterização nutricional e antinutricional da FSA: O teor de umidade determinado nas sementes de abóbora foi de 57,16 ± 0,08 g/100 g. Já na FSA, com base na matéria seca, determinou-se os níveis de 27,02 ± 0,12 g/100 g de PB, 21,16 ± 0,17 g/100 g de FA, 34,28 ± 0,26 g/100 g de EE, 3,12 ± 0,02 g/100g de cinzas. Esses valores são semelhantes aos níveis médios encontrados na FSA de Cucurbita maxima: teor de umidade de 56,54; 29,54 de PB; 22,40 de FA; 36,41 de EE e 3,48 de cinzas [5]. A composição da FSA demonstra seu potencial na alimentação animal como fonte de fibras, proteína e gordura.
Os compostos antinutricionais consistem em metabólitos secundários das plantas e têm como função natural a proteção contra os predadores. Os polifenóis podem ser benéficos ou maléficos aos seres vivos, dependendo da quantidade ingerida e do processo de obtenção. Compostos fenólicos como o tanino, afetam diretamente o consumo e digestibilidade do alimento, acarretando em baixa ingestão de forragem e perda de peso, causando uma diminuição da produtividade animal [21]. As amostras de FSA analisadas no presente trabalho, apresentaram 0,18 ± 0,01 g/100 g de polifenóis, valor semelhante aos 0,103 g/100 g encontrado na literatura [7]. Certos compostos fenólicos são antioxidantes hidrofílicos formando uma forte defesa contra os radicais livres por atuarem em diferentes compartimentos das células, protegendo-as de várias patologias, podendo ter efeitos benéficos quando presentes na dieta [22].
As amostras de FSA avaliadas no presente estudo apresentaram 4,12 ± 0,09 mg/100 g de cianeto quando previamente submetidas a aquecimento em estufa por 24 H a 40°C. Sementes submetidas ao calor entre 5 e 15 min têm seus teores de antinutrientes diminuídos de 6,42 mg/100g na semente crua, para 4,32; 3,36 e 3,76 mg/100 g quando submetidos ao calor por 5, 10 e 15 min, respectivamente [6]. O cianeto inibe a citocromo oxidase, o que resulta no bloqueio da cadeia de transporte de elétrons durante o processo de respiração celular [23]. A dose letal (DL50) de cianeto para aves domésticas varia de 9,4 a 21 mg/kg, assim, uma poedeira de 2 kg teria que ingerir 465,3 g da FSA do presente estudo para atingir a DL50 [24].
Os achados de 0,37 ± 0,09 g/100 g de saponinas condizem com os resultados em literatura [5] que apresentou entre 0,24 e 0,35 g/100 g com as variações de temperatura aplicadas. A intoxicação por saponinas varia de acordo com o organismo animal e avaliando a intoxicação em galinhas, concluiu que 0,44 g de saponina/litro de líquido ingerido causaria a morte das aves confirmando assim que a quantidade de saponinas presente em 100 g de FSA de 0,03 g não causa malefício à espécie [25]. As amostras de FSA analisadas apresentaram 4,32 ± 0,15 UTI/mg, resultado esse semelhante ao encontrado em literatura de 4,21 UTI/mg [6]. Inibidores enzimáticos nas sementes atuam como agentes regulatórios de proteases endógenas. Já na alimentação dos seres vivos, esses inibidores agem no processo de digestão de proteínas, uma vez que a tripsina realiza a quebra da cadeia polipeptídica no encontro da lisina e arginina, o inibidor de tripsina causa sua inativação podendo apresentar efeitos maléficos devido à falta de absorção de aminoácidos ou benéficos, no caso dos humanos, como controle da saciedade [26] [27] [28].
Em relação ao perfil de AG da FSA (Cucurbita maxima e Cucurbita mochata) determinou-se em relação ao EE total: 0,11% ± 0,01 de ácido mirístico, 9,56% ± 0,11 de ácido palmítico, 7,3% ± 0,06 de ácido esteárico, 26,02% ± 0,13 de ácido oleico, 43,87 ± 0,09 de ácido linoleico, 0,35% ± 0,04 de ácido araquidônico, 0,23% ± 0,08 e ácido eicosapentaenoico e 3,52% ± 0,15 de ácido docosaexaenoico. Foram encontrado em literatura a análise do perfil de AG na FSA de Cucurbita maxima L. [29]. Com resultados diferentes como: ácido caproico (C 6:0) 8,99; ácido mirístico (C 14:0) 0,13; cis-10-pentadecanoico (C 15:1 Δ10) 10,98; palmitoleico (C 16:1 Δ9) 0,09; cis-10- heptadecanoico (C 17:1 Δ10) 7,79; esteárico (C 18:0) 28,75; oleico (C 18:1Δ9) 42,3; linoleico (C 18:2 Δ9,12) 0,42; araquidônico (C 20:0) 0,43 e linolênico (C 18:3 Δ9,12,15) 0,09, podendo-se concluir que a origem e cultivo das sementes podem interferir nos resultados. Observa-se ainda a importância das gorduras (animal e vegetal) como ingrediente de rações, pois estas, além de fornecerem energia, melhoram a absorção das vitaminas, diminuem a pulverulência e aumentam a sua palatabilidade, melhorando a eficiência de utilização da energia consumida, por causa do menor incremento calórico do metabolismo dos lipídeos [30].
Parâmetros de desempenho produtivo: O consumo de ração e a produção média diária de ovos das galinhas alimentadas com níveis crescentes de inclusão de FSA na ração consta na Tabela 1.
[1] i.d.d: independentes e identicamente distribuídos

Verificou-se que o consumo de ração nos quaro tratamentos manteve-se constante enquanto que a produção de ovos apresentou valor significativo (P<0,05) com melhor resultado de produção na adição de 40g/kg de FSA. Atualmente a recomendação da ingestão de ração é de 115 g/ave/dia com idade entre 26 e 90 semanas, semelhante ao obtido nessa pesquisa [31]. Verificou-se que a adição de 60 g/kg de FSA melhora a qualidade lipídica do ovo e leva a diminuição da quantidade dos ingredientes que oneram o valor da ração como o milho com queda de 5,14%, farelo de soja de 11% e óleo de soja de 26,03%.
Perfil de ácidos graxos na gema do ovo: O perfil dos ácidos graxos determinado na gema de ovos provenientes de galinhas alimentadas com níveis crescentes de inclusão de FSA na ração consta na Tabela 2.
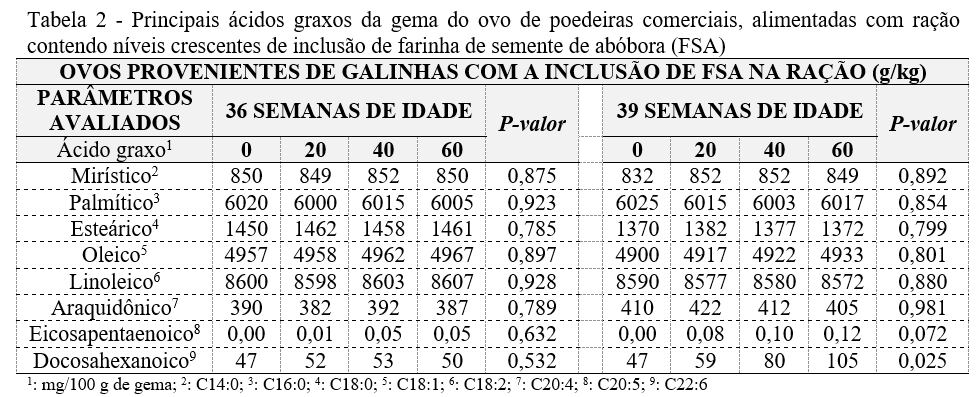
O perfil de ácidos graxos das gemas dos ovos avaliados, não apresentaram diferença entre os tratamentos (P>0,05). O resultado do ácidos eicosapentaenoico (EPA) da 39ª semana (0,072) apesar de ocupar esse grupo, se comparado à 36ª semana (0,632) indica vantajosa diferença estatística, visto que se as aves forem submetidas a mais tempo de ingestão da FSA provavelmente obtêm-se resultado benéfico para melhora do perfil de EPA no ovo. Valores de até 8,5% embora não sejam significantes ao nível de 5% é um valor bastante indicativo, portanto valioso e informativo [32]. O ácido docosahexaenóico (DHA) expressa boa significância (P<0,05), ou seja, este é conclusivo para a pesquisa, onde o acréscimo de FSA em até 60 g/kg acarretou seu aumento na gema; e se considerar o tempo de pesquisa conforme no caso de EPA, certamente obtém-se melhores resultados. A obtenção desse resultado durante os 36 dias de experimento sugere duas vantagens (Figura 1): (i) aumento de postura/ave de 62 unidades adicionando-se 40 g/kg/ração, porém, com resultados de EPA e DHA insatisfatórios; e (ii) obtém-se ligeiramente menor quantidade de produção com ovos melhorados quanto ao perfil lipídico e assim atendendo a demanda de mercado.
Tais resultados comprovam que a FSA pode ser utilizada como um ingrediente alternativo na alimentação de galinhas poedeiras. O enriquecimento dos ovos com AG poliinsaturados pode ser obtido pelo enriquecimento das rações de poedeiras como fontes desse óleo como peixe de água salgada e sementes oleaginosas, pois promovem a incorporação de n-3 na gema [33].
Sendo assim, a FSA pode ser classificada como oleaginosa devido aos seus 36,41% de teor lipídico [5] sendo essa porcentagem dividida entre 61,60% de poliinsaturados e 37,34% de saturados [7].
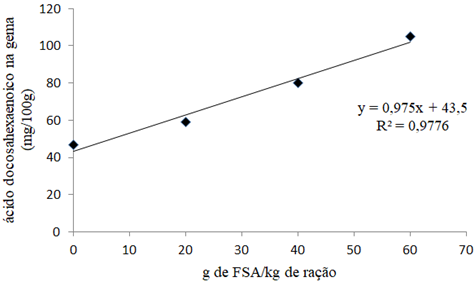
Com a adição crescente da FSA na ração verificou-se bioquimicamente que houve vantajosa produção do DHA, uma vez que na reação química normal o precursor alfa-linolênico gera 0,5% de DHA e 5% de EPA devido aos dois compostos competirem pelas mesmas enzimas de conversão (dessaturase e elongase), considerando que o ácido docosahexanoico (DHA C:22,6) é o resultado da adição de dois carbonos do ácido eicosapentaenóico (EPA C 20:5) percebe-se que havendo maior produção de EPA, essa mesma foi convertida em DHA em quantidades maiores [34].
O ácido docosahexanoico possui papel importante na estrutura de todas as membranas celulares juntamente com o EPA e araquidônico como fluidez, adesão de moléculas, sinalização celular etc. sendo assim, em casos de inflamação, os receptores presentes na membrana enviam mensagens desencadeando uma cascata de reação inflamatória com produção de eicosanóides (prostraglandinas e leucotrienos), citocinas e células T inibindo o aspécto inflamatório. Especificamente o DHA é responsável por gerar enzimas protectinas antinflamatórias e ativação da apoptose celular. Tem importante função na formação, desenvolvimento e funcionamento do cérebro e da retina, sendo predominante na maioria das membranas celulares desses órgãos. No sistema nervoso central, especificamente na parte cinzenta encontram-se os corpos celulares dos neurônios, sendo nesse local a atuação do DHA que, por ser altamente insaturado, influencia as propriedades físicas das membranas cerebrais, características dos seus receptores, interações celulares e atividade enzimática sendo que em casos de sua deficiência, no envelhecimento do indivíduo há um aumento do estresse oxidativo, reduzindo os níveis do DHA e do AA (alfa-araquidônico) no cérebro resultando em aumento na proporção de colesterol causando doenças de Alzheimer, Parkinson e esclerose lateral amiotrófica enquanto que na retina encontra-se ligado aos fosfolipídios que estão associados à rodopsina, uma proteína que interage no processo de absorção da luz [35].
Parâmetros indicadores da qualidade de ovos: Os critérios de qualidades de ovos produzidos com a inclusão de FSA na ração estão demonstrados na Tabela 3.
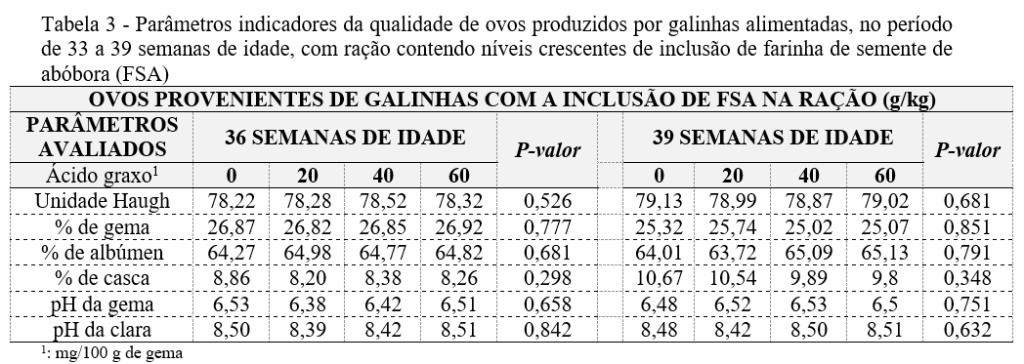
Os resultados referentes aos parâmetros indicadores da qualidade de ovos produzidos no período de 33 a 39 semanas de idade estão indicados na Tabela 3 sendo observado estatisticamente que não houve interação significativa (P>0,05) entre os fatores estudados para o acréscimo de 0, 20, 40 e 60 g/kg de FSA constatando que o produto testado pode ser utilizado para melhora do perfil lipídico da gema sem alterar tamanho, pH e peso do ovo.
Considerando-se que os resultados em geral foram semelhantes e atingiram os padrões de linhagem das galinhas poedeiras Hisex Brown vermelhas [36], demonstra-se que a FSA é um suprimento adequado de energia, lipídeos, proteínas e aminoácidos para produção de ovos. Os dados apresentados fazem da farinha de semente de abóbora um ingrediente de alto valor nutricional e baixo custo podendo substituir ingredientes como o farelo e óleo de soja, os quais suprem o valor nutricional de alguns ingredientes e excedem outros como o DHA trazendo benefícios à ração e consequentemente aos ovos.
A substituição de 60 g/kg FSA na composição da ração de poedeiras diminui a quantidade de farelo de soja em 11%, óleo de soja em 26,03% e de milho de 5,14%, produtos estes que oneram o preço da nutrição de poedeiras. A literatura escassa sobre esse assunto torna difícil a comprovação de mais características da FSA sendo de grande importância mais pesquisas nessa área a fim de beneficiar o meio ambiente, diminuir gastos com a alimentação do plantel e produzir ovos enriquecidos com w3.
CONCLUSÕES
A farinha de semente de abóbora (FSA) pode ser utilizada como um ingrediente alternativo na alimentação de galinhas, no nível de inclusão de até 60 g/kg de ração, sem prejudicar a produção de ovos das aves. Considerando-se o período de 33 a 39 semanas de idade das galinhas, o aumento do nível de inclusão da farinha de semente de abóbora na ração aumenta o teor de ácido docosahexaenoico (DHA) na gema e consequentemente produz ovo enriquecido. A adição da FSA reduz ligeiramente a quantidade do milho, farelo de soja e óleo de soja acarretando em diminuição do preço final da ração.
REFERÊNCIAS
- ABPA – Associação Brasileira de Proteína Animal. História da avicultura no Brasil [Internet]. 2018 [acesso em 2018 Mar 19]. Disponível em: http://abpa-br.com.br/setores/avicultura/a-avicultura-brasileira.
- FEN – Fundación Española de la Nutrición [internet]. 2018 [acesso em 2018 Mar 22]. Disponível em: http://www.fen.org.es/blog/el-mito-del-huevo-y-el-colesterol.
- AVICULTURA INDUSTRIAL. Dados do IBGE apontam que plantel de galinhas poedeiras aumenta 17% [Internet]. 2017 [acesso em 2017 Fev 20]. Disponível em: https://www.aviculturaindustrial.com.br/imprensa/dados-do-ibge-apontam-que-plantel-de-galinhas-poedeiras-aumenta-17/20150918-115302-o368.
- EMBRAPA CLIMA TEMPERADO. A diversidade de abóboras no Brasil e sua relação histórica com a cultura [internet]. 2012 [acesso em 2017 Ago 30]. Disponível em: https://ainfo.cnptia.embrapa.br/digital/bitstream/item/55401/1/15423.pdf
- Naves LDP, Corrêa AD, Abreu CMPD, Santos CDD. Nutrientes e propriedades funcionais em sementes de abóbora (Cucurbita maxima) submetidas a diferentes processamentos. Food Science and Technology. 2010a;30(1):185–190.
- Naves LDP, Corrêa AD, Santos CDD, Abreu CMPD. Componentes antinutricionais e digestibilidade proteica em sementes de abóbora (Cucurbita maxima) submetidas a diferentes processamentos. Food Science and Technology. 2010b;30(1):180–184.
- Silva JS, Simão AA, Marques TR, Leal RS, Corrêa AD. Chemical constituents of the pumpkin seeds flour. Journal of Biotechnology. 2014;5(2):148-156.
- Aguilar YM, López JC, Pérez ÁAS, Yero OM, Navarro MIV, Hurtado CAB. Productividad y calidad del huevo de gallinas con niveles crecientes de harina de semilla de calabaza (Cucurbita maxima). Revista Mexicana de Ciencias Pecuárias. 2012;3(1):65–75.
- Achilonu MC, Nwafor IC, Umesiobi DO, Sedibe MM. Biochemical proximates of pumpkin (Cucurbitaeae spp.) and their beneficial effects on the general well‐being of poultry species. Journal of Animal Physiology and Animal Nutrition. 2018;102(1):5–16.
- AOAC – ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTRY. Offial methods of analysis of the AOAC. 16 ed, Washington; 1995.
- Pereira A, Santanna R, Gomes J, Moreira M, Casali V. Obtenção e caracterização físico-química de um isolado protéico de semente de moranga (Cucurbita maxima, Duchesnne). Boletim da Sociedade Brasileira de Ciência e Tecnologia de Alimentos. 1985;19(1):23–34.
- Goldstein JL, Swain T. Changes in tannins in ripening fruits. Phytochemistry. 1963;2(4):371–383.
- Ikediobi CO, Onyia GOC, Eluwah CE. A rapid and inexpensive enzymatic assay for total cyanide in cassava (Manihot esculenta Crantz) and cassava products. Agricultural and Biological Chemistry. 1980;44(12):2803–2809.
- Corrêa AD, Santos CD, Natividade MAE, Abreu CD, Xisto ALRP, Carvalho VD. Farinha de folhas de mandioca I: efeito da secagem das folhas sobre a atividade da linamarase. Ciência e Agrotecnologia. 2002;26(2):368–374.
- Wood T. The isolation, properties, and enzymic breakdown of linamarin from cassava. Journal of the Science of Food and Agriculture. 1996;17(2):85–90.
- Baccou JC, Lambert F, Sauvaire Y. Spectrophotometric method for the determination of total steroidal sapogenin. Analyst, 1977;102(1215):458–465.
- Kakade ML, Rackis JJ, McGhee JE, Puski G. Determination of trypsin inhibitor activity of soy product: a collaborative analysis of an improved procedure. Cereal Chemistry. 1974;51(3):376–382.
- Folch J, Less M, Stanley S. A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry. 1957;226(1):497–509.
- Hartman L, Lago RCA. Rapid preparation of fatty acid methyl esters from lipids. Laboratory Practices. 1973;22:475–476.
- R CORE TEAM. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, [internet] 2017. [acesso em 2018 Jun 14]. Disponível em: https://www.R-project.org.
- Cordão MA, Pereira Filho JM, Bakke AO, Bakke IA. Taninos e seus efeitos na alimentação animal: revisão bibliográfica. Pubvet. 2010;4(32):924–930.
- Scalbert A, Johnson IT, Saltmarsh M. Polyphenols: antioxidants and beyond. The American journal of clinical nutrition. 2015;81(1):215–217.
- Wogan GN, Marletta MA. Componentes perjudiciales o potencialmente perjudiciales de los alimentos. In: Química de los alimentos. 2 ed, Zaragoza: Acribia; 1993.
- Stanley NW, Hill EF, Carpenter JW, Krynitsky AJ. Acute oral toxicity of sodium cyanide in birds. Journal of wildlife diseases. 1986;22(4):538–546.
- Vivaldo IL. Determinación de dosis letal media (dl50) de extracto de lechuguilla (agave lechuguilla) en aves (gallus domesticus) de 21 días de edad. [tese]. Buenavista, Saltillo, México: Universidade Autônoma Agrária Antonio Narro; 2015.
- Santos EA, Oliveira AS, Maria L, Rabêlo A, Uchôa AF, Morais AHA. Affinity chromatography as a key tool to purify protein protease inhibitors from plants. Affinity chromatography. IntechOpen. 2012;211–244.
- Ribeiro JA, Serquiz AC, Silva PF, Barbosa PB, Sampaio TB, Araújo Junior RF, et al. Trypsin inhibitor from Tamarindus indica L. seeds reduces weight gain and food consumption and increases plasmatic cholecystokinin levels. Clinics 2016;70:136–143.
- Serquiz AC, Sátiro DSP, Lima VCO, Rocha LRM, Oliveira CN, Sampaio TBM, et al. The effect of a high calorie diet containing a peanut candy on weight loss. Internacional Food Research Journal. 2016;23(1):248–256.
- Silva JES, Moura AMA, Nogueira RA. Efeito dos ácidos graxos essenciais sobre lipidemia e vascularização da membrana vitelina de codornas japonesas. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. 2012;64(6):1603–1612.
- Nunes I J. Nutrição Animal Básica, FEP – MVZ Editora, Belo Horizonte, 2 ed., 1998. 388p.
- EMBRAPA POEDEIRA. Guia de manejo das poedeiras coloniais de ovos castanhos [internet]. 2017 [acesso em 2019 Jan 17]. Disponível em: ainfo.cnptia.embrapa.br/digital/bitstream/item/179376/1/Manual-051-web.pdf.
- Paes A.T. Itens essenciais em bioestatística. Arquivos Brasileiros de Cardiologia. 1998;71(4):579–580.
- Van Elswyk ME. Comparison of n–3 fatty acid sources in laying hen rations for improvement of whole egg nutritional quality: a review. British journal of Nutrition. 1997;78(1):61–S69.
- Gómez MEDB. Modulação da composição de ácidos graxos poli-insaturados ômega 3 de ovos e tecidos de galinhas poedeiras através da dieta. [tese]. Universidade de São Paulo; 2003.
- Martin CA, Almeida VV, Ruiz MR; Visentainer JEL, Matshushita M, Sousa NE, et al. Omega-3 and Omega-6 polynsaturated fatty acids: importance and occurrence em foods. Revista de Nutrição. 2006;1(19):761-770.
- NUTRIAVES. Pintos e frangas recriadas [internet]. 2019 [acesso em 2019 Jan 18]. Disponível em: http://www.nutriavesdistribuidora.com.br/site/project/hisex-brown.
Tag:CBPAV


