
IMOBILIZAÇÃO E APLICAÇÃO DA LIPASE EVERSA TRANSFORM 2.0 NA TRANSESTERIFICAÇÃO DE ÓLEO DE SOJA
Capítulo de livro publicado no livro do VIII ENAG E CITAG. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062046-68
Este trabalho foi escrito por:
Francisco Lucas Chaves Almeida; Giovanna Totti Bullo ; Mariana Pereira Silveira ; Rafaela Menezes dos Passos; Klicia Araújo Sampaio ; Ana Silvia Prata ; Marcus Bruno Soares Forte *
*Autor correspondente (Corresponding author) – Email: [email protected]
RESUMO: A imobilização surge como uma ferramenta que proporciona uma fácil recuperação e reuso de enzimas, diminuindo assim o impacto do custo das enzimas no processo. Entretanto, para que isso seja eficientemente empregado, os agentes utilizados no processo de imobilização também necessitam apresentar baixo custo. Nesse contexto, o presente estudo objetiva estudar a substituição do alginato de sódio por amido de milho comercial na imobilização de lipases. Soluções de alginato de sódio (2,8% p/v), amido de milho comercial (2,8% p/v) e lipase comercial Eversa Transform 2.0 foram misturadas nas proporções mássicas de 80%: 0%: 20% (A); 60%: 20%: 20% (B) e 40%: 40%:20% (C), respectivamente, e em seguida foram gotejadas em uma solução de cloreto de cálcio a 200mM. A microscopiaóptica demonstrou que as partículas contendo amido apresentaram maior uniformidade de parede e maior esfericidade, mas em contrapartida, tambémexibiram menor resistência mecânica (3,63 N ± 0,23 (A), 2,78 N ± 0,16 (B), 1,57 N ± 0,16 (C)) e maior tamanho (2,52 mm ± 0,25 (A), 2,71 mm ± 0,21 (B), 2,7 mm ± 0,21 (C)). Em relação à transesterificação do óleo de soja, os processos conduzidos com as partículas contendo amido de milho apresentaram maior fração mássica de ésteres etílicos, sendo elas 73,69 (B) e 70,20% (C). Com isso, conclui-se que é possível a substituição parcial do alginato de sódio pelo amido de milho, proporcionando assim uma diminuição no custo do processo de imobilização.
Palavras-chaves: Imobilização enzimática, biodiesel, amido de milho
ABSTRACT: Immobilization emerges as a tool that provides an easy recovery and reuse of enzymes, thus reducing the impact of the cost of enzymes in the process. However, for this to be efficiently used, the agents used in the immobilization process need to have low cost. In this context, the present study aims to evaluate the replacement of sodium alginate by commercial corn starch in the lipase immobilization. Sodium alginate solutions (2.8% w/v), commercial corn starch (2.8% w/v) and commercial lipase Eversa Transform 2.0 were mixed in the mass proportions of 80%: 0%: 20% (A ); 60%: 20%: 20% (B) and 40%: 40%:20% (C), respectively, and then dripped into a 200 mM calcium chloride solution. Optical microscopy showed that the starch-containing particles had greater wall uniformity and greater sphericity, but on the other hand, they also had lower mechanical strength (3.63 N ± 0.23 (A), 2.78 N ± 0.16 (B), 1.57 N ± 0.16 (C)) and larger size (2.52 mm ± 0.25 (H), 2.71 mm ± 0.21 (B), 2.7 mm ± 0.21 (C) )). Regarding the soybean oil transesterification, the processes carried out using the particles containing corn starch showed a higher mass fraction of ethyl esters, being 73.69 (B) and 70.20% (C). Therefore, it is concluded that it is possible to partially replace sodium alginate by corn starch, thus providing a decrease in the cost of the immobilization process.
Keywords: Enzymatic immobilization, biodiesel, corn starch
INTRODUÇÃO
As lipases (EC 3.1.1.3) representam uma das classes de enzimas mais utilizadas no mercado mundial, principalmente por serem capazes de catalisarem diversas reações, tais como: hidrólise, transesterificação, esterificação, entre outras. Todavia, assim como as demais enzimas, quando utilizadas na sua forma livre, a dificuldade de recuperação e reuso são ainda grandes obstáculos a serem superados (1–3).
Assim, a imobilização de enzimas surge como uma forma de aprisionar a enzima em uma região (suporte) delimitada facilitando assim a sua recuperação e reuso no processo. Sabe-se que atualmente existem diversas técnicas capazes de imobilizar enzimas, mas a gelificação iônica têm se destacado, visto que ocorre em condições amenas de temperatura e não faz uso de agentes químicos severos capazes de desnaturar a enzima (4–6).
Atualmente, muitos materiais já foram testados como suporte para a imobilização de enzimas por meio de gelificação iônica, mas os materiais poliméricos, como os polissacarídeos, têm chamado a atenção por sua versatilidade e possibilidades de modificação, além de sua diversidade. Dentre esses, polissacarídeos que vêm sendo amplamente utilizados tais como alginato de sódio, amido de milho, quitosana e outros, , o alginato, em conjunto com o cloreto de cálcio, é um dos pares mais utilizados para a gelificação iônica (7–10).
Apesar de ser o polissacarídeo mais utilizado atualmente, o alginato apresenta alto custo quando comparado a outros (amido, por exemplo) e suas partículas apresentam poros grande, podendo permitir a lixiviação de moléculas como enzimas. Todavia, Chan et al. (11) destacam que a associação do alginato com outros polissacarídeos pode ocasionar uma menor porosidade da partícula.
Nesse contexto, o amido de milho surge como um potencial substituto do alginato de sódio, principalmente por apresentar um menor custo quando comparados entre si e também apresentar a capacidade de realizar crosslinking com íons bivalentes como o cloreto de cálcio. Assim, o presente estudo objetiva estudar a substituição do alginato de sódio por amido de milho comercial na imobilização da lipase eversa transform 2.0.
MATERIAL E MÉTODOS
Imobilização da lipase
A imobilização foi realizada utilizando solução de alginato de sódio (2,8% p/v) e amido de milho comercial (2,8%) e 20% (m/m) da lipase comercial Eversa Transform 2.0 (Tabela 1). Com o uso de um tubo de silicone (ID 4 mm), transportou-se a solução anterior através de uma bomba peristáltica (MasterFlex®) até um bico atomizador de fluido duplo (ID = 1mm), a qual foi gotejada em uma solução de cloreto de cálcio a 200 mM. Em seguida, as partículas ficaram em maturação durante 15 min, sendo filtradas e lavadas posteriormente com água destilada.

Caracterização das partículas
As partículas foram caracterizadas através de microscopia óptica utilizando um microscópio óptico Nikon (AZ100, Tóquio, Japão), com uma maximização de 4x, e resistência mecânica utilizando-se um texturometro TA-XT Plus Texture Analyzer (Stable Micro Systems, UK). Para a análise de textura, oito partículas foram distribuídas uniformemente e comprimidas até 50% do seu tamanho inicial com o auxílio de uma probe cilindrica (diâmetro de 36 mm). O tamanho médio das partículas foi realizado utilizando o software Imaje J.
Reação e caracterização dos produtos da Transesterificação do Óleo de Soja
Para a reação de transesterificação do óleo de soja, 5g de óleo foram utilizados, e os demais parâmetros são descritos a seguir: relação molar de 1:4,5 (óleo: etanol); 3% de água (em relação a massa de óleo) e 1g de partículas contendo lipase imobilizada, temperatura de 40°C e agitação de 300 RPM. As reações foram conduzidas por um período de 48h em elermeyers de 10mL. Após a reação, as soluções foram centrifugadas a 10000 RPM durante 10 min e caracterizadas por Cromatografia de Exclusão de Tamanho de Alto Desempenho (HPSEC) de acordo com a metodologia descrita por Ferreira et al. (12).
RESULTADOS E DISCUSSÃO
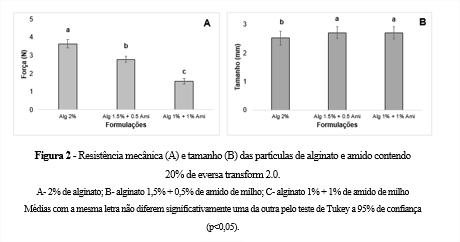
Na Figura 1, pode-se verificar a microscopia óptica das partículas produzidas com as diferentes formulações.

Observa-se que as partículas B e C apresentam uma maior uniformidade de parede e maior esfericidade, sendo observada a formação de calda na partícula contendo somente alginato (A). A partícula A é aquela que apresenta poros mais largos, indo de encontro ao elucidado pela literatura, uma vez que Chan et al.. (11)relata em seu trabalho que o amido é capaz de reforçar a rede de hidrogel e preencher os vazios intersticiais, garantindo maior esfericidade.
Percebeu-se ainda quea adição de amido ocasionou uma diminuição da resistência mecânica das partículas (Fig. 2 A) variando de 3,63 N ± 0,23 (alginato 2%) a 1,57 N ± 0,16 (alginato 1% + amido 1%). Entretanto, mesmo com o decréscimo na resistência mecânica nas partículas adicionadas de amido, quando deixadas em repouso a temperaturas de 50, 60 e 70 °C imersas em água e em uma solução de azeite de oliva: etanol (1:6 molar), todas mantiveram sua estrutura após 24h. Ressalta-se ainda que a adição de amido impactou no aumento do tamanho de partículas (Fig. 2B).
Produção e caracterização do biodiesel
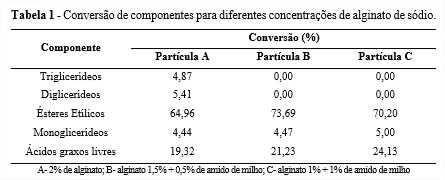
Observa-se na Tabela 1 os resultados obtidos para transesterificação do óleo de soja utilizando os biocatalisadores imobilizados. Constata-se a conversão de triglicerídeos em diglicerídeos, monoglicerídeos, ácidos graxos livres e ésteres etílicos. A produção de biodiesel através da metodologia proposta foi mais satisfatória para menores concentrações de alginato. Isso sinalizaria que, de fato, a substituição do alginato de sódio pelo amido de milho comercial é viável, tendo em vista a possibilidade de aumento da conversão de ésteres etílicos, e também pelo fato do amido apresentar menor custo, beneficiando o processo pela diminuição de custos financeiros para produção dos biocatalisadores.
CONCLUSÕES
Baseado nos resultados apresentados, pode-se concluir que as partículas contendo amido apresentaram uma menor quantidade de poros se comparadasàpartícula contendo somente alginato, mas também demonstraram menor resistência mecânica. Já para a produção de biodiesel, a substituição do alginato por amido é viabilizada, uma vez que as conversões utilizando amido de milho foram maiores e o aumento do teor de amido em substituição do alginato diminui custos. Assim, é viável a substituição parcial do alginato de sódio pelo amido de milho comercial.
AGRADECIMENTOS
A equipe do projeto agradece a Fundação de Amparo à Pesquisa do Estado de São Paulo – FAPESP pelo suporte financeiro e concessão da bolsa de doutorado (FAPESP 2019/03399-8) ao qual o projeto está vinculado e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico – CNPq pela concessão da bolsa de Iniciação Científica e ao Conselho de Aperfeiçoamento de Pessoal de Nível Superior – CAPES (código de financiamento 001).
REFERÊNCIAS
1. Kapoor M, Gupta MN. Lipase promiscuity and its biochemical applications. Process Biochem [Internet]. 2012 Apr;47(4):555–69. Available from: https://linkinghub.elsevier.com/retrieve/pii/S135951131200027X
2. Sharma R, Chisti Y, Banerjee UC. Production, purification, characterization, and applications of lipases. Biotechnol Adv [Internet]. 2001 Dec;19(8):627–62. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0734975001000866
3. Villeneuve P, Muderhwa JM, Graille J, Haas MJ. Customizing lipases for biocatalysis: a survey of chemical, physical and molecular biological approaches. J Mol Catal B Enzym [Internet]. 2000 Apr;9(4–6):113–48. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1381117799001071
4. Dong H, Zhang W, Wang Y, Liu D, Wang P. Biofilm Polysaccharide Display Platform: A Natural, Renewable, and Biocompatible Material for Improved Lipase Performance. J Agric Food Chem. 2020;68(5):1373–81.
5. Haskell AK, Sulman AM, Golikova EP, Stein BD, Pink M, Morgan DG, et al. Glucose Oxidase Immobilized on Magnetic Zirconia: Controlling Catalytic Performance and Stability. ACS Omega. 2020;5(21):12329–38.
6. Kuang L, Zhang Q, Li J, Tian H. Preparation of Lipase − Electrospun SiO 2 Nano fi ber Membrane Bioreactors and Their Targeted Catalytic Ability at the Macroscopic Oil − Water Interface. 2020;
7. Rinaudo M. Main properties and current applications of some polysaccharides as biomaterials. Polym Int [Internet]. 2008 Mar;57(3):397–430. Available from: http://doi.wiley.com/10.1002/pi.2378
8. Thangaraj B, Solomon PR. Immobilization of Lipases – A Review. Part II: Carrier Materials. ChemBioEng Rev. 2019;6(5):167–94.
9. Torres-Salas P, Del Monte-Martinez A, Cutiño-Avila B, Rodriguez-Colinas B, Alcalde M, Ballesteros AO, et al. Immobilized biocatalysts: Novel approaches and tools for binding enzymes to supports. Adv Mater. 2011;23(44):5275–82.
10. Zhang DH, Yuwen LX, Peng LJ. Parameters affecting the performance of immobilized enzyme. J Chem. 2013;2013.
11. Chan ES, Wong SL, Lee PP, Lee JS, Ti TB, Zhang Z, et al. Effects of starch filler on the physical properties of lyophilized calcium-alginate beads and the viability of encapsulated cells. Carbohydr Polym [Internet]. 2011;83(1):225–32. Available from: http://dx.doi.org/10.1016/j.carbpol.2010.07.044
12. Ferreira MC, Toledo Hijo AAC, Farias FO, Batista EAC, Maximo GJ, Meirelles AJA. In search of sustainable alternatives for vegetable oils deacidification using oligomeric ionic liquid approach. Fluid Phase Equilib [Internet]. 2022 Apr;555:113350. Available from: https://linkinghub.elsevier.com/retrieve/pii/S037838122100412X
Tag:ENAG


