
ANÁLISES FÍSICO-QUÍMICA, BIOATIVA E ANTIOXIDANTE DOS ÓLEOS DE FRUTOS DE PALMÁCEAS AMAZÔNICAS
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Tainara Costa1; Carolina Médici Veronezi2; Neuza Jorge3*
1Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Pós-doutoranda do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
3Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected].
Resumo: As palmeiras do gênero Oenocarpus produzem frutos que são bastante apreciados pela população, e podem contribuir para a ingestão diária de nutrientes e compostos bioativos. Assim, o trabalho teve como objetivos avaliar a composição centesimal da polpa e amêndoa de bacabá e patauá; e caracterizar os óleos quanto às propriedades físico-químicas, bioativas e antioxidantes. A composição centesimal da polpa e amêndoa dos frutos são bastante distintas, sendo que a polpa apresentou maiores teores de lipídios (27,1-37,2%) e proteínas (4,6-6,3%), enquanto a amêndoa obteve mais fibras (72,8-82,1%). Houve significativa presença de minerais, especialmente, sódio, magnésio e fósforo em ambos os frutos. As propriedades físico-químicas comprovaram que o óleo da polpa de patauá apresentou maior qualidade, visto que mostrou menores valores de índice de peróxidos (3,2 meq/kg) e dienos conjugados (0,1%). O óleo da amêndoa de bacabá mostrou ter baixa estabilidade oxidativa, apenas 0,2 h, devido não possuir teores de tocoferóis, embora tenha apresentado 25,7% de ácidos graxos saturados. As frações lipídicas do patauá apresentaram maiores quantidades de compostos bioativos e significativa capacidade antioxidante. Visto que as frações lipídicas apresentaram boa qualidade e compostos benéficos à saúde humana, esses frutos podem ser utilizados como matéria-prima para a extração de óleos.
Palavras-chave: bacabá; compostos bioativos; patauá; qualidade
INTRODUÇÃO
A variabilidade genética encontrada nas espécies frutíferas nativas é um importante instrumento para enfrentar o aumento cada vez maior da demanda por alimentos. A região amazônica é reconhecida como a principal reserva genética de plantas nativas do Brasil, onde são encontradas diversas espécies de palmeiras que podem ser utilizadas pela população (NOGUEIRA; CERQUEIRA; SOARES, 2010).
As palmeiras do gênero Oenocarpus abrangem várias espécies, como bacabá (O. bacaba Mart.) e o patauá (O. bataua Mart.). O bacabá é uma palmeira que fornece um fruto arredondado, de casca roxa e polpa branco-amarelada, de sabor agradável. Por conter proteínas de excelente valor biológico é muito utilizado na alimentação de populações locais e possui potencial de provimento de matéria-prima para a indústria de alimentos. Pode ser consumido na forma de bebidas, como vinhos e sucos, e também como azeite, por ser muito similar ao de oliva. Além disso, é útil no uso farmacêutico para a produção de xaropes contra tosse (MARTORANO et al., 2016). Abadio Finco et al. (2012) avaliando a atividade antioxidante da polpa de bacabá na tentativa de identificar 14 tipos de compostos, concluiram que o bacabá é uma fonte promissora de compostos fenólicos.
O patauá é uma palmeira que tem um fruto comestível, do qual se extrai uma bebida conhecida popularmente por “vinho de pataua”. É rico em diversos aminoácidos, estando o triptofano e a lisina presentes em menor quantidade, o que o torna comparável à carne animal ou ao leite humano, além de ser rico em óleo de alta qualidade (GOMES-SILVA; WADT; EHRINGHAUS, 2004). Estudos demostraram que durante séculos, os povos indígenas extraíram o óleo do patauá com água em ebulição, esfregando o mesocarpo e deixando o óleo flutuar na superfície. Este óleo pode ser utilizado na culinária ou como tônico capilar (JARAMILLO-VIVANCO et al., 2022). Na medicina popular, é utilizado como laxante, para tuberculose, asma e outros problemas respiratórios (GOMES-SILVA; WADT; EHRINGHAUS, 2004).
A fim de explorar e utilizar estes recursos naturais presentes no país, em especial os frutos amazônicos, os objetivos deste trabalho foram caracterizar os óleos, provenientes da polpa e amêndoa de bacabá e patauá, quanto às propriedades físico-químicas, bioativas e capacidade antioxidante.
MATERIAL E MÉTODOS
Material
Obtenção dos frutos
Os frutos de bacabá (Oenocarpus bacaba) e patauá (Oenocarpus batauá) foram adquiridos por meio da EMBRAPA Amazônia Oriental (Belém, Pará, Brasil), congelados e transportados em caixas térmicas via correios até o Laboratório de Óleos e Gorduras da Universidade Estadual Paulista “Júlio de Mesquita Filho” (São José do Rio Preto, São Paulo, Brasil). Os frutos que apresentavam rachaduras, danificações por insetos, animais e/ou aves foram desprezados, e o restante foram secos em estufa com circulação de ar forçada a 40ºC, por 3 h. Após secagem prévia, a polpa e as amêndoas foram separadas manualmente e secas em estufa com circulação de ar forçada a 40ºC até atingirem umidade inferior a 10%.
Extração dos óleos
As frações lipídicas da polpa e amêndoa, separadamente, foram obtidas por extração com éter de petróleo a 40-60ºC utilizando um extrator Soxhlet, com refluxo por 6 h. Em seguida, foram acondicionadas em frascos de vidro âmbar, inertizadas com nitrogênio gasoso e armazenadas a -18°C.
Métodos
Composição centesimal e mineral
As determinações analíticas de umidade, lipídios e cinzas foram realizadas de acordo com os métodos oficiais da AOCS (2009). As proteínas foram determinadas pelo método de Kjeldahl descrito pela AOAC (2012). Fibras alimentares solúveis e insolúveis foram determinadas pela técnica gravimétrica enzimática, segundo o método de Prosky et al. (1992). Os carboidratos totais foram quantificados por diferença e o valor calórico foi calculado utilizando fator de correção de 9 kcal/g para lipídios e 4 kcal/g para os teores de proteínas e carboidratos, segundo o método de Merril e Watt (1973).
Os teores de minerais foram extraídos segundo método da AOAC (2012) e quantificados por espectrofotômetro de emissão óptica por plasma indutivamente acoplado (modelo 720-ES, Varian, Walnut Creek, Estados Unidos), utilizando uma curva de calibração para cada mineral, sendo os resultados expressos em mg/100 g.
Propriedades físico-químicas e bioativas
As análises de ácidos graxos livres, índices de peróxidos, dienos conjugados, iodo, saponificação e matéria insaponificável foram realizadas de acordo com os métodos oficiais da AOCS (2009). A estabilidade oxidativa também foi determinada segundo o método da AOCS (2009), utilizando o Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland) a 100°C e fluxo de ar de 20 L/h.
Para determinar o perfil de ácidos, as amostras foram previamente esterificadas utilizando-se o método de metilação a frio, segundo procedimento descrito pela AOCS (2009). Após esterificação, os ésteres metílicos foram analisados por cromatografia em fase gasosa, utilizando um cromatógrafo (modelo CG 3900, Varian, Walnut Creek Estados Unidos,) com coluna capilar de sílica fundida (CP-Sil 88 de 60 m de comprimento, com diâmetro interno de 0,25 mm e espessura do filme de 0,20 µm). O gás de arraste foi o hidrogênio com velocidade linear de 30 mL/min, a temperatura da coluna de 90 a 195ºC, com aumento de 10ºC/min, mantida em isoterma por 16 min, a temperatura do injetor e detector de 230 e 250ºC, respectivamente e razão de divisão de 1:30. A identificação dos ácidos graxos foi realizada por comparação dos tempos de retenção utilizando como padrão uma mistura composta de 37 ésteres metílicos de ácidos graxos (Supelco, Bellefonte, Estados Unidos), de C4:0 a C24:1, com pureza entre 99,1 e 99,9%. Por meio do perfil de ácidos graxos foram calculados os índices de aterogenicidade, trombogenicidade, como definido por Ulbricht e Southgate (1991) e a razão hipocolerterolêmica/hipercolesterolêmica de acordo com Santos-Silva, Bessa e Santos-Silva (2002).
Carotenoides totais foram determinados segundo metodologia descrita por Rodriguez-Amaya (2004) em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão) e os resultados foram expressos em (μg/g). Os compostos fenólicos totais foram extraídos de acordo com o método proposto por Parry et al. (2005) e quantificados conforme método descrito por Singleton e Rossi (1965) em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão) utilizando uma curva padrão de ácido gálico, e os resultados expressos em mg EAG/g. Os teores de tocoferóis foram analisados conforme o método da AOCS (2009) utilizando um cromatógrafo líquido de alta eficiência (modelo 210-263, Varian, Walnut Creek, Estados Unidos), com detector de fluorescência, coluna de aço inox empacotada com sílica (100 Si, Microsorb, Varian, Walnut Creek, Estados Unidos) e comprimentos de ondas de excitação e emissão de 290 e 330 nm, respectivamente. Individualmente, os teores foram expressos em mg/kg.
Para a análise de teores de fitosteróis, a amostra foi previamente saponificada, conforme a metodologia por Duchateau et al. (2002). O perfil de fitosteróis foi realizado segundo a AOCS (2009), em cromatógrafo a gás (modelo Plus-2010, Shimadzu, Chiyoda-ku, Toquio, Japão) equipado com detector de ionização de chama, sistema de injeção split e coluna capilar de sílica fundida (Restek RTX 5, Shimadzu, Chiyoda-ku, Toquio, Japão) e as temperaturas utilizadas no injetor e no detector foram de 280 e 320°C, respectivamente. Os fitosteróis foram identificados por comparação com o tempo de retenção dos padrões de colesterol, campesterol, estigmasterol, β-sitosterol e estigmastanol (Sigma-Aldrich, St. Louis, MO) com grau de pureza de 99, 99, 95, 98 e 97,4%, respectivamente, e os resultados foram expressos em mg/100 g.
Capacidade antioxidante
A atividade antioxidante por meio do DPPH• foi determinada segundo o método de Kalantzakis et al. (2006) utilizando solução de DPPH• em acetato de etila na concentração de 200 μg/mL e expressa em porcentagem. O método FRAP foi realizado conforme Szydlowska-Czerniak et al. (2008), cujo resulto foi expresso em μM Trolox/100 g. O método de captura do radical livre ABTS•+ foi determinado segundo Re et al. (1999) e o resultado foi expresso em µM Trolox/100 g. Ambas as metodologias foram realizadas em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão).
Análise estatística
Os resultados obtidos das determinações analíticas foram submetidos à análise de variância e as diferenças entre as médias foram testadas a 5% de probabilidade pelo teste de Tukey, através do programa ASSISTAT, versão 7.6.
RESULTADOS E DISCUSSÃO
Composição centesimal e mineral Durante a secagem ocorre a ruptura das paredes celulares com a perda de umidade, e uma porcentagem de umidade menor que 10% auxilia na extração do óleo e melhora a conservação da matéria-prima (SCHWARTZBERG, 1987). Observa-se que ambas as frações dos frutos obtiveram umidade abaixo de 10%. Entre os frutos, a umidade da amêndoa foi significativamente superior a da polpa, e a amêndoa de bacabá apresentou maior teor (9,5%), conforme Tabela 1.
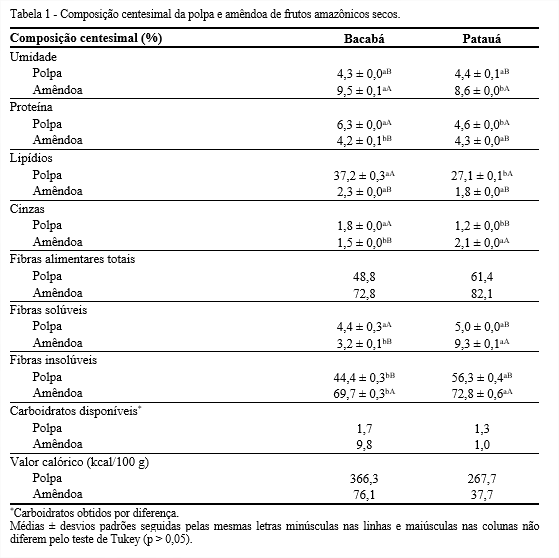
Em relação ao teor de proteínas, a polpa apresentou maiores quantidades do que a amêndoa, destacando a de bacabá (6,3%). Por outro lado, a amêndoa de patauá mostrou ser 3,8% mais proteica que a do bacabá. A polpa mostrou ser importante fonte de lipídios para a alimentação, tendo destaque a de bacabá, que obteve o maior teor de matéria graxa (37,2%). Em contrapartida, as amêndoas de ambos os frutos não diferiram significativamente e apresentaram pequena quantidade de lipídios. Diferentemente, do que ocorre com outras palmeiras, como o Syagrus romanzoffiana, em que a amêndoa do fruto apresenta maior quantidade de lipídios em relação a polpa (JORGE; SILVA; VERONEZI, 2021).
Quanto ao teor de cinzas, mais uma vez houve diferença significativa entre as quantidades encontradas na polpa e amêndoa. Neste caso, o teor de cinzas foi significativamente maior na polpa de bacabá e na amêndoa de patauá. Observa-se que ambas as frações dos frutos mostraram-se importantes fontes de fibra alimentar total, com destaque para a polpa e amêndoa de patauá com 61,4 e 82,1%, respectivamente. Em relação às fibras solúveis, as polpas não apresentaram diferença significativa, enquanto entre as amêndoas destacou-se a de patauá. As amêndoas apresentaram quantidades de fibras insolúveis superior às polpas, sobressaindo a amêndoa de patauá (72,8%).
A polpa de bacabá apresentou quantidade de carboidratos digeríveis inferior as amêndoas, porém, a amêndoa deste fruto mostrou ser um importante fornecedor desse macronutriente quando incluído na dieta, visto que apresentou 9,8%. As polpas mostraram maior valor calórico quando comparado às amêndoas, devido as elevadas quantidades de proteínas e lipídios.
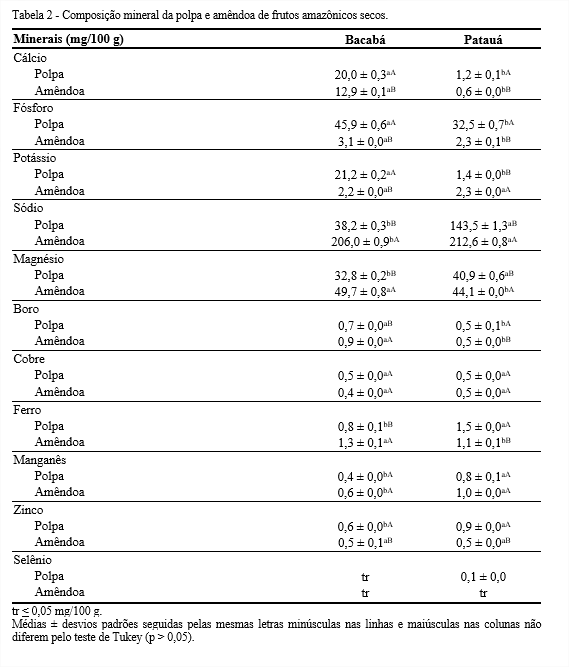
As polpas e amêndoas dos frutos amazônicos revelaram elevadas concentrações de micronutrientes, como cálcio, sódio, fósforo, potássio e magnésio (Tabela 2). Maiores teores de cálcio, fósforo e potássio foram quantificados na polpa de bacabá. Em contrapartida, as amêndoas de patauá e de bacabá mostraram maiores quantidades de sódio e magnésio, respectivamente. A amêndoa de bacabá pode ser considerada um boa fonte de magnésio (49,7 mg/100 g), visto que o valor encontrado contribui com cerca de 19% do recomendado para adultos pelo Ministério da Saúde (BRASIL, 2005a).
Os minerais boro, cobre, ferro e manganês e zinco foram quantificados em ambas as frações dos frutos estudados com concentrações diferentes, sobressaindo a quantidade de ferro encontrada na polpa de patauá, 1,5 mg/100 g. Por outro lado, o selênio foi encontrado somente na polpa de patauá (0,1 mg/100 g). O zinco e o selênio apresentam importância nutricional, por serem antioxidantes, embora seus conteúdos são limitados em alimentos vegetais.
No Brasil, o valor de ingestão diária de minerais é controlado pelo Ministério da Saúde que recomenda para cálcio, fósforo, magnésio, ferro, manganês, zinco quantidades de 1.000; 700; 260; 14; 2,3 e 7 mg/dia para adultos, a fim de prevenir o aparecimento de doenças vinculadas a falta de minerais (BRASIL, 2005a). Assim, os frutos amazônicos deste estudo apresentaram quantidades significativas desses minerais, principalmente a polpa de patauá. Os minerais cobalto, molibdênio e níquel não foram detectados nas amostras em estudo, nem cádmio e chumbo, que são considerados contaminantes de solo, demonstrando boa qualidade do mesmo.
Propriedades físico-químicas e bioativas
Observa-se que houve diferença significativa entre os teores de ácidos graxos livres encontrados nos óleos da polpa e da amêndoa (Tabela 3), destacando os óleos da amêndoa de bacabá e patauá que apresentaram 14,2 e 14,1%, respectivamente.
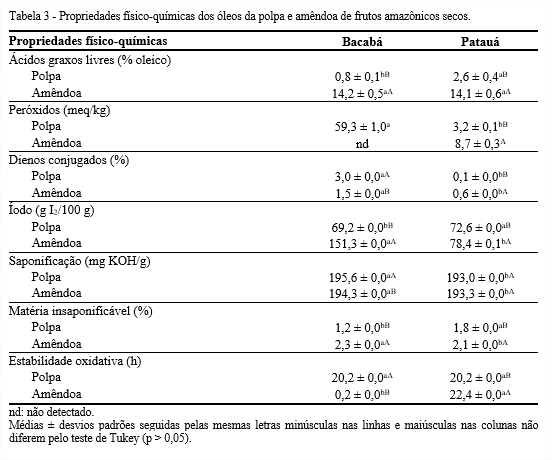
Os valores de peróxidos dos óleos analisados estão abaixo do limite de 15 meq/kg, adotado pela Instrução Normativa n° 87/2021 da ANVISA (BRASIL, 2021), exceto para a polpa de bacabá. O elevado índice de peróxidos encontrado no óleo da polpa de bacabá (59,3 meq/kg) pode ser explicado pelo fato desses frutos terem apenas uma película envolvendo a polpa, que, dessa forma, fica mais exposta a fatores, como à ação da luz, temperatura e oxigênio, que aceleram o processo de oxidação e a formação de peróxidos.
Visto que, um nível baixo de peróxidos não indica garantia de estabilidade oxidativa, uma vez que estes compostos são degradados ao longo do processo oxidativo, foi realizada a determinação dos dienos conjugados, que são produtos primários da oxidação. A formação de dienos conjugados está relacionada com a oxidação dos ácidos graxos poli-insaturados do óleo, formados pelo deslocamento de duplas ligações (SILVA; BORGES; FERREIRA, 1999). Entre os óleos dos frutos, o bacabá apresentou maiores teores de dienos conjugados na polpa e amêndoa, 3,0 e 1,5%, respectivamente, em decorrência do transporte e colheita.
O índice de iodo dos óleos da polpa foi significativamente inferior aos dos óleos da amêndoa. Assim, pode-se inferir que os óleos da amêndoa são mais insaturados, e que seu consumo pode oferecer menor risco para o aparecimento de doenças cardiovasculares, já que controla as taxas de colesterol sanguíneo. Entre os óleos da polpa, o de patauá obteve maior índice de iodo (72,6 g I2/100 g), enquanto para a amêndoa, o óleo de bacabá se destacou com índice de iodo superior (151,3 g I2/100 g). Diferentemente deste estudo, Coimbra e Jorge (2011a), analisando os óleos extraídos da polpas e amêndoa de jerivá, encontraram índices de iodo superiores na polpa.
De acordo com a resolução RDC nº 270 da ANVISA (BRASIL, 2005b), o índice de saponificação da maioria dos óleos vegetais consumidos no Brasil varia entre 181 e 265 mg KOH/g. Como observado na Tabela 3, os óleos estudados encontram-se com valores próximos aos estabelecidos para óleos vegetais. Os óleos da polpa e amêndoa de patauá não apresentaram diferença significativa no índice de saponificação. Entre os frutos, o bacabá foi o que apresentou maior índice de saponificação, tanto na polpa (195,6 mg KOH/g) quanto na amêndoa (194,3 mg KOH/g). Costa-Singh, Bitencourt e Jorge (2012), ao avaliarem óleo extraído da castanha de cutia, encontraram índice de saponificação de 187,73 mg KOH/g, próximo ao apresentado pelas polpas e amêndoas de bacabá e patauá.
Quanto ao teor de matéria insaponificável, houve diferença significativa nas porcentagens encontradas entre os frutos. Para a polpa, houve destaque para o óleo de patauá (1,8%), enquanto na amêndoa, o maior teor de matéria insaponificável foi encontrado no óleo de bacabá (2,3%). Como a matéria insaponificável inclui substâncias naturais como esteróis, tocoferóis, pigmentos e hidrocarbonetos, os óleos da polpa e amêndoa devem conter maiores quantidades desses compostos.
Pela resolução RDC nº 270 da ANVISA (BRASIL, 2005b), o máximo de matéria insaponificável para os óleos de coco, girassol, soja e algodão é de 1,5%. Já para o óleo de milho é de 2,8%. Tendo por bases esses valores, os óleos analisados estão dentro do limite aceito pela legislação para óleos comestíveis.
A estabilidade oxidativa é um importante parâmetro para avaliar as possíveis aplicações dos óleos em alimentos e outros produtos comerciais. Conforme Tabela 3, analisando somente as polpas de bacabá (20,2 h) e patauá (20,2 h) não houve diferença significativa para a estabilidade oxidativa. Por outro lado, entre os óleos das amêndoas houve diferença, visto que o óleo de bacabá apresentou apenas 0,2 h de estabilidade oxidativa. Pinto et al. (2018) avaliando o óleo da polpa de bacabá extraído por meio de CO2 supercrítico encontraram um período de indução de 339 minutos. Santos et al. (2020) analisando o óleo de patauá extraído por prensagem a frio verificaram que o tempo de indução foi de 2,79 h utilizando o Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland) com temperatura de 100°C e fluxo de ar de 10 L/h. O tempo de resistência oxidativa está diretamente relacionado ao grau de compostos insaturados, promovendo uma menor estabilidade do material contra a simulação de condições reais de trabalho, como atmosfera de ar e elevada temperatura (PARDAUIL et al., 2011).
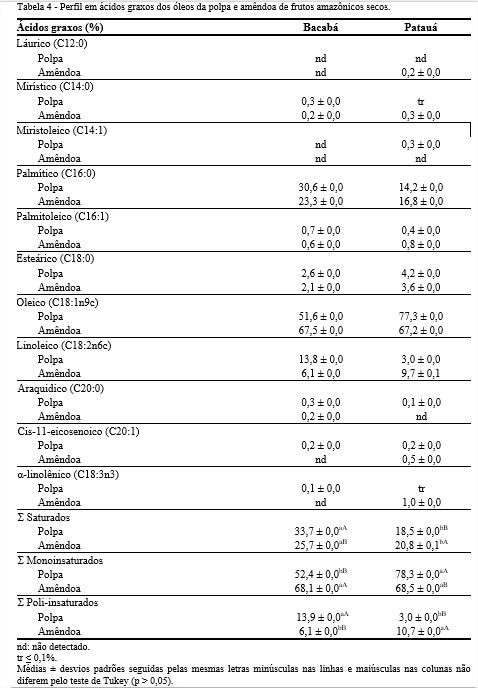
De acordo com o perfil de ácidos graxos apresentado na Tabela 4, os ácidos palmítico, palmitoleico, esteárico, oleico e linoleico estão presentes tanto nos óleos das polpas quanto das amêndoas, com o ácido oleico como o predominante.
Os ácidos poli-insaturados foram encontrados em menores quantidades do que os saturados e monoinsaturados, sobressaindo o linoleico no óleo da polpa de bacabá (13,8%). Com relação ao ácido graxo α-linolênico foram detectadas pequenas quantidades nos óleos da polpa de bacabá (0,1%) e da amêndoa de patauá (1,0%). O consumo de alimentos ricos em ácidos graxos, como bacaba e patauá, pode desempenhar um papel importante na base alimentar humana, pois os ácidos α-linolênico, linoleico e oleico são considerados funcionais e auxiliam na redução de inflamação e no aumento da imunidade do corpo humano (COSTA et al., 2017).
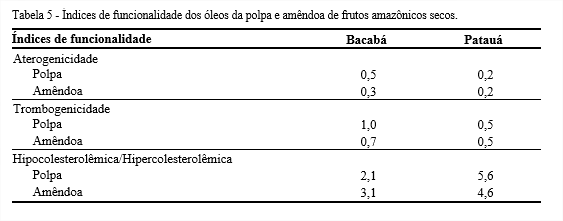
Por meio do perfil de ácidos graxos foi possível calcular os índices de funcionalidade dos óleos (Tabela 5), e verificou-se que o óleo de patauá mostrou menores índices de aterogenicidade e trombogenicidade, e, por outro lado, maiores valores de relação hipocolesterolêmica/hipercolesterolêmica, sobressaindo a polpa. De acordo com Barros et al. (2013), quanto menores os índices de aterogenicidade e trombogenicidade, maior a quantidade de ácidos graxos antiaterogênicos presentes em um determinado óleo, e, consequentemente, melhor a composição nutricional e funcional. Em contrapartida, a razão hipocolesterolêmica/hipercolesterolêmica deve ser inversamente proporcional aos outros índices, visto que elevados valores está relacionado à formação de lipoproteínas de alta densidade (SANTOS-SILVA; BESSA; SANTOS-SILVA, 2002).
Uma importante função dos carotenoides nos alimentos é a de pigmentação, sendo responsáveis pela cor amarela ou avermelhada da maioria dos óleos vegetais. Conforme a Tabela 6, os óleos de patauá mostraram maiores quantidades de carotenoides em relação ao de bacabá, principalmente o óleo da polpa (HERNÁNDEZ; FREGAPANE; MOYA, 2009).
Hernández, Fregapane e Moya (2009) obtiveram valor de 10,9 μg/g de carotenoides totais em óleos extraídos da polpa de patauá (Jessenia bataua), valor inferior ao encontrado no presente estudo. De acordo com a análise colorimétrica realizada por Santos et al. (2020), o óleo de patauá (Oenocarpus bataua) tendeu a uma coloração do verde ao amarelo. Segundo Ramadan e Mörsel (2003), essa diferença na quantidade de pigmentos ocorre, devido ao estádio de maturação do fruto, do processo de extração e das condições de estocagem do óleo.
Em relação aos teores de compostos fenólicos totais verificou-se que a quantidade foi significativamente superior nos óleos das amêndoas, destacando a de patauá com 4,0 mg/g. Segundo Coimbra e Jorge (2011b), em estudo realizado com frutos das palmeiras guariroba (Syagrus oleracea), jerivá (Syagrus romanzoffiana) e macaúba (Acrocomia aculeata), verificou-se que as amêndoas também apresentaram conteúdos de compostos fenólicos significativamente maiores do que as polpas.
Nos óleos vegetais, os tocoferóis protegem os ácidos graxos insaturados da oxidação lipídica, e no organismo humano apresentam atividade biológica de vitamina E. Nos óleos de polpa e amêndoa de bacabá não foi detectado nenhum isômero de tocoferóis, diferentemente dos óleos de patauá. Nesses óleos foi encontrado somente α-tocoferol, destacando-se o óleo de amêndoa com quantidade, aproximadamente, de 23 vezes a mais do que o óleo da polpa.
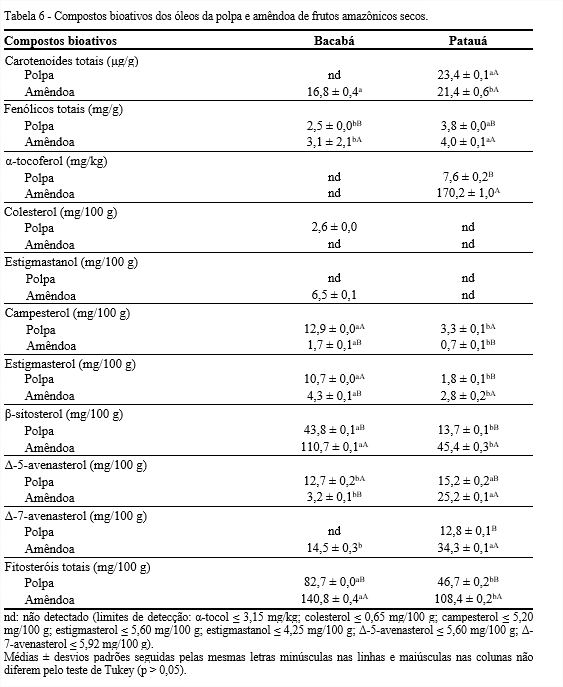
Os fitosteróis são os constituintes que estão presentes em menor quantidade na fração insaponificável da matéria vegetal. O colesterol e o estigmastanol foram detectados somente nos óleos da polpa e amêndoa de bacabá, respectivamente. O campesterol, estigmasterol, β-sitosterol e Δ-5-avenasterol foram encontrados em todos os óleos, sendo o β-sitosterol o mais abundante, destacando-se o da amêndoa de bacabá (110,7 mg/100 g). A maioria dos óleos vegetais contém de 100-1.500 mg/100 g de óleo, sendo o β-sitosterol presente em maior quantidade (FERNANDES; CABRAL, 2007).
Segundo alguns estudos, óleos extraídos de frutos apresentam significativas fontes de fitosteróis. A quantidade de fitosteróis totais foi significativamente maior nos óleos das amêndoas do que das polpas, destacando o de bacabá (140,8 mg/100 g).
Capacidade antioxidante
Os antioxidantes impedem a formação de espécies reativas de oxigênio e espécies de nitrogênio que podem facilitar a aparecimento de diversas doenças no corpo humano (COSTA et al., 2017). Vários métodos devem ser utilizados para medir a capacidade antioxidante dos óleos, visto que cada teste se baseia em um parâmetro diferente (mecanismos, substratos, radicais) (REZAIRE et al., 2014). Como mostra a Tabela 7, os óleos dos frutos amazônicos apresentaram comportamentos distintos entre os sistemas DPPH•, FRAP e ABTS•+.
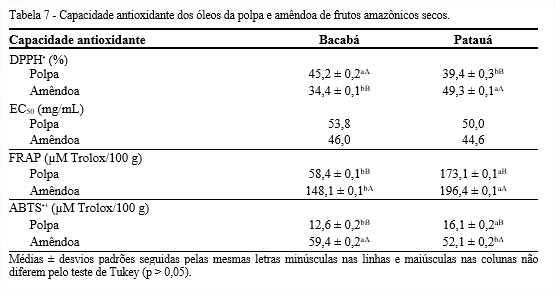
Em geral, os óleos demonstraram capacidade sequestradora do radical DPPH•, no entanto, os óleos da polpa de bacabá e da amêndoa de patauá foram os menos efetivos. A quantidade de óleo necessária para decrescer em 50% o DPPH• variou de 44 a 53 mg/mL. Em estudo realizado por Hernández, Fregapane e Moya (2009), com óleo extraído da polpa de patauá, foi encontrado EC50 de 46,7 mg/mL; tal valor se aproxima do obtido no presente estudo. O método FRAP mostrou diferenças significativas entre os frutos, destacando-se o óleo da amêndoa do patauá com 196,4 µM Trolox/100 g. Para o sistema da capacidade antioxidante por meio do ABTS•+, os óleos das polpas dos frutos amazônicos apresentaram valores bem inferiores aos óleos das amêndoas, sendo a maior atividade antioxidante encontrada no óleo de amêndoa de bacabá, 59,4 µM Trolox/100 g. Pinto et al. (2018) analisando a capacidade antioxidante por meio do ABTS•+ de óleo de polpa de bacabá extraído sob as condições de 60°C e 42 bar de pressão, encontraram 20,69 µM Trolox/100 g, enquanto Abadio Finco et al. (2012) obtiveram 3294,55 µM Trolox/100 g. Essa diferença nos valores pode estar relacionada a presença de compostos de maior polaridade, como as antocianinas, que por sua vez, não foi totalmente extraída devido ao tipo de solvente utilizado na extração do óleo.
CONCLUSÕES
As polpas e amêndoas dos frutos analisados mostraram-se bastante distintas em sua composição centesimal. Nas polpas, os constituintes principais foram os lipídios e as proteínas, enquanto nas amêndoas as fibras perfazem mais de 50% da composição.
As propriedades físico-químicas dos óleos extraídos das polpas de bacabá e patauá foram comparáveis as de óleos convencionais e de boa qualidade. Em relação aos ácidos graxos, os óleos da amêndoa de bacabá e polpa de patauá mostraram ser mais insaturados com predominância do ácido graxo oleico. Apenas os óleos de patauá apresentaram tocoferóis, enquanto, somente os de bacabá mostraram quantidades significativas de colesterol e estigmastanol. Os óleos mostraram ter capacidade antioxidante para inibir os radicais livres gerados durante a peroxidação do ácido linoleico, além de sequestrar radicais livres, pela interação com o radical DPPH•.
Assim, conclui-se que esses frutos amazônicos podem ser utilizados para a extração de óleos, visto que fornecem benefícios quando consumidos, como combate aos radicais livres in vivo. Além disso, podem ser utilizados como matéria-prima nas indústrias alimentícia, farmacêutica e cosmética.
AGRADECIMENTOS
Os autores agradecem à Coordenação de Aperfeiçoamento Pessoal de Nível Superior (CAPES), pela bolsa de doutorado e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela concessão do auxílio à pesquisa e bolsa de produtividade.
REFERÊNCIAS
ABADIO FINCO, F. D. B.; KAMMERER, D. R.; CARLE, R.; TSENG, W. H.; BÖSER, S.; GRAEVE, L. Antioxidant activity and characterization of phenolic compounds from bacaba (Oenocarpus bacaba Mart.) Fruit by HPLC-DAD-MSn. Journal of Agricultural and Food Chemistry, Easton, v. 60, n. 31, p. 7665–7673, 2012.
AMERICAN OIL CHEMITS SOCIETY (AOCS). Official and tentative methods of the American Oil Chemists’ Society: including additions and revisions. 6. ed. Champaign, 2009.
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS (AOAC). Official and Tentative Methods of the AOAC International. Maryland, 2012.
BARROS, P. A. V.; GLÓRIA, M. B. A.; LOPES, F. C. F.; GAMA, M. A. S.; SOUZA, S. M.; MOURTHÉ, M. H. F.; LEÃO, M. I.Qualidade nutricional e estabilidade oxidativa de manteigas produzidas do leite de vacas alimentadas com cana-de-açúcar suplementada com óleo de girassol. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, Belo Horizonte, v. 65, n. 5, p. 1545-1553, 2013.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC n°. 269, de 22 de setembro de 2005. Diário Oficial da União; Poder Executivo, de 23 de setembro de 2005. Aprova o Regulamento técnico sobre a Ingestão Diária Recomendada (IDR) de proteína, vitaminas e minerais. Brasília, 2005a.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC n° 270, de 22 de setembro de 2005. Diário Oficial da União; Poder Executivo, de 23 de setembro de 2005. Aprova o Regulamento técnico para óleos vegetais, gorduras vegetais e creme vegetal. Brasília, 2005b.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC n°. 87, de 15 de Março de 2021. Diário Oficial da União; Poder Executivo, de 15 de Março de 2021. Estabelece a Lista de espécies vegetais autorizadas, as designações, a composição de ácidos graxos e os valores máximos de acidez e de índice de peróxidos para óleos e gorduras vegetais. Brasília, 2021.
BRINKMANN, B. Quality criteria of industrial frying oils and fats. European Journal of Lipid Science and Technology, Weinheim, v. 102, n. 8-9, p. 539-541, 2000.
COIMBRA, M. C.; JORGE, N. Characterization of the pulp and kernel oils from Syagrus oleracea, Syagrus romanzoffiana, and Acrocomia aculeate. Journal of Food Science, Chicago, v. 76, n. 8, p. 1156-1161, 2011a.
COIMBRA, M. C.; JORGE, N. Fatty acids and bioactive compounds of the pulps and kernels of Brazilian palm species, guariroba (Syagrus oleraces), jerivá (Syagrus romanzoffiana) and macaúba (Acrocomia aculeata) fruits. Journal of the Science of Food and Agriculture, London, v. 92, n. 3, p. 679-684, 2011b
COSTA, W. A.; OLIVEIRA, M. S.; SILVA, M. P.; CUNHA, V. M. B.; PINTO, R. H. H.; BEZERRA, F. W. F.; JUNIOR, R. N. C. Açaí (Euterpe oleracea) and Bacaba (Oenocarpus bacaba) as Functional Food. In: WAISUNDARA, V.; SHIOMI, N. Superfood and Functional Food – An Overview of Their Processing and Utilization. London: InTechopen, 2017. p. 60.
COSTA-SINGH, T.; BITENCOURT, T. B.; JORGE, N. Caracterização e compostos bioativos do óleo da castanha de Cotia (Couepia edulis). Revista do Instituto Adolfo Lutz, São Paulo, v. 71, n. 1, p. 61-68, 2012.
DUCHATEAU, G. S. M. J. E.; BAUER-PLANK, C. G.; LOUTER, A. J. H.; VAN DER HAM, M.; BOERMA, J. A.; VAN ROOIJEN, J. J. M.; ZANDBELT, P. A. Fast and accurate method for total 4-desmethy sterol’s, content in spreads, fat-blends and raw materials. Journal of American Oil Chemists’ Society, Chicago, v. 79, p. 273-278, 2002.
GOMES-SILVA, D. A. P; WADT, L. H. O.; EHRINGHAUS, C. Ecologia e manejo de patauá (Oenocarpus bataua Mart.) para produção de frutos e óleo. 1 ed. Rio Branco: Embrapa Acre, 2004. 37 p.
HERNÁNDEZ, P. B. N.; FREGAPANE, G.; MOYA, M. D. S. Bioactive compounds, volatiles and antioxidant activity of virgin seje oils (Jessenia bataua) from the Amazonas. Journal of Food Lipids, Trumbull, v. 16, n. 4, p. 629-644, 2009.
JORGE, N.; SILVA, A. C.; VERONEZI, C. M. Syagrus romanzoffiana. In: LIMA, F. F.; LESCANO, C. H.; OLIVEIRA, I. P. (Eds). Fruits of the Brazilian Cerrado: composition and functional benefits, 1 ed. Switzerland: Springer, 2021, 192 p.
KALANTZAKIS, G.; BLEKAS, G.; PEGKLIDOU, K.; BOSKOU, D. Stability and radicalscavenging activity of heated olive oil and other vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, p. 329-335, 2006.
MARTORANO, L. G.; OLIVEIRA, M. S. P.; LISBOA, L. S. S.; OLIVEIRA, A. H. M. Ocorrência de populações de palmeiras do gênero Oenocarpus associada às condições topoclimáticas de Terra Santa, Pará. 1 ed. Belém: Embrapa Amazônica Oriental, 2016. 43 p.
MERRIL, A. L.; WATT, B. K. Energy value of foods: basis and derivation. Washington:United States Department of Agriculture, 1973. 105 p.
NOGUEIRA, R. C.; CERQUEIRA, H. F.; SOARES, M. B. P. Patenting bioactive molecules from biodiversity: the Brazilian experience. Expert Opinion on Therapeutic Patents, Toscana, v. 20, n. 2, p. 1-13, 2010.
PARDAUIL, J. J. R.; SOUZA, L. K. C.; MOLFETTA, F. A.; ZAMIAN, J. R.; ROCHA FILHO, G. N.; DA COSTA, C. E. F. Determination of the oxidative stability by DSC of vegetable oils from the Amazonian area. Bioresource Technology, Lucknow, v. 102, p. 5873-5877, 2011.
PARRY, J.; LUTHER, M.; ZHOU, K.; YURAWECZ, M. P.; WHITTAKER, P.; YU, L. Fatty acid composition and antioxidant properties of cold-pressed marionberry, boysenberry, red raspberry, and blueberry seed oils. Journal of Agricultural and Food Chemistry, Easton, v. 53, n. 6, p. 566-573, 2005.
PINTO, R. H. H.; SENA, C.; SANTOS, O. V.; COSTA, W. A.; RODRIGUES, A. M. C.; CARVALHO JUNIOR, R. N. Extraction of bacaba (Oenocarpus bacaba) oil with supercritical CO2: global yield isotherms, fatty acid composition, functional quality, oxidative stability, spectroscopic profile and antioxidant activity. Grasas y Aceites, Seville, v. 69, n. 2, p. 1-8, 2018.
PROSKY, L.; ASP, N. G.; SCHWEIZER, T. F.; DEVRIES, J. W.; FURDA, I. Determination of insoluble and soluble dietary fibers in foods and food products. Journal of the Association of Official Analytical Chemists International, Oxford, v. 75, p. 360-367, 1992.
RAMADAN, M. F.; MÖRSEL, J. T. Oil cactus pear (Opuntia ficus-indica L.). Food Chemistry, London, v. 82, n. 3, p. 339-345, 2003.
RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A.; YANG, M.; RICE-EVANS, C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology & Medicine, New York, v. 26, p. 1231-1237, 1999.
REZAIRE, A.; ROBINSON, J. C.; BEREAU, D.; VERBAERE, A.; SOMMERER, N.; KHAN, M. K.; DURAND, P.; PROST, E.; FILS-LYCAON, B. Amazonian palm Oenocarpus bataua (‘‘patawa’’): Chemical and biological antioxidant activity – Phytochemical composition. Food Chemistry, London, v. 149, n.1, p. 62-70, 2014.
RODRIGUEZ-AMAYA, D. B. A guide to carotenoids analysis in food. Washington: ILSI Press, 2004. 71 p.
SANTOS, O. V.; GONÇALVES, B. S.; MACÊDO, C. S.; CONCEIÇÃO, L. R. V.; COSTA, C. E. F.; MONTEIRO JUNIOR, O. V.; SOUZA, A. L. G.; LANNES, S. C. S. Evaluation of quality parameters and chromatographic, spectroscopic, and thermogravimetric profile of Patauá oil (Oenocarpus bataua). Food Science and Technology, Campinas, v. 40, p. 76-82, 2020.
SANTOS-SILVA, J.; BESSA, R. J. B.; SANTOS-SILVA, F. Effect of genotype, feeding system and slaughter weight on the quality of light lambs: II fatty acid composition of meat. Livestock Production Science, Villaviciosa, v. 77, p. 187-194, 2002.
SCHWARTZBERG, H. G. Leaching-organic material. In: ROSSEAU, R. Handbook of Separation Process Technology. New York: J. Wiley, 1010 p.1987.
SILVA, F. A. M.; BORGES, M. F. M.; FERREIRA, M. A. Métodos para avaliação do grau de oxidação lipídica e da capacidade antioxidante. Química Nova, São Paulo, v. 22, n. 1, p. 94-103, 1999.
SINGLETON, V. L.; ROSSI, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture, Davis, v. 16, p. 144-158, 1965.
SZYDLOWSKA-CZERNIAK, A.;, KARLOVITS, G.; DIANOCZKI, C.; RECSEG, K.; SZLYK, E. Comparison of two analytical methods for assessing antioxidant capacity of rapeseed and olive oils. Journal of the American Oil Chemists’ Society, Chicago, v. 85, p. 141-149, 2008.
ULBRICHT, T. L. V.; SOUTHGATE, D. A. T. Coronary heart disease: seven dietary factors. Lancet, London, v. 338, p. 985-992, 1991. YABUUCHI, Y.; MATSUSHITA, Y.; OTSUKA, H.; FUKAMACHI, K.; KOBAYASHI, Y. Effects of supplemental lauric acid-rich oils in high-grain diet on in vitro rumen fermentation. Animal Science Journal, Musashino, v. 77, n. 3, p. 300-307, 2006.


