
SEMENTES DE MAMÃO (Carica papaya L.) E MELÃO (Cucumis melo L.) COMO FONTE PROMISSORA DE ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS E CAPACIDADE ANTIOXIDANTE
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Carolina Médici Veronezi1; Neuza Jorge2*
1Pós-doutoranda do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected].
Resumo: A busca por fontes alternativas para extração de óleos vegetais cresce a cada ano, visto que a população procura por óleos saudáveis e com elevada estabilidade oxidativa. Assim, o trabalho teve como objetivo caracterizar os óleos de soja (S), mamão (Ma), melão (Me) e os compostos SMa (80:20 p/p); SMe (80:20 p/p) e SMaMe (60:20:20 p/p/p) quanto às propriedades físico-químicas e capacidade antioxidante. O óleo composto SMaMe, mostrou menores índices de acidez e peróxidos, enquanto o de mamão apresentou elevada estabilidade oxidativa. O óleo SMaMe também se destacou com elevada quantidade de carotenoides e vitamina A. Por outro lado, o óleo de melão apresentou maiores quantidades de compostos fenólicos e fitosteróis totais. Pode-se verificar grande potencial para o uso das sementes de mamão e melão, afim de valorizar os resíduos agroindustriais e, principalmente, elevar a estabilidade oxidativa e o valor nutricional do óleo de soja.
Palavras-chave: óleos compostos; resíduos agroindustriais, Carica papaya L.; Cucumis melo L.
INTRODUÇÃO
Alguns óleos vegetais apresentam limites de utilização em consequência da composição química e do elevado custo. Assim, com o aumento da busca por óleos vegetais saudáveis e com maior estabilidade oxidativa surgiram os óleos compostos, que são produtos obtidos a partir de misturas de óleos de duas ou mais espécies vegetais (O’BRIEN, 2008).
Embora a soja seja uma das matérias-primas mais utilizadas para a produção de óleos vegetais, existem sementes de frutos que são descartadas como resíduos agroindustriais e/ou subutilizadas como rações animais, que podem ser de grande utilidade para o setor industrial, devido à presença de óleos com relevâncias nutricionais, como as sementes de mamão e melão (SALAS et al., 2000).
As sementes de mamão têm elevados teores de lipídios (29%) e proteínas (25%). O conteúdo lipídico é considerado economicamente atrativo para as indústrias de extração de óleos vegetais, quando comparado com oleaginosas como soja e milho, visto que o óleo de mamão é rico em ácidos graxos monoinsaturados (72%), predominantemente o ácido oleico (ZHANG; CHEN, 2017; SANTANA et al., 2019). Além disso, tanto a polpa quanto as sementes de mamão apresentam ação antioxidante, anti-hipertensiva, hipoglicemiantes e hipolipemiantes, podendo contribuir para a prevenção e tratamento da obesidade e distúrbios metabólicos associados (SANTANA et al., 2019), devido a presença de substâncias bioativas como fitosteróis, carotenoides e compostos fenólicos totais (MALACRIDA; KIMURA; JORGE, 2011).
As sementes de melão apresentam elevadas quantidades de lipídios (25%), proteínas (20%) e fibras (30%). O óleo de sementes de melão apresenta ácidos graxos com cadeias de C6 a C24 (MARTINS, 1999; GILL et al., 2011). Possui também compostos bioativos, como carotenoides (6,3 μg β-caroteno/g), compostos fenólicos (130,7 mg EAG/kg), fitosteróis (327,3 mg/100 g) e tocoferóis (207,2 mg/kg) (SILVA; JORGE, 2014).
A investigação de óleos especiais, formulados a partir da combinação de óleos vegetais em proporções diversas é uma área de pesquisa emergente ainda pouco explorada. Neste contexto, visando a utilização destas sementes para fins alimentícios e redução do impacto ambiental, o objetivo deste trabalho foi avaliar por meio das propriedades físico-químicas e capacidade antioxidante, o potencial das sementes como fontes alternativas na formulação de óleos compostos.
MATERIAL E MÉTODOS
Material
Foram utilizadas sementes de mamão (Carica papaya L.), variedade Formosa (cultivar Mamão-formosa) e melão (Cucumis melo L.), variedade Inodorus (cultivar amarelo). As sementes de mamão foram cedidas por uma empresa localizada em Jundiaí-SP, enquanto as de melão foram obtidas de frutos adquiridos no Centro Estadual de Abastecimento de São José do Rio Preto-SP, porém provenientes da região Nordeste brasileira. As sementes foram secas em estufa com circulação de ar forçado (Marconi, modelo MA 035) a 40 ± 0,5°C/48 h e armazenadas ao abrigo de luz em recipientes de vidro vedados com tampas de rosca até a extração dos óleos.
Para a extração dos óleos, os 10 kg de sementes de mamão e melão foram laminadas em mini prensa (MPE 40, Ecirtec, Bauru, São Paulo, Brasil). Após a laminação foi realizada a extração por solvente em quatro etapas. Foram utilizados 20 L de hexano em temperatura de 45-50ºC em cada etapa. Na primeira, o hexano circulou por 20 min., na segunda e terceira por 15 min e na última por 10 min. Depois da extração, o solvente foi removido com aplicação de vapor direto e indireto, além de vácuo de 200 mmHg/3 h. As porcentagens de óleos extraídos das sementes de mamão e melão foram 11,7 e 15,3%, respectivamente. Este processo de extração foi realizado no Instituto de Tecnologia de Alimentos (Campinas, São Paulo, Brasil).
Também foi utilizado o óleo de soja sem adição de antioxidantes sintéticos fornecido por uma empresa localizada em Itápolis-SP. A seguir, foram formulados os óleos compostos, conforme mostra a Tabela 1.

Métodos
Propriedades físico-químicas
Para as determinações de ácidos graxos livres, índices de peróxidos, refração, iodo, saponificação, estabilidade oxidativa e matéria insaponificável foram utilizados os métodos da AOCS (2009).
O perfil de ácidos foi realizado por cromatografia em fase gasosa a partir dos óleos esterificados pelo método descrito por Hartman e Lago (1973). Foi utilizado um cromatógrafo a gás (modelo CG 3900, Varian, Walnut Creek, Estados Unidos) com coluna capilar de sílica fundida (CP-Sil 88 de 60 m de comprimento, com diâmetro interno de 0,25 mm e espessura do filme de 0,20 µm), detector de ionização de chama, injetor split e amostrador automático. O gás de arraste foi o hidrogênio com velocidade linear de 30 mL/min., a temperatura da coluna iniciada em 90°C/10 min., com aumento de 10ºC/min. até 195°C e mantida em isoterma por 16 min. As temperaturas utilizadas no injetor e detector foram 230 e 250ºC, respectivamente, e razão de divisão de 1:30. A identificação dos ácidos graxos foi realizada por comparação dos tempos de retenção das amostras teste com o tempo de retenção de padrões cromatográficos de ésteres metílicos. Utilizou-se como padrão uma mistura composta de 37 ésteres metílicos de ácidos graxos (Supelco, Bellefonte, Estados Unidos), de C4:0 a C24:1, com pureza entre 99,1 e 99,9%. Por meio de uma distribuição randômica, que leva em consideração o perfil de ácidos graxos, foi determinada a composição provável de triacilgliceróis utilizando o programa computacional desenvolvido por Antoniosi Filho, Mendes e Lanças (1995). Grupos com concentração total de triacilgliceróis menor que 0,5% não foram considerados.
Carotenoides totais foram determinados por espectrofotometria de varredura segundo metodologia descrita por Rodriguez-Amaya (2004). A quantificação foi calculada por meio da absorção no comprimento de onda de absorção máxima e valor de absortividade de 2592 em éter de petróleo, utilizando a equação: μg/g de óleo = [(Abs x 25 x 1000)/2592 x P], onde Abs representa a absorvância da amostra em λ = 450-477 nm, e P é o peso da amostra de óleo. A Vitamina A foi calculada de acordo com a relação de carotenoides provitamina A estabelecida pelo Instituto de Medicina, Alimentos e Nutrição, onde 1 retinol equivalente (RAE) = 1 µg retinol = 12 µg β-caroteno (IOM, 2001).
Os compostos fenólicos totais foram extraídos de acordo com o método proposto por Parry et al. (2005) e analisados conforme metodologia descrita por Singleton e Rossi (1965), utilizando reagente de Folin-Ciocalteu e curva padrão de ácido gálico (R2 = 0,998), sendo detectados a λ = 765 nm em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão) e os resultados expressos em mg EAG/g.
Antes da determinação de fitosteróis, os óleos foram saponificados, conforme metodologia descrita por Duchateau et al. (2002). Os teores de fitosteróis foram determinados conforme AOCS (2009), em cromatógrafo a gás (modelo Plus-2010, Shimadzu, Chiyoda-ku, Toquio, Japão) equipado com detector de ionização de chama, sistema de injeção split e coluna capilar de sílica fundida (Restek RTX 5, Shimadzu, Chiyoda-ku, Toquio, Japão). A temperatura do forno foi mantida em isoterma a 300°C/12 min. e as temperaturas utilizadas no injetor e no detector foram de 280 e 320°C, respectivamente. Os fitosteróis foram identificados por comparação com o tempo de retenção dos padrões com grau de pureza de 95-99% (Sigma-Aldrich, St. Louis, MO), analisados nas mesmas condições das amostras. A quantificação de cada um dos isômeros foi efetuada por normalização interna (5α-cholestano-3β-ol), com base nas áreas dos picos e os resultados expressos em mg/100 g.
A composição de tocoferóis, utilizando o método da AOCS (2009) foi realizada em cromatógrafo líquido de alta eficiência (modelo 210-263, Varian, Walnut Creek, Estados Unidos), com detector de fluorescência, coluna de aço inox empacotada com sílica (100 Si, Microsorb, Varian, Walnut Creek, Estados Unidos) e comprimentos de ondas de excitação e emissão de 290 e 330 nm, respectivamente. Os valores das concentrações foram calculados com base nas áreas dos picos de excitação da leitura e expressos em valores de cada isômero separadamente. Uma curva padrão de α-, β-, γ- e δ-tocoferol (Supelco, Bellefonte, Estados Unidos) com elevado grau de pureza foi elaborada para expressar o teor de tocoferóis em mg/kg. A Vitamina E foi calculada de acordo com o método descrito por McLaughlin e Weihrauch (1979), sendo os fatores de conversão os seguintes: α-tocoferol x 1,0; β-tocoferol x 0,40; γ-tocoferol x 0,10 e δ-tocoferol x 0,01, e o resultado expresso como equivalentes de α-tocoferol (mg/kg).
Capacidade antioxidante
A capacidade antioxidante foi realizada em espectrofotômetro (modelo UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão). A análise de DPPH• foi realizada de acordo com o método de Kalantzakis et al. (2006), sendo os resultados expressos em porcentagem. O método de captura do radical livre ABTS•+ foi realizado segundo Re et al. (1999) e o resultado expresso em µM Trolox/100 g. O método FRAP empregado foi o descrito por Szydlowska-Czerniak et al. (2008), cujos resultados foram expressos em μM Trolox/100 g. O sistema β-caroteno/ácido linoleico empregado foi o descrito por Marco (1968) e modificado por Miller (1971), expresso em % de inibição de radicais livres.
Análise estatística
Os resultados obtidos das determinações analíticas foram submetidos à análise de variância e as diferenças entre as médias foram testadas a 5% de probabilidade pelo teste de Tukey, por meio do programa ESTAT, versão 2.0 (BANZATTO; KRONKA, 2006).
RESULTADOS E DISCUSSÃO
Propriedades físico-químicas
O índice de acidez reflete o grau de conservação do óleo que está diretamente relacionado com a natureza e qualidade da matéria-prima, com os processos de extração e refinação, e, principalmente, com as condições de armazenamento, pois a decomposição dos glicerídeos é acelerada por ação enzimática, aquecimento e luminosidade (RIBEIRO; SERAVALLI, 2007). Quanto aos índices de acidez (Tabela 2), o Codex Alimentarium Commission (2009) admite até 4 mg KOH/g para óleos prensados a frio e não refinados, logo, apenas o óleo de mamão mostrou valor acima do recomendado. O elevado índice de acidez no óleo de mamão (11,0 mg KOH/g), foi provavelmente devido a qualidade inicial da matéria-prima recebida da indústria.
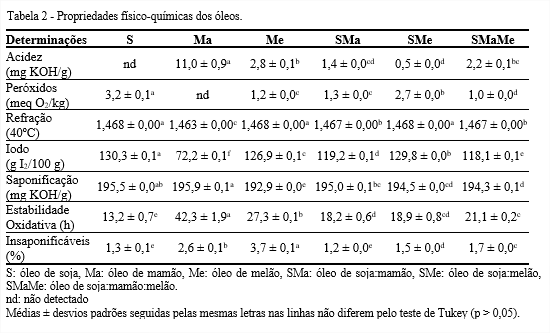
O índice de peróxidos é usado como parâmetro de qualidade para avaliar a formação de produtos da oxidação primária em óleos. Visto que, o Codex Alimentarium Commission (2009) estabelece índices de peróxidos de 10 e 15 meq O2/kg para óleos refinados e brutos, respectivamente; é possível verificar que os óleos apresentaram níveis de peróxidos dentro dos padrões estabelecidos por legislação. Porém, dentre os óleos estudados, o óleo de soja apresentou maior valor (3,2 meq O2/kg). De acordo com os ácidos graxos livres e índice de peróxidos, os óleos de soja, mamão e melão apresentaram maiores degradações hidrolítica e oxidativa do que os compostos SMa, SMe e SMaMe.
O índice de refração é um parâmetro que se refere ao peso molecular, comprimento de cadeia e grau de insaturação dos ácidos graxos. É afetado por alguns fatores como teor de ácidos graxos livres, oxidação e tratamento térmico (GUNSTONE, 2011). Nos óleos pesquisados foram obtidos índices de refração de 1,463 a 1,468, indicando que o óleo de mamão é mais estável que os demais, visto que apresentou menor índice de refração, ou seja, menor quantidade de insaturação.
O índice de iodo trata-se de um teste que indica o grau de insaturação do óleo. O óleo de mamão (72,2 g I2/100 g) foi o que apresentou menor valor. É possível que o óleo de mamão tenha influenciado os óleos compostos SMa (119,2 g I2/100 g) e SMaMe (118,1 g I2/100 g), que também apresentaram baixo índice de iodo, quando comparados ao óleo de soja (130,3 g I2/100 g).
Um índice de saponificação baixo sugere, ácidos graxos de pesos moleculares elevados, em média. Entre os óleos pesquisados, o menor índice de saponificação foi apresentado pelo óleo de melão (192,9 mg KOH/g).
O óleo mamão foi o mais resistente à oxidação, visto que apresentou 42,3 h de estabilidade oxidativa, o que pode estar atribuído à elevada presença de compostos antioxidantes e/ou ácidos graxos monoinsaturados. Pode-se verificar também, que os óleos de mamão e melão elevaram a estabilidade oxidativa do óleo de soja em 60%, visto que o SMaMe apresentou 21,1 h de estabilidade oxidativa.
A matéria insaponificável corresponde aos compostos presentes nos óleos, incluindo substâncias como esteróis, tocoferóis, pigmentos e hidrocarbonetos. Sendo assim, os óleos examinados devem conter elevadas quantidades destas substâncias, principalmente os de melão (3,7%) e de mamão (2,6%). Os óleos compostos apresentaram quantidades pequenas, porém maiores do que o óleo de soja, podendo inferir que beneficiaram o óleo de soja com compostos insaponificáveis.
Quanto ao perfil de ácidos graxos (Tabela 3) foram identificados dez diferentes ácidos graxos. Quanto à quantidade de ácidos graxos saturados, o óleo de mamão sobressaiu com 22,3%, destacando-se o ácido palmítico, que normalmente é o ácido graxo saturado mais abundante nos lipídios de origem vegetal.
Os monoinsaturados variaram de 21,9 a 71,7%. O óleo de mamão foi o único a apresentar ácido palmitoleico. Estudos realizados em animais têm sugerido que o consumo de ácido palmitoleico induz a saciedade, facilita a perda de peso e aumenta a sensibilidade à insulina (YANG; TAKEO; KATAYAMA, 2013). O óleo de mamão também apresentou elevada quantidade de ácido oleico, 71%, podendo ser considerado como alto oleico. Estudos demonstram que a presença de ácido oleico na dieta humana diminui os níveis da fração LDLc no sangue, a pressão sanguínea, além de melhorar as doenças inflamatórias (LOPEZ-HUERTAS, 2010).
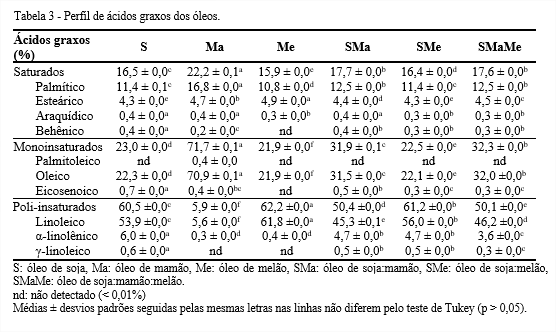
Os poli-insaturados oscilaram de 5,9 a 62,1%. Os óleos mostraram-se constituídos predominantemente por ácidos graxos insaturados, perfazendo mais de 75% do total. Dentre os ácidos graxos insaturados, os óleos compostos apresentaram consideráveis quantidades de ácidos graxos ω6 e ω3. Porém, o SMaMe, além desses ácidos graxos, mostrou elevada quantidade de ω9. Pode-se deduzir que esses óleos compostos são capazes de ajudar a diminuir os níveis de colesterol e triglicérides, regular a pressão arterial, reduzir as inflamações crônicas e o desenvolvimento de câncer, doença cardíaca e acidente vascular (PINAZO-DURAN; BOSCÁ-GOMAR, 2012).
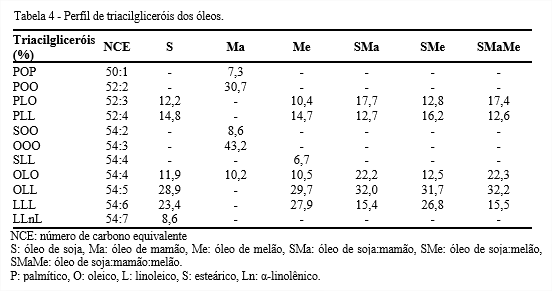
No perfil de triacilgliceróis (Tabela 4) nota-se que o óleo de mamão, exibiu uma composição de triacilgliceróis bem diferente dos demais, apresentando POP, POO, SOO, OOO, OLO, possivelmente por ser um óleo monoinsaturado e com baixa quantidade de ácido linoleico. Foi detectada maior presença dos triacilgliceróis OLL e LLL nos óleos, com exceção do óleo de mamão. Assim, verificou-se que as maiores quantidades de ácidos graxos dos óleos estudados são oleico e linoleico.
Verificou-se que o óleo de soja, possivelmente por ser um óleo refinado, apresentou baixa quantidade de carotenoides totais (Tabela 5). Porém, o óleo composto SMaMe apresentou elevada concentração de carotenoides totais (52,1 µg β-caroteno/g), seguidos pelos óleos de mamão (33,5 µg β-caroteno/g) e melão (31,3 µg β-caroteno/g). Assim, é possivel dizer que os óleos brutos contribuiram para aumentar a concentração de carotenoides, principalmente o de melão, visto que o óleo composto SMe mostrou maior quantidade de carotenoides totais do que o SMa.
Verificou-se que o óleo composto SMaMe apresentou elevada quantidade de vitamina A (434,2 µg retinol/100 g), devido a influência dos óleos de mamão e melão, que também mostraram altas quantidades quando comparados com o óleo de soja (120,2 µg retinol/100 g).
Em relação aos compostos fenólicos totais, o óleo de soja apresentou menor quantidade, 81,7 mg EAG/kg, enquanto os óleos de mamão e melão mostraram ser ricos nestes compostos, 119,7 e 145,3 mg EAG/kg, respectivamente. Quando o óleo de mamão foi adicionado ao óleo de soja, houve um efeito antagônico entre os compostos fenólicos, visto que o óleo composto SMa apresentou apenas 73,7 mg EAG/kg. Porém, o óleo de melão contribuiu para elevar a quantidade de compostos fenólicos totais do óleo de soja, uma vez que o composto SMe apresentou 102,8 mg EAG/kg e o SMaMe, 90,4 mg EAG/kg.
Verificou-se a presença de apenas quatro fitosteróis nos óleos estudados (Tabela 8), com destaque nas quantidades de β-sitosterol, que foi o único fitosterol encontrado em todos os óleos. O conteúdo de β-sitosterol variou de 310,5 a 797,1 mg/100 g, sobretudo no óleo de melão, seguido pelo de mamão e, consequentemente, pelo composto SMaMe. Porém, o óleo de soja se sobressaiu com elevadas quantidades de estigmasterol (22,8 mg/100 g) e campesterol (16,7 mg/100 g), podendo-se inferir que os óleos de mamão e melão colaboraram para elevar a quantidade de β-sitosterol do óleo de soja, porém não contribuíram no aumento de estigmasterol e campesterol.
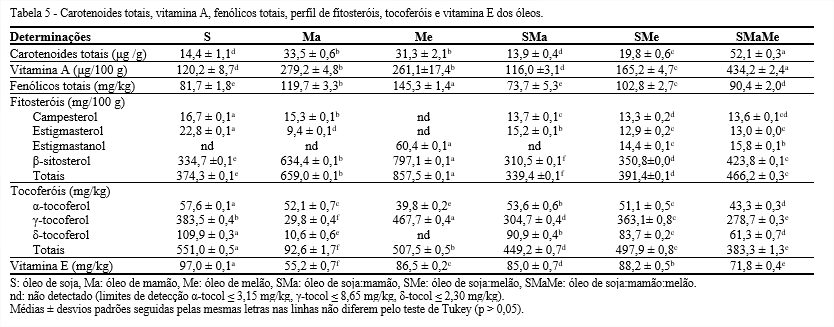
Quanto ao estigmastanol, um fitosterol saturado, apareceu apenas no óleo de melão (60,4 mg/100 g), e consequentemente nos compostos SMe (14,4 mg/100 g) e SMaMe (15,8 mg/100 g). Observa-se, nos fitosteróis totais, que os óleos compostos SMe e SMaMe apresentaram elevadas quantidades quando comparados com o óleo de soja, devido a quantidade de fitosteróis totais presentes no óleo de melão (857,5 mg/100 g).
A maioria dos alimentos de origem vegetal contém baixos níveis de vitamina E. No entanto, devido à abundância de alimentos derivados de plantas que constituem a dieta alimentar, é possível a ingestão de uma significativa quantidade desta vitamina. A vitamina E é considerada um dos principais antioxidantes, uma vez que protege as membranas das células de oxidação e de lipoproteínas de baixa densidade contra a peroxidação lipídica. O α-tocoferol é o isômero de maior atividade de vitamina E (SCHMIDT; POKORNÝ, 2005).
A quantidade de α-tocoferol foi maior no óleo de soja, consequentemente apresentou também maior teor de vitamina E. Porém, os óleos de melão e os compostos, SMa e SMe apresentaram teores significativos. Com excessão do óleo de mamão, o isômero majoritário presente nos óleos foi o γ-tocoferol. Esse isômero é um composto muito importante, pois tem propriedades anti-inflamatórias, anticancerígenas, alivia colite moderada, além disso, em combinação com a cessação do tabagismo melhora a função endotelial vascular, dentre outras propriedades (MAH et al., 2013).
O óleo de melão apresentou maior teor de γ-tocoferol, em contrapartida não exibiu δ-tocoferol. O óleo de mamão mostrou menor teor de tocoferóis totais, seguidos pelos compostos SMaMe e SMa. Esse baixo teor de tocoferóis deve ser devido a elevada quantidade de ácidos graxos saturados e/ou monoinsaturados, que promove proteção oxidativa ao óleo, não necessitando de elevada quantidade de antioxidantes naturais, como os tocoferóis.
Capacidade antioxidante
A determinação da capacidade antioxidante de um óleo pode depender da metodologia aplicada e do radical livre gerador ou oxidante utilizado nesta medida, por isso é importante combinar ao menos dois ou, se possível, todos os ensaios para a obtenção de informações mais completas quanto à capacidade antioxidante (CASTELO-BRANCO; TORRES, 2011).
Os óleos pesquisados demonstraram atividade sequestradora do radical DPPH• superior a 50%, atingindo valor máximo de 94,6% para o óleo de soja (Tabela 6). A concentração eficiente de antioxidante necessária para decrescer a concentração de DPPH• em 50% (CE50) variou de 43,4 a 51,3 mg/mL DPPH•, com destaque para o óleo de mamão, por apresentar menor CE50, consequentemente, elevada capacidade sequestrante.
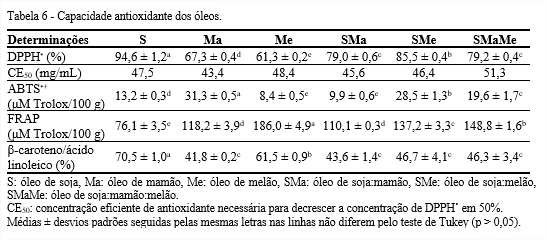
Em relação à atividade antioxidante dos óleos em eliminar o radical cromóforo ABTS•+, destacou-se o óleo de mamão (31,3 µM Trolox/100 g). Também, foi possível verificar que os óleos de mamão e melão contribuíram para aumentar a atividade antioxidante do óleo de soja, visto que o óleo composto SMaMe apresentou 19,6 µM Trolox/100 g. Embora, os ensaios DPPH• e ABTS•+ apresentam os mesmos mecanismos de reação, ou seja, agem por meio dos mecanismos de transferência de átomo de hidrogênio e de transferência de um elétron, os valores encontrados neste trabalho se diferem, pois o DPPH• não mede a capacidade antioxidante lipofílica e hidrofílica, enquanto o ABTS•+ faz as duas medidas (CASTELO-BRANCO; TORRES, 2011).
Quanto à capacidade antioxidante dos óleos em reduzir o complexo Fe+3-TPTZ a Fe+2-TPTZ detectada pelo FRAP, destacaram-se o óleo de melão (186 µM Trolox/100 g) e o composto SMaMe (148,8 µM Trolox/100 g). Além disso, conclui-se que os óleos de mamão e melão contribuíram para aumentar em 95% a atividade antioxidante do óleo de soja (76,1 µM Trolox/100 g). Essa metodologia determina a capacidade antioxidante na fração polar de óleos vegetais ricos em compostos fenólicos, assim, pode-se inferir que os óleos estudados devem ter elevada quantidade e/ou diferentes tipos de compostos fenólicos, visto que devido à diversidade de estruturas dos compostos fenólicos, cada um pode contribuir de maneira peculiar na atividade antioxidante (JARDINI et al., 2010).
Na análise de β-caroteno/ácido linoleico prevaleceu o óleo de soja. Em contrapartida, quando analisado apenas os óleos compostos, verificou-se que além de apresentarem menor atividade antioxidante do que o óleo de soja, não mostraram diferenças significativas entre si, podendo-se inferir que os óleos de mamão e melão não contribuíram diferentemente entre os óleos SMa, SMe e SMaMe. Essa metodologia é diferente das anteriores, pois a matriz da reação é uma emulsão, e em emulsões a maior eficiência protetora é realizada por antioxidantes lipofílicos (KIOKIAS; VARZAKAS; OREOPOULOU, 2008). Pode-se deduzir que esses óleos possuem elevadas quantidades de antioxidantes lipofílicos, como carotenoides e tocoferóis.
CONCLUSÕES
As propriedades físico-químicas dos óleos, principalmente os baixos valores de índices de acidez e peróxidos mostraram que os óleos compostos possuem boa qualidade. Os óleos de mamão, melão e os compostos mostraram-se ricos em carotenoides totais, vitamina A, compostos fenólicos e fitosteróis. Na análise de atividade antioxidante, não houve destaque de um único óleo, visto que as metodologias possuem mecanismos de reações diferentes.
Pode-se verificar grande potencial para o uso das sementes de mamão e melão como ingredientes e matéria-prima para a extração de óleos, valorizando os resíduos agroindustriais e principalmente elevando a estabilidade oxidativa do óleo de soja.
AGRADECIMENTOS
Os autores agradecem as empresas, pelo fornecimento de matérias-primas; ao Instituto de Tecnologia de Alimentos (ITAL), pela realização da extração dos óleos; e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa de produtividade.
REFERÊNCIAS
AMERICAN OIL CHEMITS SOCIETY (AOCS). Official and tentative methods of the American Oil Chemists’ Society: including additions and revisions. 6. ed. Champaign, 2009.
ANTONIOSI FILHO, N. R.; MENDES, O. L.; LANÇAS, F. M. Computer prediction of triacylglycerol composition of vegetable oils by HRGC. Chromatographia, New York, v. 40, p. 557-562, 1995.
BANZATTO, D. A.; KRONKA, S. N. Experimentação agrícola. 4. ed. Jaboticabal: Funep, 2006. 237 p.
CASTELO-BRANCO, V. N.; TORRES, A. G. Capacidade antioxidante total de óleos vegetais comestíveis: determinantes químicos e sua relação com a qualidade dos óleos. Revista de Nutrição, Campinas, v. 24, n. 1, p. 173-187, 2011
CODEX ALIMENTARIUM COMMISSION. Codex Stan 210-1999: codex standard for named vegetable oils. Rome, 2009.
DUCHATEAU, G. S. M. J. E; BAUER-PLANK, C. G.; LOUTER, A. J. H.; HAM, M.; BOERMA, M.; ROOIJEN, J. J. M.; ZANDBELT, P. A. Fast and accurate method for total 4-desmethy sterol’s, content in spreads, fat-blends and raw materials. Journal of the American Oil Chemists’ Society, Chicago, v. 79, n. 3, p. 273-278, 2002.
GILL, N. S.; BAJWA, J.; DHIMAN, K.; SHARMA, P.; SOOD, S.; SHARMA, P. D.; SINGH, B.; BALI, M. Evaluation of therapeutic potential of traditionally consumed Cucumis melo seeds. Asian Journal of Plant Sciences, Faisalabad, v. 10, n. 1, p. 86-91, 2011.
GUNSTONE, F. D. Vegetable oils in food technology: composition, properties and uses. 2 ed. Oxford:Wiley-Blackwell, 2011, 376 p.
HARTMAN, L.; LAGO, R. C. A. Rapid preparation of fatty acid methyl esters from lipids. Laboratory Practice, London, v. 22, n. 1, p. 475-476, 1973.
IOM. Dietary Reference Intakes: for vitamin a, vitamin k, arsenic, boron, cromium, copper, iodine, iron, manganese, molybdenium, nickel, silicon, vanadium and zinc. Washington: National Academy Press, 2001, 797 p.
JARDINI, F. A.; LIMA, A.; MENDONÇA, R. M. Z.; PINTO, R. J.; MANCINI, D. A. P.; MANCINI-FILHO, J. Phenolic compounds from pulp and seeds of pomegranate (Punica granatum, L.): antioxidant activity and protection of MDCK cells. Alimentos e Nutrição, Araraquara, v. 21, n. 4, p. 509-517, 2010.
JIANG, Q.; JIANG, Z.; HALL, Y. J.; JANG, Y.; SNYDER, P. W.; BAIN, C.; HUANG, J.; JANNASCH, A.; COOPER, B.; WANG, Y.; MORELAND, M. Gamma-tocopherol attenuates moderate but not severe colitis and suppresses moderate colitis-promoted colon tumorigenesis in mice. Free Radical Biology and Medicine, Los Angeles, v. 65, n. 1, p. 1069-1077, 2013.
KALANTZAKIS, G.; BLEKAS, G.; PEGKLIDOU, K.; BOSKOU, D. Stability and radical-scavenging activity of heated olive oil and other vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, n. 4, p. 329-335, 2006.
KIOKIAS, S.; VARZAKAS, T.; OREOPOULOU, V. In vitro activity of vitamins, flavonoids and natural phenolic antioxidants against the oxidative deterioration of oil-based systems. Critical Reviews in Food Science and Nutrition, Boca Raton, v. 48, n. 1, p. 78-93, 2008.
LOPEZ-HUERTAS, E. Health effects of oleic acid and long chain omega-3 fatty acids (EPA and DHA) enriched milks. A review of intervention studies. Pharmacological Research, Milano, v. 61, n.1, p. 200-207, 2010.
MAH, E.; PEI, R.; GUO, Y.; BALLARD, K. D.; BARKER, T.; ROGERS, V. E.; PARKER, B. A.; TAYLOR, A. W.; TRABER, M. G.; VOLEK, J. S.; BRUNO, R. S. γ-Tocopherol-rich supplementation additively improves vascular endothelial function during smoking cessation. Free Radical Biology and Medicine, Califórnia, v. 65, p. 1291-1299, 2013.
MALACRIDA, C.R.; KIMURA, M.; JORGE, N. Characterization of a high oleic oil extracted from papaya (Carica papaya L.) seeds. Ciência e Tecnologia de Alimentos, Campinas, v. 31, n. 4, p. 929-934, 2011.
MARCO, G. J. A rapid method for evaluation of antioxidants. Journal of the American Oil Chemists´Society, Chicago, v. 45, n. 9, p. 594-598, 1968.
MARTINS, M. L. S. M. Obtenção e caracterização de óleo de sementes de alguns cultivares de melão (Cucumis melo L.) produzidos na região Nordeste. 1999. 107 f. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Centro de Tecnologia, Universidade Federal da Paraíba, João Pessoa, 1999.
MCLAUGHLIN, P. J.; WEIHRAUCH, J. L. Vitamin E content of foods. Journal of the American Dietetic Association, v. 75, n. 6, p. 647-665, 1979.
MILLER, H. E. A simplified method for the evaluation of antioxidants. Journal of the American Oil Chemists´Society, Chicago, v. 48, n. 2, p. 91, 1971.
O’BRIEN, R. D. Fats and oils: formulating and processing for applications. 3 ed. Boca Raton: CRC Press, 2008. 680 p.
PARRY, J.; LUTHER, M.; ZHOU, K.; YURAWECZ, M. P.; WHITTAKER, P.; YU, L. Fatty acid composition and antioxidant properties of cold-pressed marionberry, boysenberry, red raspberry, and blueberry seed oils. Journal of Agricultural and Food Chemistry, Easton, v. 53, n. 6, p. 566-573, 2005.
PINAZO-DURAN M. D.; BOSCÁ-GOMAR L. Anti-inflammatory properties of polyunsaturated fatty acid omega 3 Indications in ophthalmology. Archivos de la Sociedad Española de Oftalmología, Barcelona, v. 87, n. 8, p. 203-220, 2012.
PRIOR, R. L.; WU, X.; SCHAICH, K. Standardized methods for de determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry, Easton, v. 53, n. 10, p. 4290-4302, 2005.
RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A. S.; YANG, M.; RICE-EVANS, C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology & Medicine, New York, v. 26, n. 9, p. 1231-1237, 1999.
RIBEIRO, E. P.; SERAVALLI, E. A. G. Química de alimentos. 2 ed. Instituto Mauá de Tecnologia. São Paulo: Edgar Blucher Ltda, 2007. 196 p.
RODRIGUEZ-AMAYA, D. B. A guide to carotenoids analysis in food. Washington: ILSI Press, 2004. 71 p.
SALAS, J. J.; SÁNCHEZ, J.; RAMLI, U. S.; MANAF, A. M.; WILLIAMS, M.; HARWOOD, J. L. Biochemistry of lipid metabolism in olive and other oil fruits. Progress in Lipid Research, Oxford, v. 39, n. 2, p. 151-180, 2000.
SANTANA, L. F.; INADA, A. C.; SANTO, B. L. S. E.; FILIÚ, W. F. O.; POTT, A.; ALVES, F. M.; GUIMARÃES, R. C. A.; FREITAS, K. C.; HIANE, P. A. Nutraceutical potential of Carica papaya in metabolic syndrome, Nutrients v. 11, n. 7, p. 1-19, 2019.
SCHMIDT, S.; POKORNÝ, J. Potential application of oilseeds as sources of antioxidants for food lipids – a review. Czech Journal of Food Science, Praha, v. 23, n. 3, p. 93-102, 2005.
SILVA, A. C.; JORGE, N. Bioactive compounds of the lipid fractions of agro-industrial waste. Food Research International, Campinas, v. 66, n. 1, p. 493-500, 2014.
SINGLETON, V. L.; ROSSI, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture, Davis, v. 16, p. 144-158, 1965.
SZYDŁOWSKA-CZERNIAK, A.; TROKOWSKI, K.; KARLOVITS, G.; SZŁYK, E. Effect of refining processes on antioxidant capacity, total contents of phenolics and carotenoids in palm oils. Food Chemistry, London, v. 129, n. 3, p. 1187-1192, 2011.
YANG, Z. H.; TAKEO, J.; KATAYAMA, M. Oral administration of omega-7 palmitoleic acid induces satiety and the release of appetite-related hormones in male rats. Appetite, Durham, v. 65, p. 1-7, 2013.
ZHANG, T.; CHEN, W. The Candida albicans inhibitory activity of the extract from papaya (Carica papaya L.) seed relates to mitochondria dysfunction. International Journal of Molecular Sciences, v. 18, n. 9, p. 1-11, 2017.
