
RISCO POTENCIAL ASSOCIADO A OCORRÊNCIA DE AFLATOXINA M1 EM LEITE CRU REFRIGERADO
Capítulo de livro publicado no livro: Ciência e tecnologia de alimentos: Pesquisas e avanços. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062060-35
Este trabalho foi escrito por:
Cristina Hallal de Freitas, *; Karen Vanessa Marimon Sibaja, ; Giniani Carla Dors* ; Eliana Badiale-Furlong ; Rosana Basso Kraus ; Pedro Rassier dos Santos ; Patricia da Silva Nascente
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: A aflatoxina M1 é uma micotoxina resultante da hidroxilação da aflatoxina B1 que pode ocorrer no leite após a ingestão de ração contaminada pelo animal. Este trabalho apresenta um estudo piloto realizado no sul do Rio Grande do Sul com a coleta de 23 amostras de leite de tanques de refrigeração de seis propriedades de pequeno porte. As amostras foram avaliadas quanto a presença das aflatoxinas M1 e B1 utilizando o método de QuEChERS para extração e a cromatografia líquida de alta eficiência com detector de fluorescência para a quantificação. A aflatoxina M1 foi detectada em 78% das amostras, com níveis que variaram de 0,34 a 1,1 μg L-1. Das amostras contaminadas, 67% apresentaram valores acima do limite máximo permitido pela legislação brasileira para leite fluído (0,5 μg L-1). Foi realizada uma projeção de avaliação de risco potencial levando-se em consideração o nível médio de contaminação do leite por aflatoxina M1 encontrado neste estudo (0,63 μg L-1) e a estimativa da ingestão diária (EID) calculada foi de 3,0 e 10,0 ng Kg-1massa corporal dia-1 para adultos e crianças, respectivamente. A EID para adultos está de acordo com o Comitê de Especialistas da FAO/OMS, porém o valor obtido para crianças é, aproximadamente, três vezes maior. A partir dos resultados obtidos fica evidente a necessidade de investimento em treinamento para pequenos produtores leiteiros, além do acompanhamento na implementação de Boas Práticas, sendo esta a principal maneira de prevenir a contaminação por micotoxinas, consideradas contaminantes naturais e inevitáveis.
Palavras–chave: aflatoxinas; HPLC-FL; QuEChERS
INTRODUÇÃO
O leite é considerado um alimento completo em termos nutricionais, sendo fonte de proteínas, lipídios, carboidratos, minerais e vitaminas que contribuem para à manutenção da saúde humana (1) e o Brasil é o terceiro maior produtor mundial, com produção em 98% dos municípios brasileiros, tendo a predominância de pequenas e médias propriedades. Em 2021, produziu mais de 35 bilhões de litros, sendo que 12% deste total, mais de 4 bilhões de litros, foram produzidos no Rio Grande do Sul (2) e, de acordo com o relatório da EMATER (3), a região sudeste do Estado foi responsável por 3,3% deste total.
Entretanto, o leite pode se tornar prejudicial à saúde dos consumidores quando contaminado com aflatoxina M1, que é um metabólito resultante da hidroxilação da aflatoxina B1, micotoxina que pode estar presente na alimentação animal (4). A taxa de excreção da toxina no leite depende de vários fatores que estão relacionados com o tipo de dieta, nível de contaminação por aflatoxina B1, quantidade ingerida, raça do animal, nível de produção, estágio de lactação e estado de saúde do gado leiteiro (5), sendo encontrado na literatura valores de transferência de aflatoxina M1 para o leite variando de 0,1 a 6% (6).
A contaminação do leite por aflatoxina M1 no Brasil tem sido relatada por diversos autores (7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17). Além da ocorrência de aflatoxina M1 em leite estudos relataram também a presença de aflatoxina B1 (18, 19, 20). Estes resultados representam maior preocupação, uma vez que a toxicidade da aflatoxina B1 é maior do que a aflatoxina M1. De acordo com a IARC (21) a aflatoxina B1 é considerada carcinógeno humano (grupo 1) e a aflatoxina M1 é um provável carcinógeno (grupo 2B). Portanto, a presença de aflatoxinas no leite representa um risco para a saúde humana devido a toxicidade relacionada a efeitos hapatotóxicos, imunossupressores, teratogênicos, mutagênicos e carcinogênicos (22). Outro problema se refere a alta estabilidade destas micotoxinas aos métodos de processamento (23, 24)
Sabendo que as micotoxinas são contaminantes naturais e inevitáveis de importantes commodities que impactam severamente a saúde animal e humana, a modelagem de exposição a estes contaminantes e a avaliação de risco podem ser ferramentas valiosas na estimativa de risco (6), pois, com a avaliação da situação real, é possível desenvolver e implementar ações que visem reduzir os riscos referentes a contaminação do leite. Com este objetivo, vários países estabeleceram o limite máximo permitido para essa substância em leite e seus derivados. No Brasil o limite para leite cru é de 0,5 μg kg-1, para leite em pó 5 μg kg-1 e queijos 2,5 μg kg-1 (25). Para a aflatoxina B1 ainda não existem limites legislados, mas existem relatos disponíveis na literatura sobre a presença de aflatoxina B1 no leite, indicando que pode não ocorrer a completa conversão de B1 em M1 (18, 19, 20). Devido a ocorrência de aflatoxina M1 encontrada e por se tratar de substância altamente tóxica vários autores avaliaram a exposição da aflatoxina M1 em leite e produtos lácteos (26, 27, 28, 29, 30).
O objetivo deste trabalho foi realizar um estudo piloto em pequenas propriedades leiteiras da região Sul do Rio Grande do Sul, analisando a ocorrência de aflatoxinas M1 e B1 em amostras de leite cru refrigerado e realizar uma projeção da exposição aos riscos através da estimativa de ingestão diária por adultos e crianças.
MATERIAL E MÉTODOS
Coleta das amostras de leite
Foram coletados 30 mL de leite cru diretamente do tanque de refrigeração, após homogeneização, e armazenados sob congelamento até o momento das análises. As coletas foram realizadas em seis propriedades leiteiras de pequeno porte localizadas na região sul do Rio Grande do Sul, Brasil. Uma propriedade (Propriedade A) localizada no município de Capão do Leão e as demais (Propriedades B, C, D, E e F) no município de Arroio Grande. O número de amostras coletadas foram 12, 3, 3, 2, 2 e 1, das propriedades A, B, C, D, E e F, respectivamente, totalizando 23 amostras.
Reagentes e padrões
Os padrões das aflatoxinas B1 e M1 foram adquiridos da Sigma-Aldrich Chemical Company; a acetonitrila, o metanol e o cloreto de sódio (pureza> 99%) da J.T.Baker; o ácido acético (pureza> 99%) da Vetec; o sulfato de magnésio (pureza> 95%) da Caledon Laboratory; o hexano (pureza> 96%) e o tolueno (pureza>99%) da Merck. A água foi ultrapurificada em sistema Direct-Q UV3 Milipore (resistividade 18,2 MΩ cm). A solução estoque de aflatoxina M1 (0,1 μg L-1) e de aflatoxina B1 (0,2 μg L-1) foram armazenadas em frascos a -20 °C antes do uso.
Extração das aflatoxinas
A extração das aflatoxinas M1 e B1 foi realizada de acordo com o procedimento de QuEChERS, descrito por Sartori et al. (12) com algumas modificações. Os tubos tipo Falcon contendo 30 mL de amostra de leite descongelado foram centrifugados três vezes por 5 min a 3000 x g para remoção da camada de gordura. A amostra analítica (5 mL) foi transferida para tubo de centrífuga e foram adicionados 10 mL de hexano e 15 mL de acetonitrila (1% de ácido acético, v v-1) seguido de agitação manual durante 1 min. Logo após, 6 g de sulfato de magnésio e 1,5 g de cloreto de sódio foram adicionados à mistura e os tubos foram agitados em vórtex durante 1 min e 30 s e, em seguida, centrifugados a 2330 x g durante 7 min. Em seguida, uma alíquota de 5 mL da fase orgânica contendo acetonitrila foram coletadas em frasco âmbar e submetidas a secagem em banho-maria a 60°C. Todas as determinações foram realizadas em triplicata.
Quantificação das aflatoxinas
A quantificação das aflatoxinas foi realizada no Laboratório de Micotoxinas e Ciência de Alimentos da Universidade Federal do Rio Grande (FURG). Foi utilizado um cromatógrafo líquido de alta eficiência acoplado a detector de fluorescência com derivatizador fotoquímico pós-coluna (Romer Derivatization Unit RDU TM) e processamento no software LC Solution. A análise cromatográfica foi realizada em coluna Kromasil C18 (5 μm, 15 cm x 4,6 mm), com vazão de fase móvel de 1 mL min-1 e temperatura do forno de 40°C. Os comprimentos de onda de excitação e emissão foram 370 e 410 nm, respectivamente.
Para determinação do limite de detecção (LOD) e de quantificação (LOQ) foram feitas injeções de diferentes concentrações da solução padrão de trabalho, até que se obtivesse uma relação de 3:1 e 10:1, respectivamente, entre o pico do analito e o ruído da linha de base. Foram preparadas curvas analíticas para verificar a sensibilidade e linearidade na faixa de trabalho das concentrações.
A quantificação foi realizada conforme método descrito por Gonçalves et al. (19), com modificações. O volume de injeção da amostra foi de 20 μL e o tempo da análise cromatográfica foi de 12 min. Os extratos foram eluídos em fase móvel composta por acetonitrila: metanol: água ultrapura (24:15:60, v v-1). O composto foi identificado com base no tempo de retenção dos padrões das aflatoxinas B1 e M1 (6,6 e 11,3 min, respectivamente) e, para confirmação, foi realizada co-cromatografia adicionando solução padrão à amostra, promovendo o aumento de sinal.
A exatidão foi avaliada em termos de recuperação do método, fortificando amostras de leite cru com os padrões das aflatoxinas B1 e M1 em três níveis (0,5; 2,5 e 5,0 µg kg-1). As alíquotas dos padrões foram adicionadas a tubos tipo Falcon, evaporadas sob fluxo de nitrogênio, e posteriormente foram adicionados 5 mL da amostra que foram extraídas e quantificadas conforme descrito anteriormente. A porcentagem de recuperação foi obtida através da Equação I:
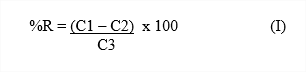
Onde: %R = porcentagem de recuperação; C1 = concentração determinada na amostra fortificada; C2 = concentração determinada na amostra não fortificada e C3 = concentração do padrão utilizado para a fortificação.
Avaliação de risco potencial
A partir dos dados médios de ocorrência de aflatoxina M1 obtidos para as amostras de leite cru neste trabalho, foi realizado um cálculo de projeção da exposição da população a este contaminante (Equação II). Para o cálculo, foram considerados os valores de consumo de leite por faixa etária e o peso de acordo com Santili et al. (2015), ou seja, 400 mL dia-1 para crianças (23 kg) e 350 mL dia-1 para adultos (60 kg).

RESULTADOS E DISCUSSÃO
Os parâmetros de validação do método para determinação das aflatoxinas B1 e M1 nas amostras de leite cru estão apresentados na Tabela 1. Os ensaios de recuperação estão em conformidade com o recomendado pela Comissão Europeia (31), pois as recuperações médias (n=3) corresponderam a um intervalo de 65-110% com valores de RSD entre ± 11% e ± 18%. Os limites de detecção e de quantificação foram considerados adequados uma vez que estão menores que o limite máximo permitido para a aflatoxina M1 vigente na legislação brasileira (0,5 µg kg-1). Além disso, os coeficientes de correlação das curvas analíticas foram próximos de 0,98, garantindo a linearidade e a pouca dispersão do sinal gerado em função da variação da concentração na faixa de 0,01 a 2,0 µg L-1.
Tabela 1 – Parâmetros analíticos do método para determinação das aflatoxinas em leite cru
| Parâmetros | AFM1 | AFB1 |
| Curva analítica | y= 58636x-15880 | y= 13214x-7530,1 |
| R2 | 0,99 | 0,98 |
| Recuperação (%) | 103 | 80 |
| LD (µg L-1) | 0,038 | 0,027 |
| LQ (µg L-1) | 0,125 | 0,083 |
Onde: R2 = coeficiente de determinação; LD = limite de detecção; LQ = limite de quantificação
A aflatoxina B1 não foi detectada em nenhuma amostra. A Tabela 2 apresenta os níveis de contaminação com aflatoxina M1 das amostras de leite cru avaliadas nas diferentes propriedades participantes deste estudo.
Tabela 2 – Contaminação das amostras de leite cru refrigerado por aflatoxina M1 nas diferentes propriedades coletadas.
| Propriedade | NT | NC (%) | Média (μg L-1) ± DP |
| A | 12 | 7 (58,3) | 0,435 ± 0,09 |
| B | 3 | 3 (100) | 0,838 ± 0,20 |
| C | 3 | 3 (100) | 0,713 ± 0,12 |
| D | 2 | 2 (100) | 0,736 ± 0,12 |
| E | 2 | 2 (100) | 0,789 ± 0,16 |
| F | 1 | 1 (100) | 0,723 ± 0,13 |
Onde: NT= número total de amostras coletadas na propriedade; NC= número de amostras contaminadas por aflatoxina M1.
Avaliando os níveis de contaminação das amostras coletadas nas diferentes propriedades (Tabela 2) é possível observar que a propriedade A apresentou contaminação em 58,3% das amostras com o menor valor médio e abaixo do limite máximo preconizado pela legislação brasileira, quando comparada com as demais. Nas propriedades B, C, E e F, todas as amostras coletadas apresentaram contaminação por aflatoxina M1, com valores médios acima do limite legislado. A média da contaminação encontrada nas amostras da propriedade A foi a menor, quando comparada com as médias das demais propriedades, sendo que esta apresentava adequada condição de armazenamento dos alimentos disponibilizados aos animais, enquanto que nas outras propriedades o armazenamento era feito de forma insatisfatória, expostos a umidade, o que pode justificar a elevada ocorrência e os altos níveis de contaminação obtidos nas amostras. Sabe-se que o controle das condições de armazenamento dos alimentos ingeridos pelos animais é fundamental para prevenir a contaminação do leite por aflatoxina M1 (32).
É importante ressaltar também, de acordo com o relatório da EMATER (3), que 37,7% das propriedades do Rio Grande do Sul produzem até 150 L de leite por dia. Avaliando as propriedades em que a coleta foi realizada este foi o volume diário máximo, considerando a propriedade A, onde uma única amostra estava acima do limite permitido (0,6 μg L-1). Nas demais propriedades a produção diária chegava até 50 L de leite encontrando-se os maiores níveis de contaminação (0,65 – 1,10 μg L-1) em 100% das amostras analisadas. A produção de leite está presente em 137.449 propriedades rurais, distribuídas por 493 dos 497 municípios do Rio Grande do Sul que produzem alguma quantidade de leite com os mais variados destinos. Na grande maioria dos municípios (451 municípios, ou 90,74%), há produtores que vendem para indústrias, cooperativas ou queijarias, porém, também foi identificado o comércio informal de leite cru diretamente para consumidores e a comercialização de derivados lácteos de fabricação caseira, o que representa um risco à saúde dos consumidores em função da falta de controle sanitário (3). Este dado reitera a importância de se investir no repasse de informações, principalmente para pequenos produtores leiteiros, através treinamentos práticos para a implementação de boas práticas.
Tabela 3 – Estimativa da ingestão diária de aflatoxina M1
| Amostras positivas | Concentração mín-máx | Concentração média ± DP | >Limite | EID criança | EID adulto | |
| N (%) | (μg L-1) | (μg L-1) | N (%) | ng Kg-1massa corporal dia-1 | ||
| 18 (78,3) | 0,34 – 1,1 | 0,63 ± 0,2 | 12 (66,7) | 10,9 | 3,0 | |
Onde: N = número de amostras; mín = mínima; máx = máxima; DP = desvio padrão; >Limite = maior que limite máximo permitido pela legislação brasileira (0,5 μg kg-1); EID = estimativa de ingestão diária
Das 23 amostras analisadas 78% estavam contaminadas com aflatoxina M1 e destas 67% (Tabela 3) estavam com níveis acima do limite máximo permitido pela legislação brasileira. A Resolução da Diretoria Colegiada nº 7 da Agência Nacional de Vigilância Sanitária (25), limita o valor máximo para contaminação do leite por aflatoxina M1 em 0,5 μg kg-1. Neste trabalho piloto foi encontrado nível médio de contaminação de 0,63 μg L-1, sendo que o valor mais elevado (1,1 μg L-1) excedeu 100% do valor máximo permitido.
Valores de contaminação do leite por aflatoxinas acima do legislado também foram encontrados em outros estudos. Gonçalves et al. (15) avaliaram amostras de leite cru coletadas em tanques de resfriamento de 52 propriedades leiteiras de pequeno porte em Concórdia, Santa Catarina e 40,4% das amostras estavam com níveis de aflatoxina acima do permitido pela legislação. Santili, et al. (11) encontraram incidência de contaminação excedente ao limite máximo legislado bastante reduzido, quando comparado ao presente estudo, visto que das 635 amostras de leite cru, oriundas de 45 fazendas leiteiras de três regiões de São Paulo, 0,5% apresentaram valor acima de 0,5 µg L-1. Picinin et al. (9) analisaram 129 amostras de leite cru de 43 fazendas leiteiras do estado de Minas e Gerais e 13,95% estavam acima do limite legislado. Sifuentes dos Santos et al. (33) avaliaram 54 amostras de leite cru, comparando sistemas orgânico e convencional, 87% das amostras estavam contaminadas com aflatoxina M1, porém nenhuma com valor acima do máximo permitido. Os autores verificaram que o sistema de produção não diferiu significativamente com relação a contaminação encontrada. A partir destes estudos fica evidente a importância do contínuo monitoramento em amostras de leite cru provenientes de diferentes regiões, sistemas de produção e tamanhos de propriedades, pois a partir do levantamento de dados que é possível avaliar as condições básicas utilizadas no sistema produtivo e planejar ações que reduzam a contaminação (aflatoxina M1), minimizando, desta forma, o risco toxicológico.
Além do leite cru, a contaminação do leite processado por aflatoxina M1 no Brasil tem sido relatada por diversos autores. Scaglioni et al. (18), analisaram 27 amostras de leite pasteurizado e UHT produzidos no Rio Grande do Sul e verificaram que 26% apresentavam contaminação com níveis 100% acima do valor legislado. Santos et al. (10) analisaram 42 amostras de leite comercializadas em Londrina, Paraná, e verificaram que 100% estavam contaminadas. Gonçalves et al. (19) verificaram que 68% das amostras de leite (n=62) obtidas do comércio de Rio Grande, Rio Grande do Sul, estavam contaminadas com níveis que variaram entre 40 a 3670 ng L-1.
Elevada ocorrência e elevados níveis de contaminação do leite por aflatoxina M1 também são constatadas em outros países. Sibaja et al. (20) investigaram 51 amostras de leite em pó de diferentes tipos (integral, desnatado, semidesnatado, sem lactose e fórmulas infantis) na Colômbia e 100% apresentaram contaminação por aflatoxina M1 com níveis entre 0,2 a 1,19 µg kg-1. Santini et al (34) realizaram um levantamento em 73 amostras de leite na Sicília, Itália, e detectaram a presença de aflatoxina M1 em 48% das amostras com concentrações variando entre 5,0 e 16,0 ng L-1. Na Costa Rica, 70 amostras de leite foram coletadas no comércio local e 96,5% apresentaram contaminação em níveis que variaram entre 0,019 e 0,629 μg L-1 (35).
Mollayusefian et al., (36) elaboraram uma revisão sistemática com metanálise, avaliando a concentração e a prevalência de aflatoxina M1 em diferentes tipos de leite a partir da análise de 199 artigos, baseado em diferentes países, animais e processamento (cru e pasteurizado). Os autores observaram que a concentração média global de aflatoxina M1 em leite cru e pasteurizado foi de 57,36 e de 85,39 ng L-1, respectivamente, e as maiores concentrações do contaminante foram encontradas no leite de vaca cru e pasteurizado. A partir dos resultados, os autores explicaram que a maior concentração de aflatoxina M1 em leite pasteurizado, comparado ao leite cru, indica o ponto crítico, ou seja, se o leite cru estiver altamente contaminado o processo de pasteurização não irá reduzir a concentração de aflatoxina a um nível aceitável. Isso acontece, pois a aflatoxina é termoestável, não sendo afetada por pasteurização ou tratamento UHT (ultra-high temperature) (37). Mollayusefian et al., (36) também chamaram atenção para a implementação de programas de controle e fornecimento de ração de boa qualidade para o gado, considerando que o consumo de leite e derivados é um hábito alimentar comum associado a benefícios à saúde, e, portanto, a incidência de aflatoxina M1 deve ser monitorada e controlada continuamente. Portanto, como medida de controle da contaminação do leite por aflatoxina M1 deve-se reduzir a contaminação por aflatoxina B1 nos alimentos destinados aos animais, principalmente através da adoção de condições ideais de temperatura e umidade durante o armazenamento destes produtos (4).
Estes relatos devem constituir um alerta à saúde pública tendo em vista a elevada toxidade da aflatoxina M1, classificada no grupo 2B, possivelmente carcinogênica para humanos (21). Neste sentido, embora os resultados apresentados neste artigo se referem a um estudo piloto, a estimativa da ingestão diária (EID) de aflatoxina M1 para as amostras de leite cru foi calculada (Tabela 3), obtendo-se valores de 3 e 10 ng Kg-1massa corporal dia-1 para adultos e crianças, respectivamente. O valor para adultos está de acordo com a estimativa indicada pelo comitê de especialistas da FAO/OMS, que indica, para a população da América Latina a ingestão média de 3,5 ng de aflatoxina M1 por dia (38). Porém, o valor EID para crianças está, aproximadamente, três vezes maior que o valor obtido para os adultos. É importante ressaltar que esta população é mais suscetível aos efeitos adversos das micotoxinas (39), pois a capacidade de biotransformação de carcinógenos das crianças é geralmente mais lenta que em adultos, logo o efeito cumulativo de exposições repetidas, por longos períodos, a pequenas doses, é um fator preocupante (40).
Na literatura há vários estudos que estimaram a ingestão diária da aflatoxina M1 a partir dos dados de amostras de leite avaliadas em cada trabalho. Shundo et al. (41) com valor médio diário de 0,08 ng Kg-1massa corporal dia-1 para adultos. Santili et al. (11), determinaram 0,358 e 0,120 ng Kg-1massa corporal dia-1 para crianças e adultos, respectivamente. Gonçalves et al. (19), encontraram 1,7 ng Kg-1massa corporal dia-1 para adultos. Sibaja et al. (20) obtiveram 8,0 e 13,0 ng Kg-1massa corporal dia-1 para adultos e crianças, respectivamente. Outros trabalhos obtiveram EID com valores bastante variáveis: 0,09 ng na França (42); 1,42 ng na Sérvia (43); 3,42 ng no Paquistão (44) e 0,107 ng no Irã (45). Os relatos com valores de ingestão diário mais baixos não devem ocasionar despreocupação, uma vez que a população está exposta a outras fontes de contaminação por aflatoxina M1, como produtos a base de leite e produtos lácteos (20). De acordo com Oliveira et al. (46) é recomendado o menor grau de exposição possível a este contaminante, principalmente por crianças, que são consideravelmente mais sensíveis aos efeitos tóxicos de compostos químicos veiculados pelos alimentos.
Portanto, Patyal et al. (47) que avaliaram a ocorrência de aflatoxina M1 em leite cru e identificaram os fatores de risco associados a três diferentes sistemas de pecuária, chegaram a conclusão que a qualidade da ração e o cuidado no armazenamento foram significativamente associadas à presença de aflatoxinas nas amostras. Como em outros trabalhos, estes autores também chamaram atenção quanto a alta prevalência e os níveis encontrados, o que representa um risco à saúde dos consumidores, especialmente crianças. Por isso, é necessário esforços conjuntos para criar consciência entre os produtores sobre a contaminação por aflatoxinas dos alimentos destinados aos animais e o leite, proporcionando melhorias nas práticas de manejo na fazenda, afim de controlar o nível de aflatoxina M1 no leite cru para abaixo dos limites legais.
CONCLUSÕES
A partir deste estudo piloto foi possível verificar a contaminação por aflatoxina M1 em 78,3% das amostras analisadas, com níveis que variaram entre 0,34 a 1,1 μg L-1, com média de 0,63 μg L-1, sendo que 67% das amostras contaminadas estavam com níveis acima dos limites máximos permitidos pela legislação brasileira. A partir destes dados foi calculada a estimativa da ingestão diária da aflatoxina M1 para adultos e crianças, obtendo-se os valores de 3,0 e 10 ng Kg-1massa corporal dia-1, respectivamente.
Esses resultados sugerem a necessidade de investimento em treinamento para pequenos produtores leiteiros, além do acompanhamento na implementação de Boas Práticas, sendo esta a principal maneira de prevenir a contaminação por micotoxinas, consideradas contaminantes naturais e inevitáveis.
REFERÊNCIAS
- Sharabi, S, Okun, Z, Shpigelman, A. Changes in the shelf life stability of riboflavin, vitamin C and antioxidant properties of milk after (ultra) high pressure homogenization: Direct and indirect effects. Innovative Food Science & Emerging Technologies. 2018;47:161-169.
- IBGE. Instituto Brasileiro de Geografia e Estatística. Diretoria de Pesquisas, Coordenação de Agropecuária, Pesquisa da Pecuária Municipal [internet]. [acesso em 10 fev 2023]. Disponível em: https://www.ibge.gov.br/estatisticas/economicas/agricultura-e-pecuaria/9107-producao-da-pecuaria-municipal.html?=&t=resultados
- EMATER. Associação Riograndense de Empreendimentos de Assistência Técnica e Extensão Rural. Relatório socioeconômico da cadeia produtiva do leite no Rio Grande do Sul: 2021. Porto Alegre; 2021.
- Edmond EC. Update of survey, regulation and toxic effects of mycotoxins in Europe: Review article. Toxicol. Lett. 2002;127:19-28.
- Freitas CH, Gonçalves CL, Nascente, OS. Aflatoxins B1 and M1: risks related to milk produced in Brazil. Ann. Microbiol. 2018;68:793-802.
- Coffey R, Cummins E, Ward S. Exposure assessment of mycotoxins in dairy milk. Food control, 2009;20(3):239-249.
- Londoño VAG, Boasso AC, de Paula MCZ, Garcia LP, Scussel VM, Resnik S, Pacín A. Aflatoxin M1 survey on randomly collected milk powder commercialized in Argentina and Brazil. Food control. 2013;34(2):752-755.
- de Oliveira CP, Soares NDFF, de Oliveira TV, Júnior JCB, da Silva WA. Aflatoxin M1 occurrence in ultra high temperature (UHT) treated fluid milk from Minas Gerais/Brazil. Food control. 2013;30(1):90-92.
- Picinin, LCA, Cerqueira MMOP, Vargas EA, Lana ÂMQ, Toaldo IM, Bordignon-Luiz MT. Influence of climate conditions on aflatoxin M1 contamination in raw milk from Minas Gerais State, Brazil. Food Control. 2013;31(2):419-424.
- Sifuentes dos Santos J, França V, Katto S, Santana EH. Aflatoxin M1 in pasteurized, UHT milk and milk powder commercialized in Londrina, Brazil and estimation of exposure. Archivos latinoamericanos de nutricion. 2015;65(3):81-185.
- Santili ABN, de Camargo AC, Nunes RDSR, Gloria EMD, Machado PF, Cassoli LD et al. Aflatoxin M1 in raw milk from different regions of São Paulo state–Brazil. Food Additives & Contaminants: Part B. 2015;8(3):207-214.
- Sartori AV, Swensson de Mattos J, de Moraes MHP, da Nóbrega AW. Determination of aflatoxins M1, M2, B1, B2, G1, and G2 and ochratoxin A in UHT and powdered milk by modified QuEChERS method and ultra-high-performance liquid chromatography tandem mass spectrometry. Food analytical methods. 2015; 8(9):2321-2330.
- Silva MV, Janeiro V, Bando E, Machinski JrM. Occurrence and estimative of aflatoxin M1 intake in UHT cow milk in Paraná State, Brazil. Food Control. 2015;53:222-225.
- de Oliveira Ramos CEC, Damasceno JC, Kazama R, Vieira TSWJ, Zambom MA, Ferreira FG, dos Santos GT. Seasonal milk contamination by aflatoxin M1, organophosphates and carbamates in Paraná–Brazil. Semina: Ciências Agrárias. 2016;37(4):2145-2153.
- Goncalves L, Dalla Rosa A, Gonzales SL, FELTES MMC, Badiale-Furlong E, Dors GC. Incidence of aflatoxin M1 in fresh milk from small farms. Food science and technology. 2017;37:11-15.
- Becker‐Algeri TA, Souza C, Bortoli K, Castagnaro D, Scaglioni PT, Drunkler DA et al. Seasonal variation of milk quality: Physicochemical, microbiological, and toxicological. Journal of Food Safety. 2020;40(4):e12796.
- Corassin CH, Borowsky A, Ali S, Rosim RE, de Oliveira CAF. Occurrence of Aflatoxin M1 in Milk and Dairy Products Traded in São Paulo, Brazil: An Update. Dairy. 2020;3(4):842-848.
- Scaglioni PT, Becker-Algeri T, Drunkler D, Badiale-Furlong E. Aflatoxin B1 and M1 in milk. Analytica chimica acta.2014;829:68-74.
- Gonçalves KDM, Sibaja KVM, Feltrin ACP, Remedi RD, de Oliveira Garcia S, Garda-Buffon, J. Occurrence of aflatoxins B1 and M1 in milk powder and UHT consumed in the city of Assomada (Cape Verde Islands) and southern Brazil. Food Control. 2018;93:260-264.
- Marimón Sibaja KV, Gonçalves KDM, Garcia SDO, Feltrin ACP, Nogueira WV, Badiale-Furlong E, Garda-Buffon J. Aflatoxin M1 and B1 in Colombian milk powder and estimated risk exposure. Food Additives & Contaminants: Part B. 2019;12(2):97-104.
- IARC. International Agency of Research on Cancer. Monographs on the evaluation of carcinogenic risks to humans. Lyon; 2002.
- Bennett JW. Klich. M. Mycotoxins. Clinical Microbiology Reviews. 2013;16(3):497-516.
- Fernandes AM, Corrêa B, Rosim RE, Kobashigawa E, Oliveira CAFD. Distribution and stability of aflatoxin M1 during processing and storage of Minas Frescal cheese. Food control. 2012; 24(1-2):104-108.
- Iha MH, Barbosa CB, Okada IA, Trucksess MW. Aflatoxin M1 in Milk and Distribution and Stability of Aflatoxin M1 during Production and Storage of Yoghurt and Cheese. Food Control. 2013; 29: 1–6.
- ANVISA. Agência Nacional de Vigilância Sanitária. RDC nº 07, de 18 de Fevereiro de 2011. Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. Diário Oficial da União. 09 mar 2011; Seção 1.
- Ishikawa AT, Takabayashi-Yamashita CR, Ono E, Bagatin AK, Rigobello FF, Kawamura O, et al. Exposure assessment of infants to aflatoxin M1 through consumption of breast milk and infant powdered milk in Brazil. Toxins. 2016;8(9):246.
- Milićević DR, Spirić D, Radičević T, Velebit B, Stefanović S, Milojević L, Janković S. A review of the current situation of aflatoxin M1 in cow’s milk in Serbia: risk assessment and regulatory aspects. Food Additives & Contaminants: Part A. 2017;34(9):1617-1631.
- Serraino A, Bonilauri P, Kerekes K, Farkas Z, Giacometti F, Canever A, et al. Occurrence of aflatoxin M1 in raw milk marketed in Italy: Exposure assessment and risk characterization. Frontiers in Microbiology. 2019;10:2516.
- Turna NS, Wu F. Aflatoxin M1 in milk: A global occurrence, intake, & exposure assessment. Trends in Food Science & Technology. 2021;110:183-192.
- Marimon Sibaja K V, Garcia SDO, Nogueira WV, de Oliveira FK, Badiale-Furlong E, Garda-Buffon J. Dietary exposure assessment of aflatoxin M1 in milk and dairy products of Latin America. Food reviews international. 2022;38(sup1):669-682.
- CE. Comunidade Europeia. Regulamento nº 401 da Comissão de 23 de Fevereiro de 2006 que estabelece os métodos de amostragem e de análise para o controle oficial dos teores de micotoxinas nos gêneros alimentícios. Jornal Oficial da União Europeia. 09 mar 2006.
- Rosa AF, Ocorrência natural de aflatoxina M1 e parâmetros de qualidade do leite em propriedades do Estado de São Paulo [dissertação]. Nova Odessa: Agência Paulista de Tecnologia dos Agronegócios; 2014.
- Sifuentes dos Santos J, Granella V, Pigatto GM, Reiniger LRS, Costabeber IH. Aflatoxin M1 in pasteurized and raw milk from organic and conventional systems. Journal für Verbraucherschutz und Lebensmittelsicherheit. 2016;11:299-304.
- Santini A, Raiola A, Ferrantelli V, Giangrosso G, Macaluso A, Bognanno M, et al. Aflatoxin M1 in raw, UHT milk and dairy products in Sicily (Italy). Food Additives & Contaminants: Part B. 2013;6(3):181-186.
- Chavarría G, Granados-Chinchilla F, Alfaro-Cascante M, Molina A. Detection of aflatoxin M1 in milk, cheese and sour cream samples from Costa Rica using enzyme-assisted extraction and HPLC. Food Additives & Contaminants: Part B. 2015;8(2):128-135.
- Mollayusefian I, Ranaei V, Pilevar Z, Cabral-Pinto MM, Rostami A, Nematolahi A. The concentration of aflatoxin M1 in raw and pasteurized milk: A worldwide systematic review and meta-analysis. Trends in Food Science & Technology 2021;115:22-30.
- Galvano F, Galofaro V, Galvano G. Occurrence and stability of aflatoxin M1 in milk and milk products: a worldwide review. Journal of Food protection. 1996; 59(10):1079-1090.
- JECFA. Joint FAO/WHO expert committee on food additives. Safety evaluation of certain mycotoxins in food/ prepared by fifty-sixth meeting of the Joint FAO/WHO expert committee on food additivies (JECFA) n° 47. FAO [internet]; 2001 [acesso em 27 Fev 2023]. Disponível em: https://www.inchem.org/documents/jecfa/jecmono/v47je01.htm
- Sylos CMD, Amaya DR. Estudo comparativo de métodos para determinaçäo de aflatoxina M1. Rev. Inst. Adolfo Lutz. 1996;87-97.
- Lopez C, Ramos L, Ramadan S, Bulacio L, Perez J. Distribution of aflatoxin M1 in cheese obtained from milk artificially contaminated. International journal of food microbiology. 2001;64(1-2):211-215.
- Shundo L, Navas SA, Lamardo LCA, Ruvieri V, Sabino M. Estimate of aflatoxin M1 exposure in milk and occurrence in Brazil. Food Control. 2009;20(7):655-657.
- Leblanc JC, Tard A, Volatier JL, Verger P. Estimated dietary exposure to principal food mycotoxins from the first French Total Diet Study. Food Additives and Contaminants. 2005;22(7):652-672.
- Škrbić B, Živančev J, Antić I, Godula M. Levels of aflatoxin M1 in different types of milk collected in Serbia: Assessment of human and animal exposure. Food Control. 2014;40: 113-119.
- Iqbal SZ, Asi MR, Malik N. The seasonal variation of aflatoxin M1 in milk and dairy products and assessment of dietary intake in Punjab, Pakistan. Food Control. 2017;79:292-296.
- Nejad ASM, Heshmati A, Ghiasvand T. The occurrence and risk assessment of exposure to aflatoxin M1 in ultra-high temperature and pasteurized milk in Hamadan province of Iran. Osong public health and research perspectives.2019;10(4):228.
- Oliveira CA, Rosmaninho J, Rosim R. Aflatoxin M1 and cyclopiazonic acid in fluid milk traded in São Paulo, Brazil. Food Additives and Contaminants. 2006;23(2):196-201.
- Patyal A, Gill JPS, Bedi JS, Aulakh RS. Potential risk factors associated with the occurrence of aflatoxin M1 in raw milk produced under different farm conditions. Journal of Environmental Science and Health, Part B. 2020;55(9):827-834.
Tag:Aflatoxinas
