
PROSPECÇÃO DE BACTÉRIAS ÁCIDO LÁTICAS RESISTENTES AO ESTRESSE TÉRMICO
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-44
Este trabalho foi escrito por:
Larissa de Souza Valladares1; Carolina Schettino Kegele1; Joice Fátima Moreira Silva2; Bruna Vieira Alonso3; Italo Perrone4; Joao Batista Ribeiro5*
1Mestranda; Pós-Graduação em Ciência e Tecnologia do Leite e Derivados; UFJF. 2Doutoranda; Pós-graduação em Ciências Veterinárias; UFLA. 3Graduanda; Medicina Veterinária; UFJF. 4Professor; Pós-Graduação em Ciência e Tecnologia do Leite e Derivados; UFJF. 5Pesquisador, Empresa Brasileira de Pesquisa Agropecuária – Embrapa Gado de Leite.
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Bactérias ácido láticas (BAL), por possuírem diversas propriedades funcionais, têm recebido destaque no cenário científico e tecnológico por sua aplicabilidade nas áreas farmacêutica e alimentícia. Um gargalo importante para exploração biotecnológica destes microrganismos está relacionado ao elevado custo para processamento e manutenção da viabilidade das células por longos períodos (cadeia de frios e/ou liofilização). O processo de secagem por atomização se apresenta como uma alternativa economicamente viável para a produção desses microrganismos como bioinsumo em escala industrial, entretanto, é um processo altamente linhagem dependente. O objetivo deste trabalho foi prospectar linhagens de BAL resistentes ao estresse térmico visando à identificação de microrganismos mais propensos a sobreviver ao processo de secagem por atomização. Cem linhagens de BAL foram submetidas ao estresse térmico de 60 °C ± 1 °C por 5 min e em seguida a taxa de sobrevivência foi avaliada por meio da técnica de microgota. Com reduções logarítmicas variando de 0,28 a 1,96 e contagens de 7,47 log UFC/mL a 8,92 log UFC/mL, 20 BAL foram capazes de resistir ao tratamento térmico e serão capazes de prosseguir para etapas seguintes de estudos visando futura aplicação industrial.
Palavras–chave: Enterococcus spp.; estresse térmico; Lactobacillus spp.; Pediococcus spp.; Streptococcus spp.
Abstract: Lactic acid bacteria (LAB), due to their diverse functional properties, have been highlighted in the scientific and technological scenario for their applicability in the pharmaceutical and food areas. A difficulty for the biotechnological exploration of these microorganisms is related to the high cost for processing and maintaining the viability of cells for long periods (cold chain and/or lyophilization). Spray drying process presents itself as an economically viable alternative for the production of these microorganisms as bioinput on an industrial scale, however, it is a highly lineage dependent process. This work aims to prospect strains of LAB resistant to heat stress in order to identify microorganisms more likely to survive the spray drying process. One hundred LAB strains were subjected to heat stress at 60 °C ± 1 °C for 5 min and then the survival rate was evaluated using the microdroplet technique. With log reductions ranging from 0.28 to 1.96 and counts from 7.47 log CFU/mL to 8.92 log CFU/mL, 20 LAB were able to withstand the heat treatment and will be able to proceed to subsequent stages of studies for future industrial application.
Key Word: Enterococcus spp.; Lactobacillus spp.; Pediococcus spp.; Streptococcus spp.; thermal stress
INTRODUÇÃO
As bactérias ácido láticas (BAL) têm recebido destaque no cenário cientifico por sua aplicabilidade nas áreas farmacêutica e alimentícia (1). Essas bactérias são capazes de produzir biomoléculas usadas na fabricação de repelentes, cosméticos, antimicrobianos, produtos lácteos, cárneos e vegetais fermentados, por exemplo (2). E podem ser encontradas em plantas, produtos alimentícios fermentados e diversas partes do organismo de seres humanos e outros animais (3).
Características que as BAL usualmente apresentam são: forma de bastonetes, cocobacilos ou cocos, com células simples, duplas ou tétrades podendo ainda formar pequenas ou grandes cadeias, não esporuladas, geralmente sem motilidade, não reduzem nitrato a nitrito, homo ou heterofermentativas, mesófilas ou termófilas, fastidiosas, acidúricas, resistentes aos sais biliares, gram-positivas, catalase e citocromo negativas, anaeróbias, anaeróbias facultativas, aeróbias ou microaerófilas, quantidades de guanina e citosina menores que as de timina e adenina no DNA bacteriano (4–8).
São capazes de produzir grande número de biomoléculas como: enzimas glicolíticas, lipolíticas e proteolíticas, ácidos orgânicos, bacteriocinas, vitaminas, diacetil, acetaldeído, alcenos, dióxido de carbono, peróxido de hidrogênio, benzaldeído, etanol, cetonas, terpenos, derivados de benzeno, além de exopolissacarídeos (2,9,10).
Por possuírem propriedades biofuncionais como atividade antimicrobiana, anti-inflamatória, anti-hipertensiva, antioxidante, antidiarreica, antiviral, imunomoduladora, hipocolesterolêmica, antidiabética e anticancerígena este grupo de microrganismos têm sido estudado utilizando animais ou ensaios clínicos em humanos para avaliação do seu potencial em reduzir ou amenizar distúrbios do trato gastrointestinal (TGI) (7,11–13). Também tem sido estudado o uso das BAL como bioprotetoras em alimentos, pois desempenham atividade inibitória considerável sobre microrganismos patogênicos e deteriorantes ali presentes (14).
Para serem aplicadas como probiótico, ou seja, organismos vivos capazes de exercer efeitos benéficos a quem os consome em quantidades adequadas, devem possuir status GRAS (do inglês Generally Recognised As Safe), resistir à passagem pelas condições adversas do TGI, principalmente a acidez do estômago e a presença de sais biliares no intestino, terem a capacidade de adesão à mucosa intestinal e à exclusão competitiva de microrganismos patogênicos (15).
Dentre as BAL com características probióticas mais bem caracterizadas e utilizadas, deve-se destacar as do gênero Lactobacillus, pertencente ao filo Firmicutes, classe Bacilli, ordem Lactobacillales, família Lactobacillaceae (16). Esse gênero passou por modificações na sua divisão taxonômica em abril de 2020 por conta de um grande número de bactérias de espécies diferentes entre si estarem inclusas em um mesmo gênero, passando a apresentar além do gênero Lactobacillus, Pediococcus e Paralactobacillus, outros 23 gêneros (8). Também foi sugerida a junção das famílias Lactobacillaceae e Leuconostocaceae.
Os principais microrganismos utilizados como probióticos são bactérias e leveduras. No Quadro 1 são exemplificadas nove bactérias aplicadas em produtos de oito marcas diferentes.
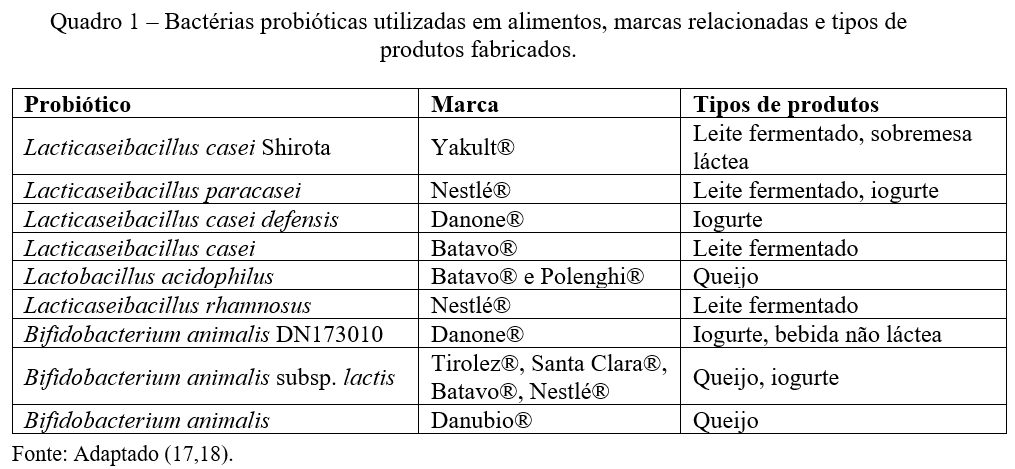
Além das bactérias citadas acima, também são utilizadas as cepas Limosilactobacillus reuteri e Streptococcus thermophilus (19). E as leveduras Saccharomyces boulardii, Saccharomyces cerevisiae e Saccharomyces bayanus (20).
A aplicação desses microrganismos pode ser feita em produtos lácteos, bebidas não lácteas, fórmulas infantis, cereais, alimentos secos, cárneos fermentados, panificação, barras nutritivas, suplementos alimentícios e alimentos probióticos para animais. Dessa forma, em 2021 o mercado de probióticos alcançou cerca de 60 bilhões de dólares, e deverá expandir a uma taxa de crescimento anual composta (do inglês compound annual growth rate – CAGR) de 7,5% de 2021 até 2030 (Probiotics Market, 2021; 2022).
Com a crescente demanda por essas bactérias, a fabricação através da secagem por atomização possibilita um maior rendimento se comparada a fabricação por liofilização (23). A comparação específica com o método de liofilização, como a apresentada no Quadro 2, se dá por conta da maior parte dos produtos que demandam viabilidade celular das bactérias pós-secagem serem preparados por meio desse método (24).
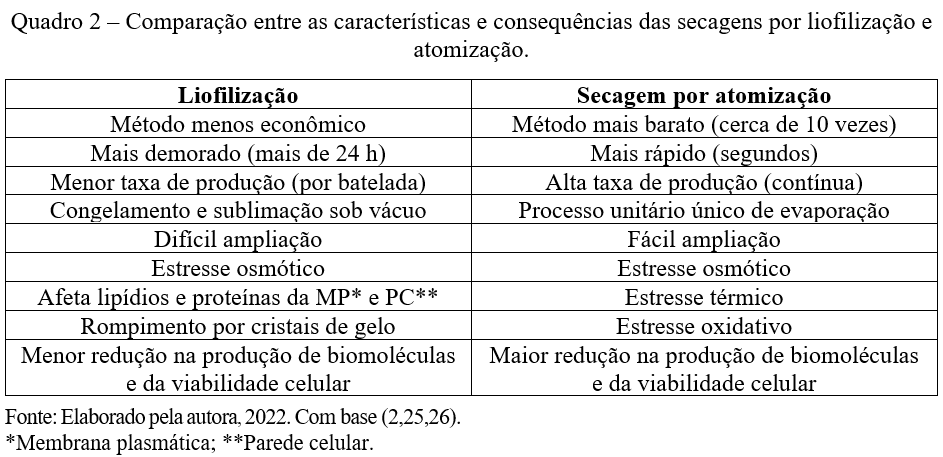
Em ambos os casos as células bacterianas passam por estresses e sofrem perda de viabilidade. Uma alternativa encontrada é a de utilizar materiais protetores frente a alta ou baixa temperatura (27–29). O processo de secagem por atomização é um método de microencapsulação realizado em um equipamento que é alimentado por uma mistura líquida composta por células de BAL somadas ao protetor adequado. Esse material é pulverizado em gotículas finas do tamanho de mícrons e misturada com fluxo de ar quente para obter desidratação rápida (30). As células bacterianas podem alcançar temperaturas de aproximadamente 60 °C por alguns segundos após a secagem da partícula do pó (2).
Como já demonstrado (31), a resistência bacteriana aos estresses é linhagem-dependente, então pode ser feito um teste de resistência para pré-selecionar as bactérias que apresentem maior capacidade de expressão desses genes, e posteriormente ser submetida a um estímulo subletal, com crescimento sob condições estressantes antes da secagem para que haja a expressão contínua desses genes que codificam proteínas chamadas chaperonas, que contribuem para a resistência frente várias condições adversas, como: variações de temperatura, variação na pressão osmótica, pH do meio e exposição aos sais biliares por exemplo (32).
Portanto, o objetivo deste trabalho foi o de encontrar BAL resistentes ao estresse térmico dentre as 100 escolhidas, com contagem pós-estresse maior que 7 log UFC/mL e perda de viabilidade de até duas unidades logarítmicas.
MATERIAL E MÉTODOS
MICRORGANISMOS UTILIZADOS E CONDIÇÕES DE ESTOCAGEM
As 100 BAL usadas nesse trabalho foram previamente isoladas, caracterizadas como pertencentes aos gêneros Lactobacillus spp., Enterococcus spp., Pediococcus spp. e Streptococcus spp., e fazem parte da coleção de trabalho do Projeto Biotech-CPLFase 1, as quais são preservadas a longo termo na Embrapa Gado de Leite, Juiz de Fora, Minas Gerais, Brasil, a -20 °C e -80 °C em meio crioprotetor constituído de 10% leite desnatado (Oxoid) adicionado de 10% de glicerol (Merck).
OBTENÇÃO DO INÓCULO E PREPARO DA SUPENSÃO DE CÉLULAS
Para cultivo da bactéria de interesse, uma alçada do meio crioprotetor contendo as células bacterinas foi estriada em placa de Petri contendo ágar MRS (Kasvi) com o intuito de obter colônias isoladas. As placas de Petri foram incubadas por 48 h, a 35 °C sem condições de anaerobiose. Uma colônia isolada foi transferida para 1 mL de caldo MRS (Kasvi) contido em tubo de ensaio e incubada a 35 °C por 24 h.
Do cultivo anterior, 100 µL foram transferidos para 900 µL de caldo MRS contido em microtubo eppendorf e incubado a 35 °C por 18 h para atingir a fase estacionária, a fim de preservar as células adaptadas em um estado ativo.
Após incubação a massa celular bacteriana foi coletada por centrifugação (6000 x g, 5 min, 25 °C), lavada duas vezes com solução PBS (composição: NaCl, Qhemis – 8,0 g; Na2HPO4 · 12 H2O, Merck – 2,9 g; KCl, Ecibra – 0,2 g; KH2PO4, Neon – 0,2 g; H2O – 1000,0 g), e ressuspendida em 1 mL de solução PBS.
ESTRESSE TÉRMICO
Alíquotas de 400 µL de cada inóculo obtido conforme descrito na seção anterior foi transferida para tubo de ensaio estéril e mantida em banho-maria de 60 °C ± 1 °C por 5 min. Em seguida transferida para banho de gelo.
A suspensão bacteriana restante, não exposta ao estresse, foi usada como controle.
ENUMERAÇÃO PELA TÉCNICA DA MICROGOTA
As placas de ágar MRS que receberam a microgota foram posicionadas abertas em capela de fluxo laminar com a chama acesa e a luz UV ligada por 15 min para que o meio perca a umidade em excesso e absorva mais facilmente o inóculo. Posteriormente as placas são tampadas, sendo mantida uma fresta aberta por mais tempo o suficiente perto da chama até que a tampa esteja livre de condensação.
A diluição seriada das suspensões bacterianas foi realizada em solução PBS até contemplar a concentração estimada, além de uma acima e outra abaixo desta.
As diluições foram plaqueadas em triplicata e cada microgota de 20 µL foi posicionada em um quadrante da placa de Petri, como exemplificado na Figura 1.
Fonte: Autora, 2022.
Movimentos circulares leves foram feitos com a placa de Petri após aplicação de cada microgota para que as bactérias não acumulem nas bordas.
A incubação foi feita a 35 °C por 48 h e a contagem das colônias foi realizada preferencialmente nas diluições que contemplaram de 8 a 80 UFC.
Para obter o resultado em UFC/mL foi aplicada a equação (1):

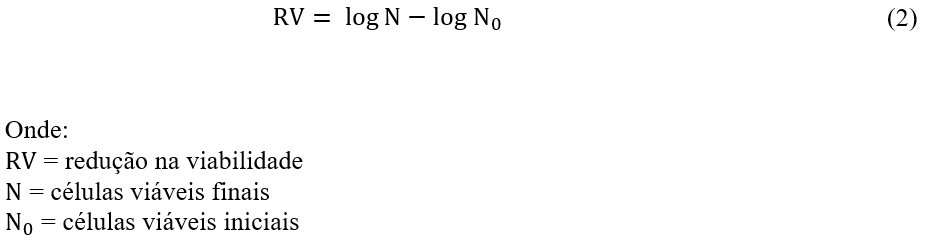
Cepas com perda de viabilidade de até duas unidades logarítmicas e contagem maior que 7 log UFC/mL foram consideradas adequadas.
RESULTADOS E DISCUSSÃO
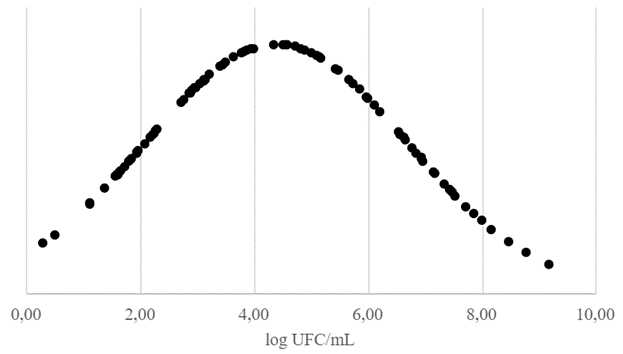
Após o teste de estresse térmico pôde-se observar que a perda de viabilidade das bactérias apresentou a forma de uma distribuição normal, ou Gaussiana, como mostrado no Gráfico 1, onde microrganismos mais resistentes ao tratamento de 60 °C ± 1 °C por 5 min estão mais próximos ao lado esquerdo e os menos resistentes estão do lado oposto, pois maiores valores indicam maior redução na viabilidade bacteriana e menores valores indicam menor redução na viabilidade bacteriana. Ao final do experimento foram observados valores variando de 0,28 a 9,18.
Fonte: Autora, 2022.
Bactérias que apresentam maior perda de viabilidade em testes de estresse térmico, tendem a manifestar menor sobrevivência quando expostas ao processo de secagem por spray drying. Circunstância que pode ser associada a baixa ou inexistente expressão de chaperonas, por exemplo (1). Portanto, para selecionar cepas resistentes devemos apontar atenção para o lado esquerdo do Gráfico 1.
Dentre as 100 BAL estudadas nesse trabalho, 20 apresentaram redução na viabilidade celular de até 2 unidades logarítmicas e contagem maior que 7 log UFC/mL após o teste de estresse térmico, como ilustrado na Tabela 1.
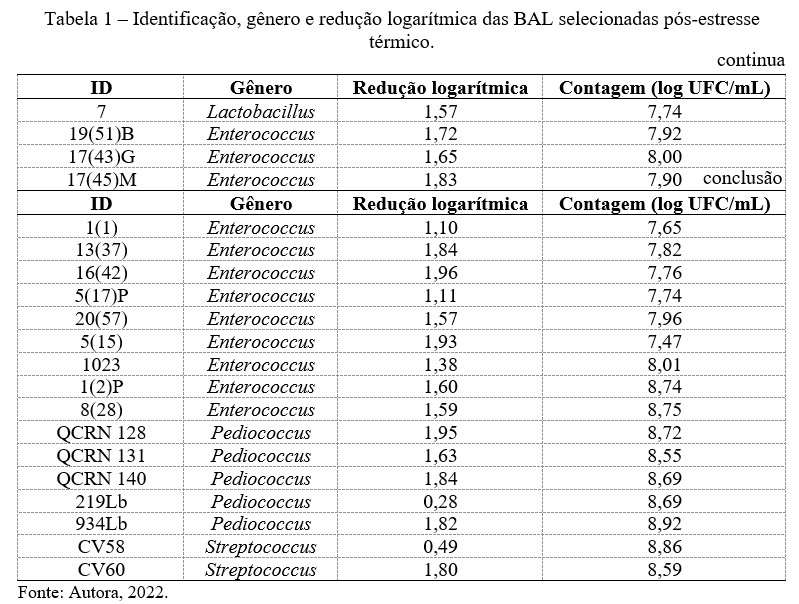
Bactérias dos gêneros Pediococcus spp. e Streptococcus spp. foram as que apresentaram menor redução logarítmica, 0,28 e 0,49 respectivamente, o que indica grande resistência frente à condição a qual foram expostas.
Outro fato que pôde ser observado está relacionado a capacidade de adequação ao limiar estabelecido para os microrganismos estudados. Onde dentre os 4 gêneros: Lactobacillus spp., Enterococcus spp., Pediococcus spp. e Streptococcus spp., foram classificados como resistentes 2,86%, 38,71%, 50,00% e 8,33% do número de bactérias, respectivamente.
No Gráfico 2 está a comparação da população de cada gênero antes e depois da aplicação de estresse.
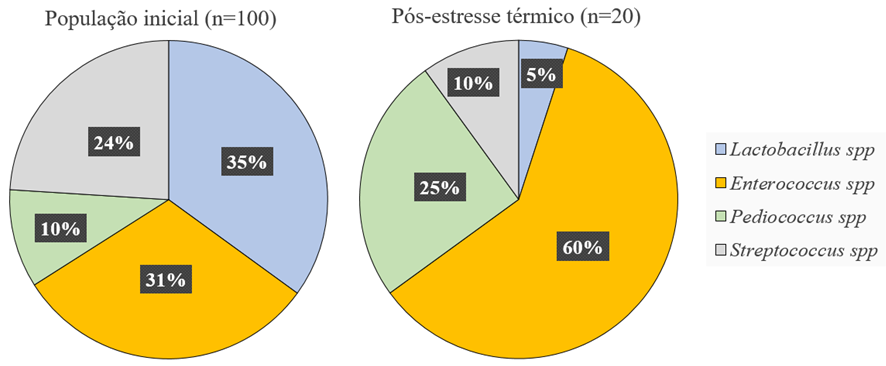
Ao final dos experimentos, 20% da população apresentou resultados dentro do estabelecido para o avanço em busca de novas cepas de BAL que venham a integrar o grupo de microrganismos aplicados para uso humano, seja em sua totalidade ou por seus genes e produtos gênicos.
CONCLUSÕES
Das 100 BAL introduzidas no estudo, 20 foram capazes de resistir ao tratamento térmico com uma redução na viabilidade dentro do esperado e serão capazes de prosseguir para etapas seguintes de estudos visando futura aplicação industrial.
Devem ser estudadas outras características de resistência desses microrganismos antes de sua aplicação no processamento por spray drying, e também seu status GRAS para uso em alimentos.
REFERÊNCIAS
- Hao F, Fu N, Ndiaye H, Woo W, Jeantet R, Chen XD, et al. Lactic Acid Bacteria After Spray Drying as Affected by the Increase of Growth Temperature. Food and Bioprocess Technology. 2021 [cited 2021 Dec 29];10(1):6. Available from: https://doi.org/10.1007/s11947-020-02571-1
- Moreira MTC, Martins E, Perrone ÍT, Freitas R, Queiroz LS, Carvalho AF. Challenges associated with spray drying of lactic acid bacteria: Understanding cell viability loss. Compr Rev Food Sci Food Saf [Internet]. 2021 Jul 19;20(4):3267–83. Available from: https://onlinelibrary.wiley.com/doi/10.1111/1541-4337.12774
- Duar RM, Lin XB, Zheng J, Martino ME, Grenier T, Pérez-Muñoz ME, et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev [Internet]. 2017 Aug 1 [cited 2022 Jan 30];41(Supp_1):S27–48. Available from: https://academic.oup.com/femsre/article/41/Supp_1/S27/3902999
- Freire TT, Silva ALT e, Ferreira BKO, Santos TM dos. Bactérias ácido lácticas suas características e importância: revisão. Res Soc Dev [Internet]. 2021 Sep 7 [cited 2022 Jan 3];10(11):e513101119964. Available from: https://rsdjournal.org/index.php/rsd/article/view/19964
- Lunardi A, Filho JVD, Ferreira CC, Cavali J, Vais JO, Dias A de A, et al. Bactérias Ácido-Láticas Não Iniciadoras (Nslab): Um Desafio À Indústria Do Queijo / Non Starter Lactic Acid Bacteria (Nslab): a Challenge To the Cheese Industry. Brazilian J Dev. 2021;7(3):26383–409.
- Mokoena MP. Lactic Acid Bacteria and Their Bacteriocins: Classification, Biosynthesis and Applications against Uropathogens: A Mini-Review. Molecules [Internet]. 2017 Jul 26 [cited 2022 Jan 28];22(8):1255. Available from: /pmc/articles/PMC6152299/
- Adu KT, Wilson R, Baker AL, Bowman J, Britz ML. Prolonged Heat Stress of Lactobacillus paracasei GCRL163 Improves Binding to Human Colorectal Adenocarcinoma HT-29 Cells and Modulates the Relative Abundance of Secreted and Cell Surface-Located Proteins. J Proteome Res [Internet]. 2020 [cited 2021 Dec 30];19:2021. Available from: https://dx.doi.org/10.1021/acs.jproteome.0c00107
- Zheng J, Wittouck S, Salvetti E, Franz CMAP, Harris HMB, Mattarelli P, et al. A taxonomic note on the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae. Int J Syst Evol Microbiol [Internet]. 2020 Apr 15 [cited 2022 Jan 28];70(4):2782–858. Available from: https://www.microbiologyresearch.org/content/journal/ijsem/10.1099/ijsem.0.004107
- Vieco-Saiz N, Belguesmia Y, Raspoet R, Auclair E, Gancel F, Kempf I, et al. Benefits and inputs from lactic acid bacteria and their bacteriocins as alternatives to antibiotic growth promoters during food-animal production. Front Microbiol. 2019;10:57.
- Tulini FL, Hymery N, Haertlé T, Le Blay G, De Martinis ECP. Screening for antimicrobial and proteolytic activities of lactic acid bacteria isolated from cow, buffalo and goat milk and cheeses marketed in the southeast region of Brazil. J Dairy Res [Internet]. 2016 Feb 1 [cited 2022 Jan 30];83(1):115–24. Available from: https://www.cambridge.org/core/journals/journal-of-dairy-research/article/abs/screening-for-antimicrobial-and-proteolytic-activities-of-lactic-acid-bacteria-isolated-from-cow-buffalo-and-goat-milk-and-cheeses-marketed-in-the-southeast-region-of-brazil/8A8
- Souza TC, Zacarías MF, Silva AM, Binetti A, Reinheimer J, Nicoli JR, et al. Cell viability and immunostimulating and protective capacities of Bifidobacterium longum 51A are differentially affected by technological variables in fermented milks. J Appl Microbiol [Internet]. 2012 Jun;112(6):1184–92. Available from: https://onlinelibrary.wiley.com/doi/10.1111/j.1365-2672.2012.05280.x
- Cuffia F, George G, Godoy L, Vinderola G, Reinheimer J, Burns P. In vivo study of the immunomodulatory capacity and the impact of probiotic strains on physicochemical and sensory characteristics: Case of pasta filata soft cheeses. 2019; Available from: https://doi.org/10.1016/j.foodres.2019.108606
- Minj J, Chandra P, Paul C, Sharma RK. Bio-functional properties of probiotic Lactobacillus: current applications and research perspectives. Crit Rev Food Sci Nutr [Internet]. 2021 [cited 2021 Dec 14];61(13):2207–24. Available from: https://pubmed.ncbi.nlm.nih.gov/32519883/
- Cosentino S, Viale S, Deplano M, Fadda ME, Pisano MB. Application of Autochthonous Lactobacillus Strains as Biopreservatives to Control Fungal Spoilage in Caciotta Cheese. 2018 [cited 2022 Apr 7]; Available from: https://doi.org/10.1155/2018/3915615
- WHO. Guidelines for the Evaluation of Probiotics in Food [Internet]. Canada; 2002 p. 11. Available from: http://www.fao.org/es/ESN/Probio/probio.htm
- Papadimitriou K, Alegría Á, Bron PA, Angelis M de, Gobbetti M, Kleerebezem M, et al. Stress Physiology of Lactic Acid Bacteria. Microbiol Mol Biol Rev [Internet]. 2016 Sep [cited 2021 Dec 30];80(3):837. Available from: /pmc/articles/PMC4981675/
- Melo T, Melo TA, Ribeiro-Alves MA, Lavinas FC, Rodrigues I de A. Levantamento e caracterização dos produtos probióticos disponíveis no mercado varejista da região metropolitana do Rio de Janeiro. Rev Rede Cuid em Saúde [Internet]. 2016 Jan 20 [cited 2022 Feb 4];10(1):13. Available from: http://publicacoes.unigranrio.edu.br/index.php/rcs/article/view/3307
- Rocha NDC. Prospecção de bactérias lácticas para uso como probióticos e avaliação do efeito protetor em modelo murino de mucosite intestinal induzida por 5-FU. Dissertação (Mestrado em Genética) – Universidade Federal de Minas Gerais, Belo Horizonte; 2020.
- Uriot O, Denis S, Junjua M, Roussel Y, Dary-Mourot A, Blanquet-Diot S. Streptococcus thermophilus: From yogurt starter to a new promising probiotic candidate? J Funct Foods. 2017 Oct 1;37:74–89.
- Leo VV, Viswanath V, Deka P, Zothanpuia, Ramji DR, Pachuau L, et al. Saccharomyces and Their Potential Applications in Food and Food Processing Industries. Ind Important Fungi Sustain Dev [Internet]. 2021 [cited 2022 Feb 8];393–427. Available from: https://link.springer.com/chapter/10.1007/978-3-030-67561-5_12
- Probiotics Market Growth Analysis, Trends, and Forecasts to 2026 | MarketsandMarkets [Internet]. 2021 [cited 2022 Feb 3]. Available from: https://www.marketsandmarkets.com/Market-Reports/probiotic-market-advanced-technologies-and-global-market-69.html
- Probiotics Market Size | Industry Report, 2021 -2030 [Internet]. 2022 [cited 2022 Feb 3]. p. 135. Available from: https://www.grandviewresearch.com/industry-analysis/probiotics-market
- Yurani Vera-Peña M, Cortés Rodríguez M, Francia Y, Valencia-García E. Spray Drying of Lactic Acid Bacteria. Ing y Cienc [Internet]. 2019 May 31 [cited 2021 Dec 29];15(29):179–213. Available from: https://publicaciones.eafit.edu.co/index.php/ingciencia/article/view/5417
- Paéz R, Lavari L, Vinderola G, Audero G, Cuatrin A, Zaritzky N, et al. Effect of heat treatment and spray drying on lactobacilli viability and resistance to simulated gastrointestinal digestion. Food Res Int [Internet]. 2012 Oct 1 [cited 2022 Jan 11];48(2):748–54. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0963996912002104
- Frakolaki G, Giannou V, Kekos D, Tzia C. A review of the microencapsulation techniques for the incorporation of probiotic bacteria in functional foods. https://doi.org/101080/1040839820201761773 [Internet]. 2020 [cited 2022 Jan 18];61(9):1515–36. Available from: https://www.tandfonline.com/doi/abs/10.1080/10408398.2020.1761773
- Liu H, Cui SW, Chen M, Li Y, Liang R, Xu F, et al. Protective approaches and mechanisms of microencapsulation to the survival of probiotic bacteria during processing, storage and gastrointestinal digestion: A review. Crit Rev Food Sci Nutr [Internet]. 2017 Sep 25 [cited 2022 Feb 17];59(17):2863–78. Available from: https://www.tandfonline.com/doi/abs/10.1080/10408398.2017.1377684
- Zhang Z, Peng S, Sun X, Jie Y, Zhao H, Zhu B, et al. A novel insight to screen the optimal spray-drying protectants and parameters for manufacturing lactic acid bacteria preparations. Dry Technol [Internet]. 2020 Oct 1 [cited 2021 Dec 30];38(14):1843–56. Available from: https://www.tandfonline.com/doi/abs/10.1080/07373937.2019.1674323
- El-Salam MHA, El-Shibiny S. Preparation and properties of milk proteins-based encapsulated probiotics: a review. Dairy Sci Technol [Internet]. 2015 Jul 3 [cited 2021 Dec 30];95(4):393–412. Available from: http://link.springer.com/10.1007/s13594-015-0223-8
- Santos G Dos, Nogueira RI, Rosenthal A. Powdered yoghurt produced by spray drying and freeze drying: a review. Brazilian J Food Technol [Internet]. 2018 Aug 16 [cited 2021 Dec 29];21. Available from: http://www.scielo.br/j/bjft/a/z36wyrYGCXy7xJcy6LZTXsR/?lang=en
- Wang N, Fu N, Chen XD. The extent and mechanism of the effect of protectant material in the production of active lactic acid bacteria powder using spray drying: a review. Curr Opin Food Sci. 2022 Apr 1;44:100807.
- Barbosa J, Borges S, Teixeira P. Influence of sub-lethal stresses on the survival of lactic acid bacteria after spray-drying in orange juice. Food Microbiol. 2015 Dec 1;52:77–83.
- Sugimoto S, Abdullah-Al-Mahin, Sonomoto K. Molecular Chaperones in Lactic Acid Bacteria: Physiological Consequences and Biochemical Properties. J Biosci Bioeng [Internet]. 2008;106(4):324–36. Available from: http://dx.doi.org/10.1263/jbb.106.324
Tag:CBPAV


