
PROBIÓTICOS, PREBIÓTICOS E SIMBIÓTICOS NA AVICULTURA: REVISÃO DE LITERATURA
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-7
Este trabalho foi escrito por:
Júlio Cesar Lopes Brasileiro1; João Marcos Monteiro Batista*1; Allan Gabriel Ferreira Dias1; Alison Batista Vieira Silva Gouveia1; Lorrayne Moraes de Paulo1; Fernando Ariel Moura Aranha1; Julia Marixara Sousa da Silva1
1Departamento de Zootecnia, Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia, Goiás.
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Com proibição de alguns antibióticos melhoradores de desempenho houve o favorecimento da síndrome disbiose a qual acarretou o na piora de alguns refletindo neste sentido, em redução dos índices de desempenho zootécnico na avicultura comercial. Objetivou-se através do estudo descrever os principais aspectos relevantes em relação às características, à utilização e aos mecanismos de ação dos aditivos equilibradores de microbiota do trato digestório de uso na avicultura com ênfase em probióticos, prebióticos e simbióticos. Os probióticos são microrganismos vivos associados que apresentam efeitos benéficos para animais e seres humanos, que quando administrados em níveis adequados, contribuem para a saúde do hospedeiro. Já o prebiótico é o substrato para espécies de Bifidobacterium e tal assimilação não é possível para espécies enteropatogênicas incluindo Clostridium sp. e Salmonella sp. Na mesma perspectiva o uso conjunto de probióticos e prebióticos forma os simbióticos são capazes de conferir ação benéfica ao hospedeiro por melhorar a sobrevivência e já são elucidados como aditivos moduladores de microbiota intestinal.
Palavras–chave: microrganismo vivos, microflora intestinal, modulador, substrato
Abstract: With the prohibition of some performance-enhancing antibiotics, it favored the appearance of the dysbiosis syndrome which resulted in the worsening of some, reflecting in this sense, in a reduction of the zootechnical performance indices in commercial poultry. Therefore, the objective of this study is to describe the main relevant aspects in relation to the characteristics, use and mechanisms of action of digestive tract microbiota balancing additives for use in poultry with emphasis on probiotics, prebiotics and symbiotics. Probiotics are associated live microorganisms that have beneficial effects for animals and humans, which when administered at adequate levels, contribute to the health of the host. The prebiotic is assimilated as a substrate for Bifidobacterium species and such assimilation is not possible for enteropathogenic species including Clostridium sp. and Salmonella sp. In the same perspective, the joint use of probiotics and prebiotics forms the symbiotics that are capable of conferring a beneficial action on the host by improving survival and are already elucidated as additives that modulate the intestinal microbiota.
Key Word: live microorganism, intestinal microflora, modulator, substrate
INTRODUÇÃO
A produção avícola brasileira tem crescido de forma significativa, onde a área de nutrição pode representar até 70% do custo total de produção para os animais de interesse zootécnico e a busca por novos produtos considerados mais seguros têm sido estudadas por pesquisadores da área tendo-se como base o conceito de Saúde Única, a qual traduz a união indissociável entre a saúde animal, humana e ambiental(1).
No contexto de nutrição animal, o uso de antibióticos é relatado desde a década de 40 e tem sido adotada como parte integrante das estratégias no sistema da avicultura comercial e o aumento dos desafios sanitários em função de uma maior densidade das aves, bem como outros fatores, intensificou a utilização dessas substâncias como promotores de crescimento ou de forma profilática no plantel(2). Com isso, ainda apresenta efeito positivo frente à produção e entre os principais efeitos associados ao uso de antibióticos são a prevenção de distúrbios digestivos, otimização dos nutrientes, reduções de lesões do epitélio intestinal e minimização da ocorrência de doenças subclínicas e metabólitos prejudiciais no organismo animal(3).
O Brasil, como o maior exportador mundial de carne de frango tem se adaptado às medidas impostas pelos mercados importadores visando a continuação das negociações e a busca constante de melhorias da cadeia produtiva tem intensificado estudos por substâncias alternativas que propiciem melhores índices de produção, redução de infecção e carcaças isentas de resíduos que possam levar efeitos negativos na saúde dos consumidores finais a longo prazo(4).
Ressalta-se que, seguindo a tendência internacional como Estados Unidos e Europa, o Brasil ao longo dos anos tem conduzido algumas medidas com o objetivo de minimizar o uso de antibióticos como aditivos melhoradores de desempenho. Diante da reavaliação do uso e proibição de alguns antibióticos melhoradores de desempenho favoreceu o aparecimento da síndrome disbiose a qual acarretou o aumento do índice de cama úmida, crescimento exagerado da microbiota, má absorção, mucosas delgadas e abauladas refletindo neste sentido, em redução dos índices de desempenho zootécnico na avicultura comercial(5).
Nesse sentido, a inclusão de aditivos em dietas de aves tem sido estudada com foco na manutenção e desenvolvimento do trato digestório e da saúde intestinal incluindo o equilíbrio da microbiota intestinal, reduzindo populações de microrganismos patogênicos, e dessa forma, otimizando a digestibilidade, absorção de nutrientes e índices de desempenho zootécnico. O objetivo dessa revisão é descrever os principais aspectos relevantes em relação às características, à utilização e aos mecanismos de ação dos aditivos equilibradores de microbiota do trato digestório de uso na avicultura com ênfase em probióticos, prebióticos e simbióticos.
TRATO DIGESTÓRIO
O trato digestório das aves (Figura 1) apresenta a divisão em diferentes segmentos que têm algumas particularidades importantes para o desenvolvimento e manutenção da homeostase das aves. O intestino delgado é dividido em três segmentos (duodeno, jejuno e íleo) enquanto o intestino grosso é composto pelos cecos, considerando que os segmentos cólon-reto não são bem delimitados como nos mamíferos.
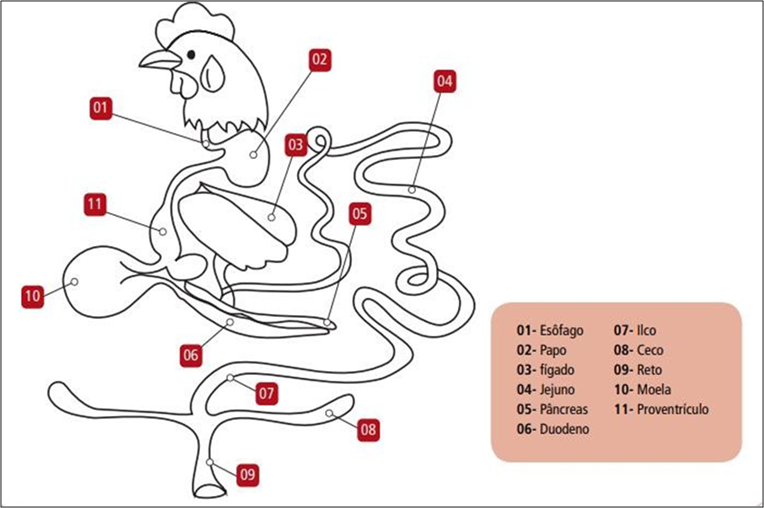
Fonte: Ilustrado por Amanda Duarte. Adaptado de Albino e Tavernari(6).
O duodeno ou alça duodenal, primeiro segmento do intestino delgado, abrange o pâncreas que segrega os canais biliares e pancreáticos contendo amilase, lipase e tripsina que auxiliam no mecanismo da digestão. O suco pancreático é responsável pela regulação do pH (5,7 – 6,1) e têm como função reduzir a acidez do bolo alimentar proveniente do pro-ventrículo e ventrículo otimizando a atuação enzimática e dos enterócitos(7).
O jejuno e íleo têm maior influência nos processos digestivos e efeito na microbiota através da absorção de nutrientes provenientes da dieta para a corrente sanguínea e, para as células e apresentam uma distinção quanto ao pH, em torno de 5,6 – 6,0 e 6,1 – 6,5, respectivamente. Nos cecos há a fermentação microbiana da fibra dietética juntamente com a produção de ácidos graxos de cadeia curta (acetato, propionato e butirato). Outras funções são descritas em menor proporção como absorção de água, carboidratos, proteínas e aminoácidos. Neste compartimento há variação no pH entre 5,8 e 6,2 e nas aves adultas e hígidas o comprimento dos cecos pode chegar até 15 cm e de todo intestino delgado, aproximadamente 140 cm(7-8).
A importância que o intestino delgado desempenha no processo de digestão é bem conhecida, entretanto é importante ter conhecimento acerca da eficácia dos demais processos digestivos e outros segmentos do trato digestório, tais como diâmetro regular médio, altura da camada de muco, espessura de epitélio etc. Manter a integridade do tecido epitelial significa ter o efeito positivo na relação altura de vilosidades e profundidade de cripta pois o maior tamanho de profundidade de cripta é indicativo de maior atividade de proliferação celular para adequar a taxa de renovação epitelial compensando as perdas nas extremidades das vilosidades. Nesse sentido uma relação desejável entre vilosidades e criptas intestinais ocorre quando as vilosidades se apresentam altas e criptas rasas pois quanto maior a relação vilo: cripta (Figura 2) melhor será a absorção de nutrientes e menores as perdas energéticas com a renovação celular(9-10).
De acordo com a histologia o epitélio intestinal três tipos celulares são descritos, células caliciformes, células enteroendócrinas e enterócitos e de acordo com Mazzoni et al(11) algumas condições crônicas como estresse térmico induziram alterações na expressão celular e na morfometria de duodeno, jejuno, cecos e inclusive no proventrículo através de uma redução significativa da espessura total da parede, circunferência e diâmetro epitelial.
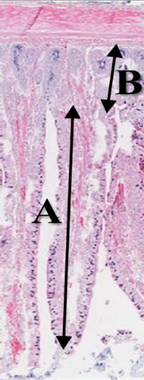
Quando exposto aos fatores crônicos o trato digestório é afetado negativamente, resultando em lesões nas células epiteliais da mucosa, atrofia das vilosidades, função da barreira epitelial prejudicada, efeito negativo frente ao sistema imune no GALT (gut-associated lymphoid tissue) e MALT (mucosa-associated lymphoid tissue) juntamente a variações na microbiota(13).
MICROBIOTA DO TRATO DIGESTÓRIO
Alguns estudos realizados em períodos passados acreditavam-se que o trato digestório das aves era estéril ainda no período de incubação e hoje se sabe que há a colonização de algumas populações de microrganismos no pinto saudável. Os microrganismos presentes no trato digestório das aves são provenientes da dieta e do meio ambiente sendo importante evidência que a microbiota pode ser alterada de acordo com a idade, segmentos do trato digestório, dieta, uso de aditivos e antibióticos e patologias pré-existentes(14).
A microbiota de frangos de corte contém em torno de 1011 unidades formadoras de colônia por grama (UFC/g) sendo a quantidade e gêneros de microrganismos são variáveis conforme a idade das aves e o segmento intestinal onde se encontram. Os microrganismos que compõem a microbiota intestinal ao colonizar os distintos segmentos do intestino estabelecem relação de cooperação, competição por nutrientes e aderência no lúmen promovendo o equilíbrio populacional(15). Os principais microrganismos componentes da microbiota intestinal dos frangos de corte são compostos principalmente por Lactobacillus sp., Coliformes Gram negativos, Estreptococcus fecais predominando S.faecallis, S. faecium e Anaeróbios abrangendo Eubacteria, Propionibacteria, Clostridia, Fusobacterium, Bacteroides, Ruminococcus entre outros coccus gram positivos(16). Estudos realizados por Macari et al.(17) confirmam que as bactérias predominantemente encontradas são os Lactobacillus sp., Clostridium sp., Streptococcus sp. assim como Enterococcus em frangos de corte jovens.
A distribuição desses microrganismos no trato digestório apresenta variação conforme as necessidades para sua melhor sobrevivência. Nesse sentido, a disponibilidade de oxigênio, mudanças de pH luminal, concentração de sais biliares, presença de bacteriocinas e ácidos graxos voláteis são algumas variáveis que modificam a presença desses microrganismos ou limita-os no intestino das aves. Desta forma, a população microbiana apresenta variação conforme o segmento do intestino, sendo que na porção inicial do duodeno a quantidade de microrganismos é inferior quando comparada às regiões finais(18).
A presença de bactérias e fungos em equilíbrio na microbiota são essenciais para o metabolismo e crescimento das aves pois participam de diversos processos fisiológicos, mantêm o equilíbrio dinâmico e a integridade epitelial além de otimizarem função anti-inflamatória pelo sistema imunológico da mucosa. Li et al.(19) demonstraram a complexidade de microrganismos presentes no trato digestório de frangos de corte e que a idade tem um efeito significativo sobre a composição e estabilidade da microbiota no período inicial até 3 dias, de 14 a 21 dias e de 35 a 42 dias de idade (Figura 3).
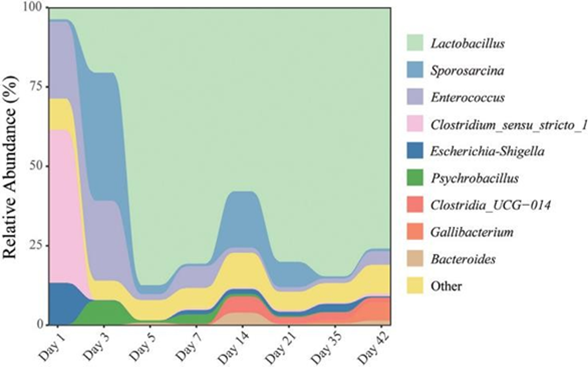
O equilíbrio da microbiota intestinal está relacionado de acordo com a composição, oscilação e os microrganismos benéficos os quais eliminam competitivamente a população patogênica controlam as bactérias que tem efeito negativo ou competidor. A população de microrganismos patogênicos pode comprometer a integridade da mucosa intestinal, lesionando vilosidades e tornando-as irregulares afetando assim, a taxa de renovação celular, o que pode refletir negativamente no desempenho zootécnico dos frangos de corte(20).
ANTIBIÓTICOS E ADITIVOS NA ALIMENTAÇÃO ANIMAL
A utilização de antibióticos na alimentação animal iniciou-se na década de 50 levando a uma otimização dos índices zootécnicos dos animais destacando melhores valores de conversão alimentar, ganho de peso, redução nas taxas de morbidade e mortalidade, o que levou a utilização de forma indiscriminada desses fármacos. O uso indiscriminado destes produtos gerou preocupações em virtude dos prejuízos à saúde humana levando a União Europeia a banir em 2007 o uso de grande parte desses fármacos na alimentação animal principalmente devido a possibilidade de desenvolvimento de resistência bacteriana e reações de hipersensibilidade oriundas de resíduos em alimentos direcionados ao consumo humano(21).
Na avicultura, o uso dessas substâncias acarretou efeitos positivos nos índices de desempenho zootécnico, vinculados à melhor taxa de conversão alimentar, ganho de peso concomitantemente à prevenção de doenças. Os antibióticos utilizados como promotores de crescimento têm de se apresentar relativamente baixo frente à concentração mínima inibitória (CMI) não sendo absorvidos e com ação principal no trato digestório visando o bloqueio e crescimento exagerado de microrganismos enteropatogênicos que promovem a redução inflamatória do epitélio intestinal(22).
As preocupações quanto ao uso dos antibióticos na cadeia produtiva animal persistem e o Brasil as reavaliam de forma constante esses produtos de modo a atualizar as legislações que regulamentam o uso destes produtos na alimentação animal. O Ministério da Agricultura, Pecuária e Abastecimento é o órgão competente para tratar dessas regulamentações e antibióticos como tilosina, lonomicina, virginiamicina, bacitracina e tiamulina foram proibídos pela portaria n° 171 no ano de 2018 e mais recentemente a lincomicina, através da instrução normativa n°1 de 13/01/2020(23).
Wee et al(24) descreveram a presença de microrganismos MDR colonizando animais de produção destinados à alimentação humana e que frequentemente algumas bactérias carreiam genes de resistência de importância clínica principalmente EsβL do tipo CTXM usualmente foi descrita em carne de frango. Nesse sentido a ocorrência desses genes está intimamente relacionado ao uso de antibióticos como promotores de crescimento podendo exercer uma pressão seletiva na microbiota e caso estejam localizados em MGEs podem ser transferidos para espécies de importância zoonótica refletindo na saúde pública(25,26).
A inclusão de alimentos alternativos na nutrição animal tem a otimização quanto a redução dos custos da produção, entretanto os índices zootécnicos podem ficar comprometidos em virtude do aproveitamento da energia ou proteína dos ingredientes por diversos fatores, como por exemplo a presença de fatores antinutricionais ou agente enteropatogênico. A inclusão de aditivos tem influência direta ou indireta onde a ave passa a otimizar os nutrientes provenientes da dieta contribuindo para um melhor desempenho e qualidade do produto final(27).
Os aditivos são descritos como substância, microrganismo ou produto formulado adicionado intencionalmente a dieta que não é usada normalmente como ingrediente, que tenha ou não valor nutritivo e que melhore as características dos produtos destinados à alimentação animal ou dos produtos animais. Nesse sentido que melhore o desempenho dos animais hígidos e atenda às necessidades nutricionais ou que tenha efeito anticoccidiano(28). Os aditivos zootécnicos equilibradores de microbiota com ênfase em probióticos, prebióticos e simbióticos presentam-se promissores e influem positivamente na saúde do hospedeiro e na busca por produtos, teoricamente mais seguros.
PROBIÓTICOS, PREBIÓTICOS E SIMBIÓTICOS
Os probióticos são descritos pela Organização das Nações Unidas para Alimentação e Agricultura (FAO/WHO) como microrganismos vivos associados que apresentam efeitos benéficos para animais e seres humanos, que quando administrados em níveis adequados, contribuem para a saúde do hospedeiro. Esses microrganismos ou leveduras devem ser capazes de resistir a passagem como também ter a capacidade de proliferação no trato digestório. Essas substâncias ainda, promovem benefícios para a saúde do hospedeiro como modulação da microbiota entérica e melhorias na imunidade e desempenho zootécnico(29).
De acordo a Instrução Normativa n°13 de 30/11/2004 do Ministério da Agricultura Pecuária e Abastecimento (MAPA) são classificados como cepas de microrganismos vivos viáveis que agem como auxiliares na recomposição da microbiota do trato digestivo dos animais contribuindo para a homeostase(30). O mecanismo de ação dos probióticos pode variar de acordo com diferentes microrganismos cepas ou leveduras que pode acarretar benefícios semelhantes, porém por vias distintas.
Os efeitos dos probióticos apresentam variação e não apresentam risco de toxicidade ou resistência microbiana, entretanto o efeito positivo dessas substâncias só ocorre quando há uma redução significativa de microrganismos enteropatogênicos(31).
De acordo com Berteli et al.(32) há a categorização dos probióticos em: Probióticos bacterianos e não-bacterianos: com a ressalva de certos fungos e leveduras como alguns dos gêneros Saccharomyces sp. e Aspergillus spp., o maior número dos probióticos é composto por cepas de bactérias. Evidenciam-se os gêneros: Lactobacillus sp., Bacillus sp., Enterococcus sp. e Bifidobacterium sp.
Probióticos formadores e não-formadores de esporos: algumas das bactérias de efeito probiótico podem se apresentar de forma esporulada, momento o qual paralisam sua atividade biosintética e reduzem sua taxa respiratória, sobrevivendo em situações adversas a seu desenvolvimento. São exemplos os Bacillus amyloliquefaciens e B. subtilis.
Probióticos multi-espécies e prebióticos de única espécie: um produto comercial probiótico pode ser composto por uma ou várias espécies bacterianas e/ou fúngicas, de forma associada. Probióticos alóctones e autóctones são relacionados ao fato de os micro-organismos da composição serem naturais do trato gastrointestinal da espécie hospedeira. Exemplo de bactérias autóctones da microbiota animal: Bifidobacterium sp. e Lactobacillus sp.
Segundo Lemos et al.(33) há necessidade de uma caracterização mais detalhada da microbiota devido a sua complexidade e grande variedade de microrganismos para uma melhor compreensão juntamente do conhecimento acerca da fisiologia do trato digestório sendo o principal local de ação dos probióticos que levam a modificações tróficas e imunomoduladoras.
Diversos fatores são relacionados com a eficácia do probiótico, tais como método de extração do microrganismo, espécies, capacidade de sobrevivência no trato digestório, via de administração, desafio ambiental, exposição a microrganismos externos, patologias pré-existentes e condição do sistema imune. Em aves, os mecanismos de ação dos probióticos já podem ser descritos de acordo com os estudos e alguns pontos são propostos como uma não exclusão de ação única e sim uma ação mútua com demais mecanismos e primordialmente a rápida estabilização no trato digestório das aves faz que o probiótico possa desempenhar suas funções de forma satisfatória(34-35).
Entre os distintos mecanismos de ação dos probióticos, são destacados: Exclusão competitiva por sítios de ligação e nutrientes que é uma importante forma de ação dos probióticos de distintos gêneros, tais como, Bacillus sp., Lactobacillus sp., Bifidobacterium sp. e Streptococcus sp. Nesse sentido, promovem a redução de microrganismos patogênicos no organismo da ave pelo mecanismo de competição por nutrientes essenciais, locais físicos de fixação(35).
Antagonismo direto, produção de compostos como lipopeptídeos antimicrobianos, surfactinas, bacteriocinas, ácidos orgânicos e peróxidos de hidrogênio que tem ação antibacteriana á microrganismos enteropatogênicos concomitante à estas interações sinérgicas que refletem na regulação da microbiota intestinal. Os probióticos do gênero Bacillus sp. desempenham esse mecanismo satisfatoriamente por produzirem um biofilme nas células epiteliais do intestino e dessa forma conferindo uma prevenção à colonização de enteropatógenos. Há a produção de peptídeos e lipopetídeos antimicrobianos (AMP) que são citotóxicos para diversos microrganismos patogênicos, principalmente para Eimeria spp. e Clostridum spp. que acarretam doenças de relevância sanitária na avicultura comercial(35-36).
Estímulo do sistema imune, onde a defesa imunológica do hospedeiro está relacionada com a microbiota e alguns microrganismos probióticos estão diretamente relacionados com o estímulo da resposta imune por meio do aumento da produção de anticorpos, ativação de macrófagos, proliferação de linfócitos T e produção de interferon. Mingmongkolchai & Panbangred(37) demonstraram que houve um estímulo para a produção de IgA e desenvolvimento do tecido linfoide associado ao intestino (GALT) juntamente com a produção de linfócitos de forma intraepitelial e células produtoras de imunoglobulinas.
Efeito nutricional, onde é observado a redução de pH intestinal promovido principalmente por microrganismos do gênero Lactobacillus sp. otimizando absorção de ácidos graxos de cadeia curta e que alguns probióticos promovem a digestão das fibras em aves e que alguns microrganismos são capazes de secretar amilase, protease e lipase(38).
Farhat-Khenakhlem et al.(39) demonstraram que cepas do Bacillus sp. em ensaio in vitro obtiveram propriedades probióticas satisfatórias, tais como, tolerância a condições severas de pH no trato digestório, maior adesão aos enterócitos e secreção de enzimas (fitase, amilase, xilanase e β- glucanase) importantes para neutralizar fatores antinutricionais da ração. Ainda dentro deste estudo, houve a melhora da digestibilidade em aproximadamente 48% em ocorrência da secreção enzimática já conhecida.
Supressão da produção de amônia, que assim como os antibióticos, há indicações de que os probióticos tenham efeito de reduzir a produção intestinal desse gás pela microbiota que pode apresentar níveis tóxicos para as células epiteliais. Conforme esboça Ahmed et al.(40) alguns gêneros de Bacillus sp. contribuíram para a redução da emissão de amônia oriundas das excretas das aves embora não esteja totalmente esclarecido esse mecanismo de redução e nessa perspectiva estudos com o mesmo gênero probiótico comprovam os resultados positivos na diminuição desse gás nocivo em decorrência da remoção de nitrogênio (N) e fósforo (P) o qual reflete positivamente no tratamento de dejetos provenientes da avicultura de corte e postura.
Os efeitos positivos observados com o uso de probiótico na dieta das aves estão diretamente relacionados a otimização da digestão e absorção através de secreções enzimáticas e morfologia das vilosidades intestinais, através da relação vilo: cripta que reflete na capacidade absortiva dos nutrientes provenientes da dieta. É definido que, a altura de vilosidades intestinais está diretamente relacionada com a capacidade absortiva de nutrientes, ao mesmo tempo que, a profundidade de cripta e relação vilo: cripta estão associadas à capacidade de renovação celular por ativação mitótica a qual confere melhora na saúde intestinal das aves(41).
Estudo realizado por Brasileiro(12) demonstrou resultados positivos frente ao uso da cepa de Bacillus amyloliquefaciens para a histomorfometria de duodeno e jejuno onde houve o aumento das vilosidades intestinais. No mesmo estudo em relação ao desempenho zootécnico foi observado efeito do uso da mesma cepa probiótica sobre a conversão alimentar no período de 1 a 21 dias de idade em frangos no período de 1 a 21 dias quando comparado ao grupo que não receberam adição do aditivo em suas rações.
Nessa perspectiva outra classe que apresenta evidência entre os aditivos moduladores de microbiota são os prebióticos, que apresentam efeito positivo. São definidos como “ingredientes que não são digeridos pelas enzimas digestivas do hospedeiro, mas que são fermentados pela microbiota do trato digestório dos animais contribuindo para o seu equilíbrio” e são regulamentados pela Instrução Normativa n°44 de 15/12/2015 do Ministério da Agricultura Pecuária e Abastecimento (MAPA)(42). As principais classes de prebióticos são oriundas de alguns açúcares absorvíveis ou não, fibras, peptídeos, proteínas, álcool de açúcares, oligossacarídeos de cadeia curta e dissacarídeos transgalactosilatados(43) e são diferenciados em frutoligossacarídeo (FOS), glucoligosacarídeo (GOS) e mananoligossacarídeo (MOS) para o uso em aves de corte e postura.
Os FOS são polímeros de frutose podendo ser naturais derivados de plantas como a inulina ou sintéticos, resultantes da polimerização da frutose(43). A inulina por exemplo, tem a capacidade de atravessar o segmento superior do trato digestório alcançando o intestino grosso no qual é fermentada por microrganismos benéficos (Acidophillus, Bifidus e Faecium) e convertida em ácidos graxos de cadeia curta (acetato, butirato e propionato), lactato e gases, minimizando a população de microrganismos enteropatogênicos como E.colli e Salmonella sp. por exclusão competitiva(44).
Xu et al(45). observaram um aumento da concentração da população de Bifidobacterium sp. e Lactobacillus sp. cecais juntamente com uma redução de E. coli no intestino de frangos alimentados com diferentes níveis de inclusão de FOS na dieta. Em ensaio laboratorial in vitro o crescimento de salmonela entérica sorovar Typhimurium foi inibido pelo sistema de fermentação em que o FOS foi adicionado(46).
Os GOS não são digeridos no trato digestório superior devido ás ligações β- (1,6) e β- (1,4) que evitam a ação enzimática pela β-galactosidase. Nesse sentido, esse grupo prebiótico é assimilado como substrato para espécies de Bifidobacterium e tal assimilação não é possível para espécies enteropatogênicas incluindo Clostridium sp. e Salmonella sp(47). Esse mecanismo de ação foi observado por Jung et al.(48) onde o efeito da inclusão de GOS associado ou não resultou em melhora na digestibilidade sem efeitos negativos ao desempenho juntamente com o aumento de Bifidobacterium sp. cecais.
A parede celular de Saccharomyces cerevisae destaca-se como uma das principais fontes de MOS rica em oligossacarídeos à base de alfa-manose e beta-glucose, glicose e proteína. O mecanismo de ação apresenta uma complexidade impedindo que microrganismos enteropatogênicos iniciem o processo de colonização ou modulando o sistema imunológico contra um processo infeccioso. Para que ocorra tal mecanismo é necessário que ocorra a adesão epitelial e tal adesão é possível em virtude da atração de glicoproteínas (lecitinas) presentes nas fímbrias pelos oligossacarídeos. O MOS apresenta alta afinidade favorecendo sítios de ligação dos quais se ligam a bactérias enteropatogênicas gram-negativas que possuem fímbria do tipo I que é específica para ligar-se aos oligossacarídeos. Nesse sentido, esse prebiótico tem a capacidade de modular a microbiota do trato digestório, reduzindo a taxa de renovação epitelial, minimizando lesões causadas por processos infecciosos, melhorando a relação vilo: cripta assim como otimizando a absorção de nutrientes, desempenho das aves e redução da mortalidade(49-50). A força de adesão entre o microrganismo patogênico e o MOS inibe o processo infeccioso e se adere ao epitélio intestinal formando uma barreira física que impede a colonização pela população de microrganismos indesejáveis(51).
A ativação do sistema imune das aves é outro mecanismo de ação descrito com o uso de prebióticos atraindo distintas células e outros componentes imunológicos para o trato digestório otimizando a barreira contra antígenos na mucosa. Nesse contexto ocorre uma reação em cascata com ativação de macrófagos e liberação de citocinas através de uma resposta imunológica adquirida após a ligação de MOS aos sítios receptores de macrófagos na superfície dos enterócitos mediante o reconhecimento de peptídeos específicos nesse epitélio. Savage et al.(52) demostraram níveis de anticorpos circulantes específicos elevados juntamente com a síntese de imunoglobulinas secretórias em resposta a exposição de antígenos como IgG plasmático e IgA na bile.
Na mesma perspectiva o uso conjunto de probióticos e prebióticos confere efeito positivo frente à saúde intestinal uma vez que a simbiose que ocorre no trato digestório impede que microrganismos enteropatogênicos como E. colli, Clostridium sp. e Salmonella sp. se sobressaiam sobre os benéficos e essa combinação de aditivos denominada simbióticos são capazes de conferir ação benéfica ao hospedeiro por melhorar a sobrevivência e modular a microbiota intestinal(50).
O que se espera do produto desse sinergismo ou simbiose do uso desses aditivos é a potencialização que ambos têm no trato digestório. Os probióticos inibem a maturação e desenvolvimento de microrganismos enteropatogênicos otimizando a absorção de nutrientes e processos infecciosos, no mesmo sentido que, os prebióticos impedem a adesão da população desses microrganismos às vilosidades intestinais devido á saturação dos sítios de ligação eliminando-as juntamente com as excretas(50). Al-Badanni et al.(53) realizaram um experimento com simbiótico a base de Bacillus subtilis e oligossacarídeos mananoligossacarídeos (MOS) e foi observada diferença significativa no perfil bioquímico do sangue em frangos desafiados sanitariamente.
Resultados demonstrados por Fornazier et al.(54) demonstraram resultados significativos com a inclusão de distintos níveis de simbiótico na dieta de frangos quando comparado com a ração com antibiótico como ganho de peso e conversão alimentar, no mesmo sentido que, houve efeito significativo no rendimento de peito ainda neste mesmo estudo. Resultados que foram de acordo com Maiorka et al.(55) que observaram o pior ganho de peso no grupo de frangos de corte alimentados com dieta isenta de probiótico, prebiótico ou associação de ambos os aditivos.
CONCLUSÕES
Mediante exigências de mercados importadores, a tendência é que cada vez mais antibióticos sejam minimizados na alimentação animal mesmo como promotores de crescimento considerando os efeitos negativos, mesmo que a longo prazo que podem causar no âmbito de saúde animal e saúde pública.
Os efeitos positivos dos probióticos, prebióticos e simbióticos já são elucidados como aditivos moduladores de microbiota tanto na avicultura de corte quanto na avicultura de postura juntamente aos mecanismos de ação. Entretanto, conhecimentos mais aprofundados a respeito da diversidade da microbiota, fatores adversos, sinergismo ou antagonismo dos microrganismos usados nos produtos poderão, futuramente, contribuir para a real compreensão dessas substâncias, principalmente no tocante aos simbióticos.
REFERÊNCIAS
- Kirchhelle, C. Pyrrhic progress antibiotics in Anglo-American food production (1935– 2013). Newark: Rutgers University Press. Kirchhelle, C. Pharming animals: a global history of antibiotics in food production (1935–2017). Humanities & Social Sciences Communications. ISSN (online): 2662-9992.
- Sakomura NK, Rostagno HS. Métodos de Pesquisa em Nutrição de Monogástricos. 2ª. ed. Jaboticabal: FUNEP – Fundação de Apoio a Pesquisa, Ensino e Extensão, 2016. v.1. 262p.
- Alexandrino SLSA, Costa TF, Silva NGD, Abreu JM, Silva NF, Sampaio SA, Christofoli M, Cruz LCF, Moura GF, Faria PP, Minafra CS. Intestinal microbiota and factors influencing poultry. Res., Soc. Dev. 2020; 9(6) e87963098.
- Huyghebaert G, Ducatelle R, Van Immerseel F. An update on alternatives to antimicrobial growth promoters for broilers. Vet. J. 2011; 187(2):182-188.
- Kuritza LN, Westphal P, Santin E. Probiotics on poultry production. Ciência Rural. 2014; 44(8):1457-1465.
- Frandson RD, Wilke WL, Fails AD. Anatomia e fisiologia dos animais da fazenda. 7.ed. Rio de Janeiro: Guanabara Koogan, 2011. 454 p.
- Liu W, Ye A, Han F, Han J. Advances and challenges in liposome digestion: Surface interaction, biological fate, and GIT modeling. Adv. Colloid. Interface Sci. 2018; 263:52‑67.
- Silva EIC. Avicultura: anatomia da galinha. 1a. ed. Instituto Federal de Educação Ciência e Tecnologia. Campus Belo Jardim-PE, 2020. 25 p.
- Garriga C, Hunter RR, Amat C, Planas JM, Mitchell MA, Moreto M., O estresse térmico aumenta o transporte apical de glicose no jejuno de galinha. Revista Americana de Fisiologia. Fisiologia Regulatória, Integrativa e Comparativa. 2006; 290:195-201.
- Li DF, Nelssen JL, Reddy PG, Blecha F, Klemm R, Goodband RD. Interrelationship between hypersensitivy to soybean proteins and growth performance in early weaned pigs. J. Anim. Sci. 1991; 69(10):4062-4069.
- Mazzoni M, Zampiga M, Clavenzani P, Lattanzio G, Tagliavia C, Sirri F. Effect of chronic heat stress on gastrointestinal histology and expression of feed intake-regulatory hormones in broiler chickens. Animal. 2022; 16(8):100600.
- Brasileiro JCL. Probiótico na dieta de frangos de corte. 2021. 37 p. Dissertação (Mestrado em Zootecnia) – Universidade Federal de Goiás, Goiânia, 2021. Disponível em:< https://repositorio.bc.ufg.br/>. Acesso em: 18 ago. 2022.
- Santos RR, Awati, A, Roubos-van den Hil PJ, Tersteeg-Zijderveld MHG, Koolmees PA, Fink Gremmels J. 2015. Quantitative histo-morphometric analysis of heat-stress-related damage in the small intestines of broiler chickens. Avian Pathol. 2015; 44(1):19-22.
- Shang Y, Kumar S, Thippareddi H, & Kim WK. Effect of dietary fructooligosaccharide (FOS) supplementation on ileal microbiota in broiler chickens. Poultry science, 2018; 97(10), 3622-3634.
- Tardocchi CFT, Cabral NO. Técnicas de vacinação para prevenção de doenças na avicultura. Revista Eletrônica Nutritime. 2020; 17(04):8749-8754.
- Ali Q, Ma S, La S, Guo Z, Liu B, Gao Z, & Shi Y. Microbial short-chain fatty acids: a bridge between dietary fibers and poultry gut health—A review. Animal Bioscience, 2022; 35(10), 1461-1478.
- Macari M, Naas IA, Mendes AA. Produção de Frangos de Corte. Campinas: FACTA, 2004. 365 p. CDU: 636.5.
- Mello PD. Uso de antibióticos em animais de produção. Revista Científica Eletrônica de Medicina Veterinária. 2009; 7(12).
- Ming-Han L, Jin-Xin M, Wang W, He M, Zhao ZY, Ma N, Lv QB, Qin YF, Geng H-L, Zhao Q, Ni HB, Zhang X-X, Dynamic description of temporal changes of gut microbiota in broilers. Poult. Sci. 2022; 101(9):102037.
- Santos II, Poli A, Padilha MTS. Desempenho zootécnico e rendimento de carcaça de frangos de corte suplementados com diferentes probióticos e antimicrobianos. Acta Sci. Anim. Sci. 2008; 26(1):29-33.
- Cai J, Liu F, Liao X, Zhang R. Complete genome sequence of Bacillus amyloliquefaciens LFB112 isolated from Chinese herbs, a strain of a broad inhibitory spectrum against domestic animal pathogens. J. Biotechnol. 2014; 175:63-64.
- Alexandrino SLSA, Costa TF, Silva NGD, Abreu JM, Silva NF, Sampaio SA, Christofoli M, Cruz LCF, Moura GF, Faria PP, Minafra CS. Intestinal microbiota and factors influencing poultry. Res., Soc. Dev. 2020; 9(6): e87963098.
- Brasil, 2020. Instrução normativa nº 1, de 13 de janeiro de 2020. Ministério da Agricultura Pecuária e Abastecimento (MAPA), ed.16, seção. 1, p. 6. Disponível em: < https://www.in.gov.br/>. Acesso em: 10 ago. 2022.
- Wee BA, Muloi DM, Bunnik BAD. 2020. Quantifying the transmission of antimicrobial resistance at the human and livestock interface with genomics. Clin. Microbiol. Infect. 2020; 26(12):1612–1616.
- Xiong W, Wang Y, Sun Y, Ma L, Zeng Q, Jiang X, Li A, Zeng Z, Zhang T. Antibiotic-mediated changes in the fecal microbiome of broiler chickens define the incidence of antibiotic resistance genes. Microbiome. 2018; 6(34):1-11.
- Lemos MJ, Calixto LFL, Torres-Cordido KAA, Reis TL. Uso de aditivo alimentar equilibrador da flora intestinal em aves de corte e de postura. Arquivos do Instituto Biológico. 2016; 83:1-7.
- Sakomura NK, Silva JHV, Costa FGP, Fernandes JBK, Hauschild L. Nutrição de Não Ruminantes. 1ª. ed. Jaboticabal: Funep, 2014. v. 1. 678p .
- Food and Agriculture Organization of the United Nations (FAO). Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria. Córdoba, Argentina, 34 p, 2002. Disponível em: < http://www.fao.org/>. Acesso em: 19 ago. 2022.
- BRASIL, 2004. Instrução normativa nº 13, de 30 de novembro de 2004, Ministério da Agricultura Pecuária e Abastecimento (MAPA). Regulamento técnico sobre aditivos para produtos destinados à alimentação animal. Disponível em: < https://www.gov.br/>. Acesso em: 19 ago. 2022.
- Silva PC, Oliveira PG, Guedes MRA, Trindade DC. Identificação de cepas do gênero Lactobacillus com potencial probiótico isoladas do trato gastrointestinal de suínos. Rev. Epist. Trans. 2020; 11(1):223-241.
- Berteli CR. Probiótico (Bacillus amyloliquefaciens) e antimicrobiano melhorador de desempenho em dietas de leitões na fase de creche. 2019. 43 p. Dissertação (Mestrado em Zootecnia) – Universidade Federal de Goiás, Goiânia, 2019.
- Lemos MJ, Calixto LFL, Torres-Cordido KAA, Reis TL. Uso de aditivo alimentar equilibrador da flora intestinal em aves de corte e de postura. Arq. Inst. Biol. 2016; v.83, 1-7, e0862014.
- Ajuwon KM. Toward a better understanding of mechanisms of probiotics and prebiotics action in poultry species. J. Appl. Poult. Res. 2016; 25(1-2):277-283, 2016.
- Cai J, Liu F, Liao X, Zhang R. Complete genome sequence of Bacillus amyloliquefaciens isolated from Chinese herbs, a strain of a broad inhibitory spectrum against domestic animal pathogens. J. Biotechnol. 2014; 175:63-64.
- Oliveira MJK, Sakomura NK, Dorigam JCP, Doranalli K, Soares L, Viana GS. Bacillus amyloliquefaciens CECT 5940 alone or in combination with antibiotic growth promoters improves performance in broilers under enteric pathogen challenge. Poult. Sci. 2019; 98(10):4391-4400.
- Mingmongkolchai S, Panbangred W. Bacillus probiotics: an alternative to antibiotics for livestock production. J. Appl. Microbiol. 2018;124(6):1334-1346.
- Freitas ER, Rabello CBV, Watanabe PH. Probióticos e prebióticos na nutrição de monogástricos. In: Sakomura NK, Silva JHV, Costa FGP, Fernandes JBK, Hauschild L. Nutrição de Não Ruminantes. 1ª. ed. Jaboticabal: Funep, 2014. v. 1. 678p .
- Farhat-Khenakhlem A, Blibech M, Boukhris I, Makni M, Chouayekh H. Assessment of the potential of the multi-enzyme producer Bacillus amyloliquefaciens US573 as alternative feed additive. J. Sci. Food. Agric. 2018; 98(3):1208-1215.
- Aly SM, Ahmed YAG, Ghareeb AAA, Mohamed MF. Studies on Bacillus subtilis and Lactobacillus acidophilus, as a potential probiotic in the immune response and resistence of Tilapia nilotica (Oreochromis niloticus) to challenge infections. Fish Shellfish Immunol. 2008; 25(1-2):128-36.
- Xu J, Xu C, Chen X, Cai X, Yang S, Sheng Y, Wang T Regulation of an antioxidant blend on intestinal redox status and major microbiota in early weaned piglets. Nutrition. 2014; 30(5):584-9.
- BRASIL, 2015. Instrução normativa nº 44, de 15 de dezembro de 2015, Ministério da Agricultura Pecuária e Abastecimento (MAPA). Regulamento técnico sobre aditivos para produtos destinados à alimentação animal. Disponível em: < https://www.gov.br/>.
- Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J. Nutr. 1995; 125(6):1401-1412.
- Scapinello C, Faria HG, Furlan AL, Michelan AC. Efeito da utilização de oligossacarídeo manose e acidificantes sobre o desempenho de coelhos em crescimento. R. Bras. Zootec. 2001; 30(4):1272-1277.
- Xu ZR, Hu CH, Xia MS, Zhan XA, Wang MQ. Effects of dietary fructooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poult. Sci. 2003;82(6):1030-1036.
- Donalson LM, Kim WK, Chalova VI, Herrera P, Woodward CL, Mcreynolds JL, Kubena LF, Nisbet DJ, Ricke SC. In vitro anaerobic incubation of Salmonella enterica serotype Typhimurium and laying hen cecal bacteria in poultry feed substrates and a fructooligosaccharide prebiotic. Anaerobe. 2007; 13(5-6):208-214.
- Alles MS, Hartemink R, Meyboom S, Harryvan JL, Van Laere KM, Nagengast FM, Hautvast JG. Effect of transgalactooligosaccharides on the composition of the human intestinal microflora and on putative risk markers for colon cancer. Am. J. Clin. Nutr.1999; 69:980-991.
- Jung SJ, Houde R, Baurhoo B, Zhao X, Lee BH. Effects of galacto-oligosaccharides and a Bifidobacteria lactis-based probiotic strain on the growth performance and fecal microflora of broiler chickens. Poult. Sci. 2008; 87(9):1694-1699.
- Shane MS. Mannan oligosaccharides in poultry nutrition: mechanism and benefits. Science and technology in the feed industry. Nottingham, UK: Nottingham, 2001. p.65-77.
- Faria IS. Avaliação da inclusão de aditivo simbiótico em dietas para frangos. 2022. 54 p. Dissertação (Mestrado em Zootecnia) – Universidade Federal de Goiás, Goiânia, 2022. Disponível em: < https://repositorio.bc.ufg.br/>. Acesso em: 22 ago. 2022.
- Pelicano ERL, Souza PA, Souza HBA. Prebióticos e probióticos na nutrição de aves. Revista Ciências Agrárias e da Saúde. 2002; 2(1):59-64.
- Cotter PF. Modulation of immune response: current perceptions and future prospects with an example from poultry. In: Alltech’s Annual Symposium On 90 Biotechnology In Feed Industry, 10., 1994, Nottingham. Proceedings… Loughborough, UK: Nottingham University Press, 1994. p.105-203.
- Savage TF, Zakrewska EI, Andreasen JR. The effects of feeding mannan oligosaccharide supplemented diets to poultrys on performance and the morphology of the small intestine. Poult. Sci. 1997; 76:139-149.
- Al-Baadani HH, Abudabos AM, Al-Mufarrej SI, Al-Baadani AA, Alhidary IA. Dietary supplementation of Bacillus subtilis, Saccharomyces cerevisiae and their symbiotic effect on serum biochemical parameters in broilers challenged with Clostridium perfringens. J. Appl. Anim. Res. 2018;46(1):1064–1072.
- Fornazier R, Ribeiro Junior V, Albino LF, Rodrigues DJ, Tavernari F de C, da Silva DL. A symbiotic improves performance and carcass yield of broilers. J. Appl. Poult. Res. 2019; 28(2):383–389.
- Maiorka A, Santin E, Sugeta SM, Almeida JG, Macari M. Utilização de prebióticos, probióticos ou simbióticos em dietas para frangos. Braz. J. Poult. Sci. 2001; 3(1):75-82.
Tag:CBPAV
