
POTENCIAL ANTIMICROBIANO DE FILMES BICAMADA À BASE DE AMIDO DE BATATA-DOCE COM ÓLEO ESSENCIAL DE TOMILHO (THYMUS VULGARIS) ENCAPSULADO EM NANOFIBRAS DE ZEÍNA PARA A APLICAÇÃO EM ALIMENTOS
Capítulo de livro publicado no livro da III Semana Nacional da Microbiologia de Alimentos na Indústria. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/IIISEMICRO-14
Este trabalho foi escrito por:
Jéssica Silveira Vitoria *; Denise Oliveira Pacheco ; Laura Martins da Fonseca ; Tatiane Kuka Valente Gandra ; Elessandra da Rosa Zavareze ; Eliezer Avila Gandra
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: O controle microbiano é uma preocupação constante na indústria de alimentos. A utilização de conservantes naturais para alimentos, bem como de embalagens bioativas capazes de inibirem e/ou inativarem o crescimento bacteriano vem ganhando atenção. Nesse cenário, no presente trabalho objetivou-se avaliar a atividade antimicrobiana de filmes bicamada à base de amido de batata-doce com óleo essencial de tomilho (Thymus vulgaris) (OET) encapsulado em nanofibras de zeína contra as bactérias Escherichia coli e Staphylococcus aureus. O filme foi produzido pela técnica de casting e as nanofibras de zeína com óleo essencial encapsulado por meio da técnica de electrospinning. A avaliação in vitro da atividade antimicrobiana foi determinada pelo método de microatmosfera. Os resultados indicaram atividade antimicrobiana na concentração de 65% (p/v) do OET contra as bactérias testadas. Houve redução de 97% e 90% para S. aureus e E. coli, respectivamente. Deste modo foi possível concluir que o filme bicamada antimicrobiano apresenta potencial para uma possível aplicação como embalagem ativa para alimentos.
Palavras–chave: compostos bioativos; Escherichia coli; microatmosfera; Staphylococcus aureus
Abstract: Microbial control is a constant concern in the food industry. Using natural food preservatives and bioactive packaging capable of inhibiting and/or inactivating bacterial growth has been receiving increasing attention. In this scenario, this work aimed to evaluate the antimicrobial activity of bilayer films based on potato starch with thyme essential oil (Thymus vulgaris) (TEO) encapsulated in zein nanofibers against Escherichia coli and Staphylococcus aureus bacteria. The film was produced using the casting technique and the zein nanofibers with essential oil encapsulated using the electrospinning technique. In vitro evaluation of the antimicrobial activity was determined by the micro-atmosphere method. The results indicated antimicrobial activity at the concentration of 65% (w/v) of TEO against the tested bacteria. There was a 97% and 90% reduction for S. aureus and E. coli, respectively. Therefore, it can be concluded that the antimicrobial bilayer film has the potential for a possible application as active food packaging.
Keywords: bioactive compounds; Escherichia coli; micro-atmosphere; Staphylococcus aureus
INTRODUÇÃO
Segundo o Ministério da Saúde (1), Doenças de Transmissão Hídrica e Alimentar (DTHA) são aquelas causadas pela ingestão de água e/ou alimentos contaminados. Existem mais de 250 tipos de DTHA no mundo, podendo ser causadas por bactérias e suas toxinas, vírus, micotoxinas, parasitas intestinais oportunistas ou substâncias químicas. É considerado surto de DTHA quando duas ou mais pessoas apresentam doença ou sinais e sintomas semelhantes após ingerirem alimentos e/ou água da mesma origem, normalmente em um mesmo local. Entre os anos de 2012 e 2021 foram notificados no Brasil um total de 6.347 surtos de DTHA, a maioria das ocorrências (37,7%) foi causada em residências e os principais agentes etiológicos foram Echerichia coli (29,6%) e Staphyloccocus aureus (12,9%) (2).
Escherichia coli é uma bactéria anaeróbica facultativa pertencente à família Enterobacteriaceae, um bacilo Gram-negativo, presente na microbiota intestinal de vertebrados (3). Suas cepas podem causar patologias extraintestinais (por exemplo, infecções do trato urinário, diversas infecções intra-abdominais, pulmonares, cutâneas e de tecidos moles, meningite neonatal e bacteremia) e patologias intestinais (várias formas de diarreia, incluindo síndrome hemolítica e urêmica) (4).
As cepas patogênicas de E. coli são classificadas em patótipos (também conhecidos como patovares) (5), e são identificadas por meio de siglas. Esses patótipos foram baseados por vários critérios, como órgão-alvo, o hospedeiro infectado, a associação com um órgão e hospedeiro, a associação com os órgãos-alvo, a presença de genes específicos e a patologia causada pelas cepas. Dentre os patótipos que se destacam por causarem infecção intestinal em humanos, tem-se a E. coli enteropatogênica (EPEC), E. coli enterotoxigênica (ETEC), E. coli enterohemorrágica (EHEC) ou E. coli produtora da toxina de Shiga (STEC), E. coli enteroinvasora (EIEC), E. coli enteroagregativa (EAEC) e E. coli aderente difusa (DAEC) (6).
O surgimento de cepas altamente virulentas, capazes de sobreviver em ambientes hostis, incluindo água, solo e plantas (7, 8), causando surtos em larga escala é uma grande preocupação. Ao longo da cadeia alimentar a contaminação cruzada de produtos alimentícios é um fator de risco à segurança alimentar, atribuído a surtos em grandes centros de processamento e distribuição de alimentos (9). Devido as suas características E. coli é utilizada como modelo de bactéria Gram-negativa para avaliar a ação de substâncias antimicrobianas.
Staphylococcus aureus também se destaca por ser um patógeno de grande relevância, Gram-positivo, anaeróbico facultativo de origem alimentar, capaz de sobreviver a uma ampla variação de fatores extrínsecos como temperatura (entre 7 °C e 48,5 °C), pH (entre 4,2 e 9,3) e concentrações de NaCl (entre 0 e 15%) (10, 11). É capaz de produzir enterotoxinas que são liberadas durante sua multiplicação no alimento ocasionando diarreia intensa e vômito algumas horas após a ingestão (12). Dentre as enterotoxinas produzidas, as enterotoxinas estafilocócicas (EEs) clássicas (A, B, C, D e E) são responsáveis por 95% dos surtos (13, 14, 15).
Além disso, por ser uma bactéria formadora de biofilmes, S. aureus é capaz de permanecer em superfícies e utensílios, o que ocasiona interações intercelulares com a troca de material genético que resultam em bactérias com menor suscetibilidade aos antimicrobianos existentes (16). Devido a essas características, a intoxicação alimentar estafilocócica está entre as formas comuns de surtos de intoxicação alimentar bacteriana (17). No ano de 2017, a Organização Mundial da Saúde (OMS) classificou S. aureus como um patógeno de alta prioridade (18). Assim como E. coli é utilizada como modelo de bactéria Gram-negativa, S. aureus é amplamente utilizado como modelo de bactéria Gram-positiva para avaliar a ação de substâncias antimicrobianas.
Tendo em vista possíveis ameaças de origem alimentar, associadas às implicações sociais e econômicas, surge a demanda por assegurar o fornecimento de alimentos mais seguros por meio do desenvolvimento de novos agentes conservantes não tóxicos com propriedades antimicrobianas e antioxidantes. Com isso, é crescente o interesse pelo uso de conservantes alimentícios naturais, já que aditivos químicos sintéticos, comumente utilizados para o controle de patógenos na indústria de alimentos, oferecem preocupações relacionadas à saúde por parte do consumidor (19, 20).
Estudos têm sido realizados com o intuito de investigar agentes antimicrobianos naturais que podem inibir o crescimento, a adesão e a formação de biofilme por microrganismos patogênicos como S. aureus e E. coli (21). Neste contexto, com o objetivo de substituir os conservantes sintéticos, os óleos essenciais (OEs), líquidos oleosos voláteis obtidos de diferentes partes de plantas, começaram a ser considerados alternativas de agentes antimicrobianos naturais. Esses óleos podem ser utilizados para inibir a deterioração, prolongar o prazo de validade sob a percepção de “estratégia orgânica ou verde”, representando uma nova barreira para garantir a diminuição de patógenos de uma matriz alimentar (20, 22). Incluído na lista de Generally Recognized as Safe (GRAS) para uso como aditivo alimentar pela United States Food and Drug Administration (23), o óleo essencial de tomilho (Thymus vulgaris) é um exemplo de conservante natural que se destaca por sua atividade antimicrobiana e antioxidante (24).
Apesar da alta eficiência dos OEs como antimicrobiano em testes in vitro, quando aplicado diretamente na matriz de alimentos o mesmo efeito só é alcançado com maior concentração de EOs (25), o que pode levar a possíveis impactos negativos nas propriedades sensoriais do alimento (22). Esse problema pode ser solucionado por meio de abordagens que tornem a liberação e o contato do OE com a matriz alimentícia gradual ou até mesmo indireto. Técnicas como a nanoencapsulação de OEs e/ou a incorporação destes em filmes biodegradáveis e revestimentos tem como objetivo proteger o alimento contra a contaminação microbiana, mantendo ativa por um longo período de tempo altas concentrações da substância na superfície do alimento (26).
Além disso, atualmente os materiais que têm sido convencionalmente aplicados em embalagens de alimentos contêm papel, plástico, cerâmica, entre outros, que têm impactos ecológicos significativos na poluição ambiental (27). Embalagens biodegradáveis com propriedades antibacterianas para a aplicação em alimentos com excelentes desempenhos e funções tornaram-se uma nova demanda de pesquisa (28). Desta forma, o presente trabalho teve como objetivo avaliar in vitro um filme biodegradável à base de amido de batata-doce adicionado de óleo essencial de tomilho (Thymus vulgaris) encapsulado em nanofibras de zeína com potencial antimicrobiano contra a Staphylococcus aureus e Escherichia coli.
MATERIAL E MÉTODOS
Para a produção dos filmes biodegradáveis utilizou-se amido de batata-doce amarela “Amélia” (Ipomoea batatas L.) e glicerol (Labsynth, CAS 56-81-5). A suspensão do filme foi preparada com 4% de amido utilizando água destilada e glicerol como plastificante na relação de 0,30 (gplastificante/gamido), por meio da técnica de casting proposta por Fonseca et al. (29), a suspensão foi aquecida sob agitação até atingir 90 °C e permaneceu por 30 min sob agitação para completa gelatinização do amido. Em seguida a suspensão foi resfriada a 50 °C, 25 g foram despejados em placas de acrílico (Ø 8,5 cm), e foram secos a 35 °C em estufa com circulação forçada de ar por 16 h.
Para a produção das soluções poliméricas formadoras de nanofibras de zeína com óleo essencial foi utilizado o óleo essencial de tomilho (Thymus vulgaris L.), obtido comercialmente da empresa Ferquima (CAS 800-46-3), Indústria e Comércio de Óleos Essenciais, acondicionado em frasco âmbar, lacrados, com volume de total de 100 mL contendo majoritariamente os seguintes compostos fenólicos: timol (50%), p-cimeno (30%), gamma-terpineno (6%), linalol (5%), carvacrol (5%), alfa-pinene (2%). A Zeína comercial foi obtida da empresa Sigma-Aldrich, Brasil (97% pureza, CAS 9010-66-6) e álcool etílico (99,9% pureza, CAS 64-17-5) para produção das membranas de nanofibras.
Para a produção de nanofibras foi utilizado 30% de zeína (p/v). Inicialmente, a zeína foi dissolvida em solução aquosa de etanol a 70% (v/v, em água ultrapura) sob agitação por 30 minutos a temperatura ambiente (25 ± 2 °C). Foi utilizada a concentração de 65% de óleo essencial de tomilho (v/p, óleo essencial de tomilho/zeína). O óleo essencial foi adicionado às soluções poliméricas e agitado durante 15 min no escuro a 25 ± 2 °C (30).
As membranas de nanofibras foram produzidas por meio da técnica de electrospinning de acordo com metodologia adaptada de Böhmer-Maas et al. (30). Após o preparo a solução polimérica foi injetada em uma seringa plástica de 10 mL, acoplada diretamente em uma agulha metálica de aço inoxidável de 0,8 mm de diâmetro. A solução foi bombeada por uma bomba de infusão de seringa (KD Scientific, Modelo 100, Holliston, Inglaterra). Foi posicionado um alvo coletor a uma distância de 20 cm da ponta da agulha, coletando-se 10 mL da solução e tendo como substrato de coleta das membranas de nanofibras os filmes biodegradáveis produzidos. O campo elétrico foi aplicado por uma fonte de alta tensão (5 – 50 kV, Modelo FA+30kV, Brasil).
A avaliação in vitro do efeito antimicrobiano do filme de amido, do filme de amido com nanofibras de zeína e do filme de amido com nanofibras de zeína e óleo essencial de tomilho (Thymus vulgaris) encapsulado, foi realizada pelos ensaios de microatmosfera. Foram testados os efeitos antimicrobianos do filme bicamada sobre as cepas padrão das espécies de bactérias Escherichia coli (ATCC 43895) e Staphylococcus aureus (ATCC 10832) adquiridas da Fundação André Tosello. A escolha destas espécies se deu pelo fato de possibilitar o teste do composto contra modelos de bactérias Gram-positivas (Staphylococcus aureus) e Gram-negativas (Escherichia coli).
Os microrganismos utilizados no experimento foram mantidos em ultrafreezer sob congelamento em caldo Brain Heart Infusion (BHI) e glicerol (propano-1,2,3-triol) na proporção 3:1 (v:v). Para realizar a reativação, uma alçada dessas bactérias foi transferida para caldo Soja Tripticaseína (TSB) e incubada em estufa durante 24 h a 37 ºC. Após, uma alçada desse crescimento foi estriada em placas de Petri com meios seletivos, sendo ágar Eosina Azul de Metileno (EMB) para Escherichia coli e ágar Baird-Parker para Staphylococcus aureus, e incubada por 24 h a 37 °C, para o isolamento das colônias. Após este período, com uma alçada, foi extraída uma colônia e ressuspendida em solução salina (NaCl) 0,85%, a qual foi padronizada na concentração 0,5 na escala de McFarland (1,5 x 108 UFC mL-1). Todos os ensaios foram realizados em triplicata.
A atividade antimicrobiana em microatmosfera foi avaliada pela técnica proposta por Ghabraie et al. (31) com pequenas modificações, discos de celulose foram substituídos pelos filmes bicamada. Alíquotas de 0,1 mL de suspensões celulares dos microrganismos foram inoculados na superfície de placas com ágar Müller -Hilton (MH) (15 mL/ camada de 6 mm). Na tampa de cada placa de Petri foram posicionados discos com 47 mm de diâmetro do filme de amido com nanofibras de zeína e óleo essencial de tomilho. Posteriormente, as placas foram imediatamente fechadas de modo invertido (tampa para baixo), e incubadas a 37 °C por 24 h. A ação antimicrobiana foi expressa pelo percentual de redução na contagem celular (UFC) dos tratamentos comparados com um controle, apenas o inóculo sem nenhum dos filmes.
RESULTADOS E DISCUSSÃO
Na Figura 1 é possível observar o percentual de inibição do OET contra bactérias Gram-positiva e Gram-negativa. Por meio da técnica de microatmosfera, ao utilizar o filme com o OET encapsulado em nanofibras de zeína, houve redução de 97% na concentração de S. aureus e de 90% na de E. coli., o que não foi possível observar quando utilizado apenas o filme de amido ou o filme de amido com nanofibras zeína.
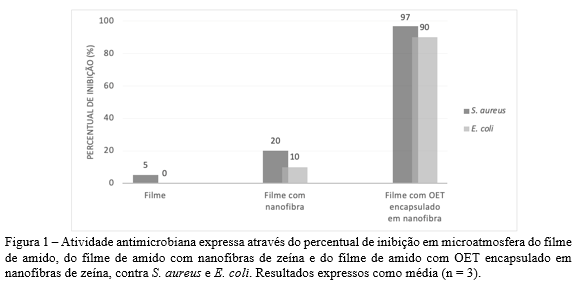
Utilizando o filme de amido com nanofibras de zeína, sem o OET, não se obteve redução significativa das bactérias estudadas. Alcançando apenas um percentual de inibição de 20% contra S. aureus e 10% contra E. coli. Segundo Sato et al. (32) os principais compostos do OET, timol e carvacrol, se destacam por ser responsáveis por exercer atividade antimicrobiana por meio de mecanismos, como danos à membrana celular de bactérias, aumento da permeabilidade celular, alteração dos ácidos graxos da membrana e efeito nas proteínas da membrana. O OET ao ser encapsulado, dando origem a nanoestruturas, permite que a zeína forneça proteção e transporte. Este material de parede serve como barreira à umidade para os materiais ativos encapsulados, melhorando sua estabilidade e reduzindo sua taxa de degradação (33, 34).
A análise da atividade antibacteriana de OEs em microatmosfera, diferente de outras análises, não promove contato direto do OE com a bactéria ou com o meio de cultura. Assim, a ação antibacteriana ocorre em função dos compostos voláteis presentes no óleo, que em fase de vapor entram em contato com a bactéria (35). Permite-se assim que o OE tenha sua ação sem a necessidade de se difundir ou se dispersar em meios de cultura (ágar ou caldo) de base aquosa, visto que sua capacidade de dispersão/difusão pode ser afetada, pois se tratam de compostos hidrofóbicos (31).
Dannenberg et al. (36) utilizaram a técnica de microatmosfera para analisar a ação do OE de pimenta-rosa incorporado em filmes de acetato de celulose e verificaram reduções significativas no crescimento de S. aureus e E. coli. Resultados semelhantes foram encontrados ao testar o efeito do OE de canela e mostarda contra B. cereus, E. coli, Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas putida e Pectobacterium carotovorum, onde houve 100% de redução do crescimento bacteriano (37). Chen et al. (38) obtiveram 93,4 ± 1 e 100% de redução nas contagens de S. aureus e E. coli respectivamente, aplicando 1 g de filme de sulfato de celulose contendo OE de mostarda em microatmosfera.
Frutas armazenadas em embalagens contendo nanofibras como encapsulante do OET foram beneficiadas com a volatilização desse composto ao apresentarem redução significativa na contagem total de bactérias, fungos e leveduras durante 15 dias de armazenamento a 4 °C (39). A aplicação de agentes antimicrobianos naturais na estrutura de filmes é um dos métodos inovadores na concepção de embalagens ativas (40). Embalagens primárias, que estão em contato direto com os alimentos, têm papel crítico como a primeira barreira contra a contaminação por microrganismos patogênicos e/ou deteriorantes (41).
A incorporação de nanocarreadores carregados com antimicrobianos na estrutura de embalagens, permite que os mesmos sejam liberados, de forma prolongada e constante, no espaço livre da embalagem e, em seguida, entrem em contato com o alimento (42, 43). Além disso, polímeros comuns usados para a produção de embalagens são polímeros à base de petróleo. Apesar de suas vantagens, existem alguns problemas em seu uso no setor de alimentos, como sua natureza química e imposição de questões ambientais (41). Recentemente, o uso de materiais à base de biopolímeros para a produção de embalagens ativas tem aumentado, por serem provenientes de recursos renováveis, comestíveis, ecologicamente corretos e flexíveis de produzir (44).
Dessa forma, a baixa capacidade dos sistemas de embalagem convencionais em atender adequadamente a esses requisitos resultou no desenvolvimento de embalagens ativas na indústria alimentícia (45). As embalagens ativas são capazes de controlar a atmosfera em que o alimento está inserido e controlar o crescimento de microrganismos, resultando no aumento da vida útil e a na segurança dos alimentos (40).
Neste cenário, é possível prospectar o potencial de aplicação industrial do OE por meio da sua capacidade de volatilização, como componente ativo de embalagens (46, 47), evitando-se assim interferências indesejáveis nas características sensoriais dos alimentos, já que não necessitam de uma aplicação direta do OE com os ingredientes (48).
CONCLUSÕES
Os resultados encontrados sugerem que o filme bicamada desenvolvido com óleo essencial de tomilho encapsulado é um material com potencial antibacteriano para aplicações em embalagens de alimentos, pois inibiu bactérias Gram-positivas e Gram-negativas. Nanoestruturas, como as nanofibras, ao serem utilizadas combinadas com as matrizes de biopolímeros, dão origem a estruturas mais complexas. Essa combinação de um sistema de encapsulação com revestimentos biodegradáveis permite que os revestimentos sejam utilizados como sistemas de transporte para a liberação controlada ou sustentada de substâncias ativas no alimento para promover sua conservação.
REFERÊNCIAS
- Ministério da Saúde. Doenças de Transmissão Hídrica e Alimentar (DTHA) [Internet]. Secretaria de Vigilância em Saúde; 2023 [acesso em 16 Jun de 2023]. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/d/dtha
- Ministério da Saúde. Surtos de Doenças de Transmissão Hídrica e Alimentar no Brasil Informe 2022 [Internet]. Secretaria de Vigilância em Saúde; 2023 [acesso em 16 Jun de 2023]. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/d/dtha/publicacoes/surtos-de-doencas-de-transmissao-hidrica-e-alimentar-no-brasil-informe-2022/view
- Tenaillon O, Skurnik D, Picard B, Denamur E. The population genetics of commensal Escherichia coli. Nat. Rev. Microbiol. 2010;8:207–217.
- Denamur E, Clermont O, Bonacorsi S, Gordon D. The population genetics of pathogenic Escherichia coli. Nat. Rev. Microbiol. 2021;19:37–54.
- Croxen MA, Finlay BB. Molecular mechanisms of Escherichia coli pathogenicity. Nat. Rev. Microbiol. 2010;8:26–38.
- Martinez MB, Trabulsi LR. Enterobacteriaceae. In: Trabulsi LR, Alterthum F, editores. Microbiologia. São Paulo: Atheneu; 2008;271-9.
- Chandran A, Mazumder A. Pathogenic potential, genetic diversity, and population structure of Escherichia coli strains isolated from a forest-dominated watershed (Comox Lake) in British Columbia, Canada. Appl. Environ. Microbiol. 2015;8:1788-1798.
- Nagy A, Mowery J, Bauchan GR, Wang L, Nichols-Russell L, Nou X. Role of extracellular structures of Escherichia coli O157:H7 in initial attachment to biotic and abiotic surfaces. Appl. Environ. Microbiol. 2015;81:4720-4727.
- Aijuka M, Buys EM. Persistence of foodborne diarrheagenic Escherichia coli in the agricultural and food production environment: Implications for food safety and public health. Food Microbiol. 2019;82:363-370.
- Bergdoll MS. Staphylococcus aureus. In: Foodborne bacterial pathogens. New York: Marcel Dekker. 1989;463-523.
- Loir YL, Baron F, Gautir M. Staphylococcus aureus and food poisoning. Genet. Mol. Res. 2003;2(1):63-76.
- Gustafson JE, Muthaiyan A, Dupre JM, Ricke SC. Staphylococcus aureus and understanding the factors that impact enterotoxin production in foods: A review. Food Control. 2015;1-14.
- Peles F, Wagner M, Varga L, Hein I, Rieck P, Gutser K, Keresztúri P, Kardos G, Turcsányi I, Béri B, Szabó A. Characterization of Staphylococcus aureus strains isolated from bovine milk in Hungary. Int. J. Food Microbiol. 2007;118(2):186-193.
- Chiang YC, Liao WW, Fan CM, Pai WY, Chiou CS, Tsen HY. PCR detection of Staphylococcal enterotoxins (SEs) N, O, P, Q, R, U, and survey of SE types in Staphylococcus aureus isolates from food-poisoning cases in Taiwan. Int. J. Food Microbiol. 2008;121:66-73.
- Castro A, Santos C, Meireles H, Silva J. Teixeira, P. Food handlers as potential sources of dissemination of virulent strains of Staphylococcus aureus in the community. J. Infect. Public Health. 2016;9:153–160.
- Liu H, Li S, Meng L, Dong L, Zhao S, Lan X, Wang J, Zheng N. Prevalence, antimicrobial susceptibility, and molecular characterization of Staphylococcus aureus isolated from dairy herds in northern China. J Dairy Sci. 2017;100(11):8796-8803.
- Dayan GH, Mohamed N, Scully IL, Cooper D, Begier E, Eiden J, Jansen KU, Gurtman A, Anderson AS. Staphylococcus aureus: the current state of disease, pathophysiology and strategies for prevention. Expert Rev Vaccines. 2016;15(11):1373-1392.
- WHO Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics [Internet]. Geneva: World Health Organization; 2017 [acesso em 20 Jun 2023]. Disponível em: https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed.
- Alves-Silva JM, Santos SMD, Pintado ME, Pérez-Álvarez JA, Fernández-López J, Viuda-Martos M. Chemical composition and in vitro antimicrobial, antifungal and antioxidant properties of essential oils obtained from some herbs widely used in Portugal. Food Control. 2013;32:371–378.
- Falleh H, Jemaa MB, Saada M, Ksouri R. Essential oils: A promising eco-friendly food preservative. Food Chemistry. 2020;330:127268.
- Unlu A, Sar T, Seker G, Erman AG, Kalpar E, Akbas MYI. Biofilm formation by Staphylococcus aureus strains and their control by selected phytochemicals. Int J Dairy Technol. 2018;70:1–10.
- Khorshidian N, Yousefi M, Khanniri E, Mortazavian AM. Potential application of essential oils as antimicrobial preservatives in cheese. Innov Food Sci Emerg Technol. 2018;45:62–72.
- FDA Food and Drug Administration. Code of Federal Regulations Title 21. Substances generally recognized as safe. [Internet] 2002 [acesso em 2 Jul 2023] Disponível em: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=182
- Escobar A, Pérez M, Romanelli G, Blustein G. Thymol bioactivity: A review focusing on practical applications. Arab. J. Chem. 2020;13:9243–9269.
- Burt S. Essential oils: Their antibacterial properties and potential applications in foods – A review. Int. J. Food Microbiol. 2004;94(3):223–253.
- Fajardo P, Martins JT, Fucińos C, Pas-Trana L, Teixeira JA, Vicente AA. Evaluation of a chitosan-based edible film as carrier of natamycin to improve the storability of Saloio cheese. J Food Eng. 2010;101:349-356.
- Nešić A, Cabrera-Barjas G, Dimitrijević-Branković S, Davidović S, Radovanović N, Delattre C. Prospect of Polysaccharide-Based Materials as Advanced Food Packaging. Molecules. 2019;25(1):135.
- Weligama Thuppahige VT, Karim M A. A comprehensive review on the properties and functionalities of biodegradable and semibiodegradable food packaging materials. Compr Rev Food Sci Food Saf. 2022;21:689-718.
- Fonseca LM, Radünz M, Hackbart HCD, Silva FT, Camargo TM, Bruni GP, Monks JLF, Zavareze ER, Dias ARG. Electrospun potato starch nanofibers for thyme essential oil encapsulation: antioxidante activity and thermal resistance. J. Sci. Food Agric. 2020;100:4263-4271.
- Böhmer-Maas BW, Fonseca LM, Otero DM, Zavareze ER, Zambiazi RC. Photocatalytic zein-TiO2 nanofibers as ethylene absorbers for storage of cherry tomatoes. Food Packag. Shelf Life. 2020;24.
- Ghabraie M, Vu KD, Tata L, Salmieri S, Lacroix M. Antimicrobial effect of essential oils in combinations against five bacteria and their effect on sensorial quality of ground meat, LWT – Food Sci. Technol. 2016;66:332-339.
- Sato K, Krist S, Buchbauer G. Antimicrobial effect of vapours of geraniol,(R)‐(–)‐linalool, terpineol, γ‐terpinene and 1, 8‐cineole on airborne microbes using an airwasher. Flavour Fragr. J. 2007;22(5):435-437.
- Patel AR, Velikov KP. Zein as a source of functional colloidal nano- and microstructures. Curr Opin Colloid Interface. 2014;19:450-458.
- Rehman A, Jafari SM, Aadil RM, Assad pour E, Randhawa MA, Mahmood S. Development of active food packaging via incorporation of biopolymeric nanocarriers containing essential oils. Trends Food Sci. 2020;101:106–121 .
- Goñi P, López P, Sánchez C, Gómez-Lus R, Becerril R, Nerín C. Antimicrobial activity in the vapour phase of a combination of cinnamon and clove essential oils. Food Chem. 2009;116(4):982–989.
- Dannenberg GS, Funck GD, Cruxen CES, Marques JL, Silva WP, Fiorentini AM. Essential oil from pink pepper as an antimicrobial component in cellulose acetate film: potential for application as active packaging for sliced cheese. LWT – Food Sci. Technol. 2017;81:314–318.
- Clemente I, Aznar M, Silva F, Nerín C. Antimicrobial properties and mode of action of mustard and cinnamon essential oils and their combination against foodborne bacteria. Innov Food Sci Emerg Technol. 2016;36:26-33.
- Chen G, Liu B. Cellulose sulfate based film with slow-release antimicrobial properties prepared by incorporation of mustard essential oil and β- cyclodextrin. Food Hydrocoll. 2016;55:100-107.
- Ansarifar E, Moradinezhad F. Preservation of Strawberry Fruit Quality via the Use of Active Packaging with Encapsulated Thyme Essential Oil in Zein Nanofiber Film. Int. J. Food Sci. Technol. 2021;56(9):4239-247.
- Bahrami A, Delshadi R, Assadpour E, Jafari SM, Williams L. Antimicrobial-loaded nanocarriers for food packaging applications. Adv Colloid Interface Sci. 2020;278:102140.
- Robertson GL. Food packaging: principles and practice. CRC press; 2005.
- Limbo S, Khaneghah AM. Active packaging of foods and its combination with electron beam processing. Electron Beam Pasteurization and Complementary Food Processing Technologies. Elsevier. 2015;195–217.
- Tas BA, Sehit E, Tas CE, Unal S, Cebeci FC, Menceloglu YZ, et al. Carvacrol loaded halloysite coatings for antimicrobial food packaging applications. Food Packag Shelf Life 2019;20:100300.
- Khaneghah AM, Hashemi SMB, Limbo S. Antimicrobial agents and packaging systems in antimicrobial active food packaging: an overview of approaches and interactions. Food Bioprod Process 2018;111:1–19.
- Duncan TV. Applications of nanotechnology in food packaging and food safety: barrier materials, antimicrobials and sensors. J Colloid Interface Sci. 2011;363:1–24.
- Donsì F, Annunziata M, Sessa M, Ferrari G. Nanoencapsulation of essential oils to enhance their antimicrobial activity in foods. LWT – Food Sci. Technol. 2011;44:1908–14.
- Pabast M, Shariatifar N, Beikzadeh S, Jahed G. Effects of chitosan coatings incorporating with free or nanoencapsulated Satureja plant essential oil on quality characteristics of lamb meat. Food Control. 2018;91:185–92.
- Dannenberg GS, Funck GD, Mattei FJ, Silva WP, Fiorentini AM. Antimicrobial and antioxidant activity of essential oil from pink pepper tree (Schinus terebinthifolius Raddi) in vitro and in cheese experimentally contaminated with Listeria monocytogenes. Innov. Food Sci. Emerg. Technol. 2016;36:120–127.


