
ESTABILIDADE DE TOCOFERÓIS E FITOSTERÓIS EM MANTEIGAS DE ORIGEM VEGETAL SOB ESTOCAGEM EM ESTUFA
Capítulo de livro publicado no livro Ciência e tecnologia de alimentos: Pesquisas e avançosPara acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062060-02
Este trabalho foi escrito por:
Marcelo Vieira de Oliveira1 ; Carolina Médici Veronezi2* ; Neuza Jorge3
1Docente/pesquisador do Instituto Federal de Educação, Ciência e Tecnologia do Maranhão – IFMA; E-mail: [email protected]
2Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; E-mail: [email protected]
3Docente/pesquisadora do Departamento de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; E-mail: [email protected]
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Existem diversas espécies frutíferas na região Amazônica consideradas fontes potenciais para produção de óleos e manteigas. Esses frutos têm sido bastante explorados por conterem mais de 60% de micronutrientes bioativos. Neste contexto, o presente trabalho objetivou avaliar a estabilidade dos tocoferóis e fitosteróis de manteigas comerciais obtidas a partir do bacuri (Platonia insignis Mart.), cacau (Theobroma cacao L.), cupuaçu (Theobroma grandiflorum L.), murumuru (Astrocaryum murumuru Mart.), tucumã (Astrocaryum tucumã Mart.) e ucuuba (Virola sebifera Aubl.), sob teste acelerado em estufa (60ºC/20 dias). As manteigas foram estocadas a 60°C em estufa com circulação de ar, retiradas após 0, 10 e 20 dias e analisadas quanto aos teores de tocoferóis e fitosteróis por cromatografia líquida e gasosa, respectivamente. Somente as manteigas de bacuri e ucuuba apresentaram tocoferóis totais ao longo da estocagem, com destaque para a manteiga de ucuuba, que mostrou maior quantidade de α-tocoferol (791,4-320,6 mg/kg). Em relação aos fitosteróis totais, a manteiga de cupuaçu se sobressaiu com maiores teores durante o tempo de estocagem (125,4-89,9 mg/kg). Porém, em 20 dias, a retenção foi de apenas 71,7%, enquanto que as manteigas de bacuri, murumuru, tucumã e ucuuba apresentaram retenções de fitosteróis totais acima de 80%. As manteigas podem ser utilizadas como matéria-prima nas indústrias alimentícias, cosmética e farmacêutica, porém, as de bacuri e ucuuba obtiveram maiores quantidades de fitoquímicos bioativos e foram mais estáveis perante a estocagem acelerada em estufa a 60°C.
Palavras-chave: fitoquímicos bioativos; frutos amazônicos; teste acelerado
INTRODUÇÃO
O bioma Amazônia é um dos mais importantes do mundo, graças a sua valiosa biodiversidade e importância ambiental. Essa região possui, em média, 44% das espécies vegetais nativas (1). A maioria dos frutos nativos da região amazônica é utilizada para consumo nos mercados locais, sendo pouco explorados, embora seja considerada uma fonte potencial de óleos e manteigas vegetais, por apresentarem elevado conteúdo lipídico. Estima-se que 60 a 80% dos componentes presentes nas frações insaponificáveis dos óleos e manteigas de frutos provenientes de palmeiras amazônicas são compostos bioativos como fenólicos, fitosteróis, tocoferóis, dentre outros (2).
Entre as oleaginosas amazônicas, destacam-se bacuri, cacau, cupuaçu, murumuru, tucumã e ucuuba, pois possuem participação ativa e importância no ciclo econômico dos estados da Amazônia Legal, por apresentarem composições lipídicas singulares que remetem às diversas aplicações nas indústrias farmacêutica, cosmética, bioenergética e alimentar (3). Estudos sugerem que, devido ao conteúdo de fitoquímicos bioativos, essas oleaginosas apresentam efeitos antioxidante, antimicrobiano, anticancerígeno, hipocolesterolêmico, anti-inflamatório, cito e neuroprotetor, etc. (4-7).
Entre os produtos originários das oleaginosas amazônicas, destacam-se as manteigas vegetais, que são os principais veículos de vitaminas lipossolúveis (A, D, E, K) e possuem emoliência natural derivada dos ácidos graxos. A manteiga de bacuri é rica em ácidos oleico e palmítico, sendo este na forma de tripalmitina; a de cacau é composta de aproximadamente 36% de ácido palmítico; a de cupuaçu apresenta elevada concentração de ácido oleico; as de murumuru e tucumã são compostas por elevada quantidade de ácido láurico, 62 e 51%, respectivamente; e a de ucuuba tem grande quantidade de ácido mirístico (71%) (8-11).
Além dos ácidos graxos, essas manteigas possuem compostos bioativos, como os tocoferóis e fitosteróis. Os tocoferóis são substâncias que têm poder antioxidante 250 vezes maior que o antioxidante sintético butil hidroxitolueno (BHT), agindo a níveis inferiores a 2.000 mg/kg, porém, em elevadas concentrações e na presença de traços de ferro e de sais de cobre podem agir como pró-oxidantes (12). Além disso, os tocoferóis aumentam a estabilidade oxidativa de óleos vegetais e reduzem a peroxidação de ácidos graxos poli-insaturados (13). Os fitosteróis são os principais constituintes da matéria insaponificável e exercem uma grande influência nutricional embora não contribuam com propriedades químicas ou físicas importantes (14).
Os produtos lipídicos são susceptíveis a processos de degradação e, como consequência, sua aplicação é limitada. A degradação dos óleos pode ser hidrolítica, catalisada por enzimas ou pela presença de umidade, ou oxidativa (15). Além da qualidade sensorial, as qualidades nutricionais e funcionais são afetadas durante a autoxidação, pela formação de substâncias tóxicas e, principalmente, pela perda de ácidos graxos essenciais, carotenoides, tocoferóis e fitosteróis (16). Nesse contexto, o presente estudo objetivou avaliar a estabilidade dos tocoferóis e fitosteróis de manteigas comerciais obtidas de bacuri (Platonia insignis Mart.), cacau (Theobroma cacao L.), cupuaçu (Theobroma grandiflorum L.), murumuru (Astrocaryum murumuru Mart.), tucumã (Astrocaryum tucumã Mart.) e ucuuba (Virola sebifera Aubl.), sob teste acelerado em estufa (60ºC/20 dias).
MATERIAL E MÉTODOS
Manteiga
As manteigas vegetais provenientes do bacuri (Platonia insignis Mart.), cupuaçu (Theobroma grandiflorum L.) e murumuru (Astrocaryum murumuru Mart.) foram obtidas de uma empresa situada em Belém-PA (latitude 01º21’56″S e longitude 48º22’20″W). As manteigas de cacau (Theobroma cacao L.), tucumã (Astrocaryum tucumã Mart.) e ucuuba (Virola sebifera Aubl.) foram adquiridas de uma empresa fornecedora localizada em Catanduva-SP. Os lotes de cada manteiga, pesando entre 800-1.000 g, foram homogeneizados em recipiente de plástico, inertizados com nitrogênio gasoso e armazenados a -18ºC até o momento das análises.
Estocagem em estufa
O teste acelerado em estufa a 60°C foi realizado empregando 30 mL de cada manteiga em béqueres com superfície/volume de 0,4/cm. As amostras, nos intervalos de tempo 0, 10 e 20 dias, foram recolhidas, inertizadas e armazenadas à temperatura de -18°C até o momento das análises.
Teores de tocoferóis
Os teores de tocoferóis foram determinados utilizando o método da Ce 8-89 da AOCS (2009) (17) em cromatógrafo líquido de alta eficiência (Modelo 210-263 Varian Inc., Walnut Creek, EUA), com detector de fluorescência, coluna de aço inox empacotada com sílica (100 Si, Microsorb, Varian Inc., Walnut Creek, EUA) de 250 x 4,6 mm com poro de 0,5 μm e comprimentos de onda de excitação e emissão de 290 e 330 nm, respectivamente. A quantificação de cada isômero foi realizada por padronização externa com base nas áreas dos picos, utilizando padrões de α-, β-, γ- e δ-tocoferol (marca Supelco) com graus de pureza de 99,9, 98,0, 99,4 e 99,6%, respectivamente. Os teores de tocoferóis foram expressos em mg/kg.
Teores de fitosteróis
A composição de fitosteróis foi conduzida por cromatografia gasosa da matéria insaponificável. A saponificação foi realizada conforme a metodologia de Duchateau et al. (2002) (18). Para a determinação dos teores de fitosteróis foi utilizado um cromatógrafo a gás (Modelo Plus-2010, Shimadzu, Chiyoda-ku, Tóquio, Japão), com detector de ionização de chama, injetor split e coluna capilar de sílica fundida (Restek RTX 5, Shimadzu, Chiyoda-ku, Tóquio, Japão) de 30 m de comprimento, com diâmetro interno de 0,25 mm e espessura do filme de 0,25 μm. A temperatura do forno foi iniciada a 100°C por 2 min, aquecida a 15°C/min até 260°C e mantida isotérmica por 35 min. As temperaturas que foram utilizadas no injetor e no detector foram 280 e 320°C, respectivamente. O hidrogênio foi usado como gás de arraste com velocidade linear de 40 mL/ min. Os fitosteróis foram identificados de acordo com seus tempos de retenção, comparando-os com padrões de pureza de 95-98% (Supelco, Bellefonte, EUA) analisados nas mesmas condições que as amostras. A quantificação de cada isômero foi realizada por padronização interna (5α-cholestano-3β-ol), com base nas áreas dos picos, e expressa em mg/kg.
Análise estatística
O experimento foi realizado em delineamento inteiramente casualisado em esquema fatorial. Os resultados obtidos nas determinações analíticas foram submetidos à análise de variância e as diferenças entre as médias foram testadas a 5% de probabilidade pelo teste de Tukey, utilizando o programa ESTAT, versão 2.0 (19).
RESULTADOS E DISCUSSÃO
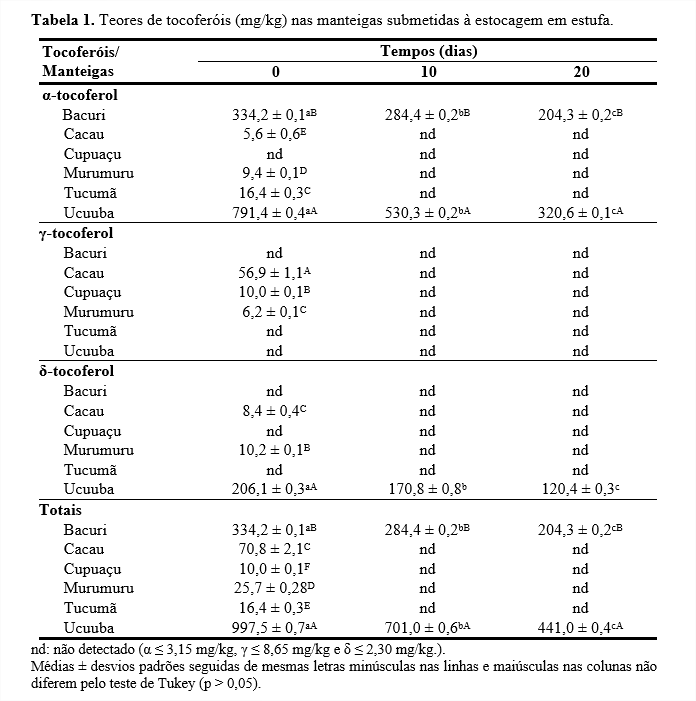
Os tocoferóis fazem parte da fração insaponificável de produtos lipídicos. Podem ser potencialmente utilizados para identificar e caracterizar os produtos, visto que são compostos bioativos presentes em diferentes concentrações dependendo da espécie vegetal, das condições climáticas, estádio de maturação do vegetal, presença de ácidos graxos insaturados, etc. (20). Além disso, sua presença é importante por conferir valor nutricional e estabilidade oxidativa, em especial para evitar a oxidação de ácidos graxos insaturados (21-22). Os isômeros α-, γ- e δ-tocoferol foram identificados nas manteigas submetidas às condições de estocagem em estufa (Tabela 1).
Inicialmente, a manteiga de ucuuba apresentou maior quantidade de α-tocoferol (791,4 mg/kg). Por outro lado, na manteiga de cupuaçu não foi detectado esse isômero ao longo do tempo de estocagem. Com 10 e 20 dias de estocagem, somente as manteigas de bacuri e ucuuba apresentaram α-tocoferol, destacando-se a de bacuri com retenção aproximada de 61% de α-tocoferol em 20 dias de estocagem.
No início da estocagem, o γ-tocoferol foi detectado somente nas manteigas de cacau, cupuaçu e murumuru, sendo que a de murumuru mostrou menor quantidade, 6,2 mg/kg. Essa escassa presença de γ-tocoferol pode estar relacionada com a elevada quantidade de ácidos graxos saturados nas manteigas (23). Jorge, Oliveira e Luzia (2021) (8) analisando a manteiga de murumuru encontraram 84,09% de ácidos graxos saturados. Com 10 e 20 dias de estocagem não foi detectado o isômero γ-tocoferol em nenhuma das manteigas estudadas.
Apenas as manteigas de cacau, murumuru e ucuuba apresentaram o isômero δ-tocoferol. Porém, nas manteigas de cacau e murumuru não foi detectado o δ-tocoferol em 10 e 20 dias de estocagem. Dentre as manteigas citadas, a de ucuuba se sobressaiu com maior valor no início da estocagem (206,1 mg/kg). Ao longo da estocagem houve redução da quantidade deste isômero, apresentando significativa retenção de 58% em 20 dias.
Dentre as manteigas estudadas, inicialmente, a de ucuuba se destacou com maior teor de tocoferóis totais, ou seja, 997,5 mg/kg, devido a sua elevada quantidade de α-tocoferol. Contudo, com o decorrer da estocagem, só as manteigas de bacuri e ucuuba mostraram quantidades relevantes de tocoferóis totais, sobressaindo, aos 20 dias, a ucuuba (441,0 mg/kg), com retenção de 44% e de bacuri (204,3 mg/kg), com retenção de 61%.
Os fitosteróis são constituintes que estão presentes em menor quantidade na fração insaponificável da matéria vegetal. No organismo, os fitosteróis, dos quais os mais comuns são campesterol, estigmasterol e β-sitosterol, atuam na diminuição da absorção de colesterol no intestino delgado por um mecanismo de competição. Esta competição ocorre porque a estrutura química dos fitosteróis é semelhante à do colesterol, diferindo no tamanho da cadeia (24). Conforme Tabela 2, foi detectada a presença de quatro fitosteróis, sendo encontrados o estigmasterol e o Δ7-avenasterol em todas as manteigas.
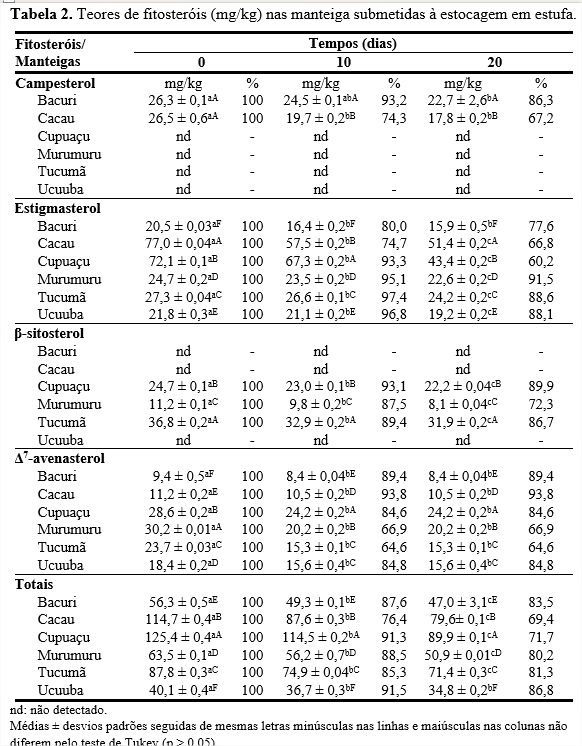
O campesterol foi detectado apenas nas manteigas de bacuri e cacau, sendo que, inicialmente, não apresentaram diferenças significativas (p > 0,05). Estudos comprovam que os fitosteróis são susceptíveis à autoxidação, que pode ocorrer no organismo humano, e também nos alimentos por meio do processamento e armazenamento. Sabe-se que a tendência de degradação ocorre na sequência campesterol > β-sitosterol > estigmasterol (25-26). Assim, com o tempo de estocagem houve uma redução de campesterol em ambas as amostras, porém em 10 e 20 dias, a manteiga de bacuri se destacou com maiores retenções, 93,2 e 86,3%, respectivamente.
O estigmasterol foi detectado em todas as manteigas estudadas, contudo, inicialmente e com 20 dias de estocagem, a de cacau apresentou maiores quantidades, 77 e 51,4 mg/kg, respectivamente. Em contrapartida, a manteiga de murumuru, com o decorrer da estocagem mostrou ser mais estável, com retenção de 91,5% de estigmasterol, em 20 dias. Embora o β-sitosterol, seja, normalmente, encontrado em elevada quantidade em diversos tipos de óleos vegetais, nas manteigas de bacuri, cacau e ucuuba esse fitosterol não foi detectado. Além disso, inicialmente, foi constatada maior quantidade na manteiga de tucumã (36,8 mg/kg), porém, com o decorrer da estocagem, a manteiga de cupuaçu mostrou ser mais estável, visto que em 20 dias apresentou retenção de 89,9% de β-sitosterol.
Todas as manteigas apresentaram Δ7-avenasterol, sobressaindo a de murumuru com 30,2 mg/kg no início da estocagem. Em contrapartida, a manteiga de cacau que, inicialmente, mostrou baixa quantidade de Δ7-avenasterol, 11,2 mg/kg, foi a que durante a estocagem se manteve mais estável, com 93,8% de retenção deste fitosterol, em 10 e 20 dias. A manteiga de cupuaçu apresentou maiores quantidades de fitosteróis totais ao longo do tempo de estocagem (125,4-89,9 mg/kg), atribuídas pela presença de estigmasterol, β-sitosterol e Δ7-avenasterol. Porém, a perda durante o processo de estocagem foi maior na manteiga de cupuaçu do que nas de bacuri, murumuru, tucumã e ucuuba.
CONCLUSÕES
A utilização das manteigas estudadas são alternativas viáveis para conservação de espécies vegetais nativas da região amazônica, porém, as de bacuri e ucuuba apresentam maiores quantidades de fitoquímicos bioativos, como tocoferóis e fitosteróis, além de serem mais estáveis perante a estocagem acelerada em estufa a 60°C. Ainda é necessário aprofundar mais sobre o conhecimento acerca das atividades biológicas e ensaios de toxicidade dessas manteigas voltadas à aplicação dentro das áreas farmacêutica, cosmética, alimentícia, bioenergética, entre outras,
AGRADECIMENTOS
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pelo auxílio financeiro e bolsa de doutorado; à Universidade Estadual Paulista “Júlio de Mesquita Filho” (UNESP); ao Instituto Federal de Educação, Ciência e Tecnologia do Maranhão (IFMA) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa de produtividade em pesquisa.
REFERÊNCIAS
2. Rufino MDSM, Alves RE, Brito ES, Perez-Jimenez J, Saura-Calixto F, Mancini-Filho, J. Bioactive compounds and antioxidant capacities of 18 nontraditional tropical fruits from Brazil. Food Chem. 2010; 121:996-1002.
3. Ramos YJ, Dourado D, Oliveira-Souza L, Carvalho LS, Oliveira GC, Costa-Oliveira C, et al. Manteigas da Amazônia e os seus frutos: conhecimento popular, composição química, propriedades físico-químicas e aplicação farmacêutica. In: Faria AM. Princípios físico-químicos em farmácia. Ponta Grossa: Atena; 2019. p. 95-110.
4. Araújo NMP, Arruda HS, Marques DRP, Oliveira WQ, Pereira GA, Pastore GA. Functional and nutritional properties of selected Amazon fruits: a review. Food Res Int. 2021; 147:1-19.
5. Tauchen J, Bortl L, Huml L, Miksatkova P, Doskocil I, Marsik P, et al. Phenolic composition, antioxidant and anti-proliferative activities of edible and medicinal plants from the Peruvian Amazon. Rev Bras Farmacogn. 2016; 26:728-37.
6. Nascimento RP, Reguengo LM, Machado APF, Marostica Junior MR. The preventive and therapeutic potential of native Brazilian fruits on colorectal cancer. Food Biosc. 2022; 46:1-18.
7. Avila-Sosa R, Montero-Rodriguez AF, Aguilar-Alonso P, Vera-López O, Lazcano-Hernandez M, Morales-Medina JC, et al. Antioxidant properties of amazonian fruits: a mini review of in vivo and in vitro studies. Oxid Med Cell Longev. 2019; 1:1-12.
8. Jorge N, Oliveira MV, Luzia DMM. Caracterização físico-química de manteigas de frutos amazônicos. ForScience. 2021; 9:1-15.
9. Silva JPP, Oliveira PD, Rodrigues AMC, Silva LHM. Caracterização física e química de lipídios estruturados obtidos a partir da interesterificação química da mistura de Murumuru e óleo de buriti. In: Anais do XX Congresso Brasileiro de Engenharia Química [Internet]; 2014. Out 19-22; Florianópolis, SC. São Paulo: Associação Brasileira de Engenharia Química; 2014. Disponível em: http://pdf.blucher.com.br.s3-sa-east1.amazonaws.com/chemicalengineering
Proceedings /cobeq2014/0318-26027-155237.pdf
10. Pardauil JJR, Molfetta FA, Braga M, De Souza LKC, Filho GNR, Zamian JR, et al. Characterization, thermal properties and phase transition of amazonian vegetable oils. J Therm Anal Calorim. 2017; 127:1221-29.
11. Machado APF, Nascimento RP, Alves MR, Reguengo LM, Marostica Junior MR. Brazilian tucumã-do-Amazonas (Astrocaryum aculeatum) and tucumã-do-Pará (Astrocaryum vulgare) fruits: bioactive composition, health benefits, and technological potential. Food Res Int. 2022; 151:1-19.
12. Jung MY, Min DB. Effects of α-, γ- and δ-tocopherols on oxidative stability of soybean oil. J Food Sci. 1990; 55:1464-65.
13. Clarkson PM, Thompson HS. Antioxidants: what role do they play in physical activity and health? Am J Clinical Nut. 2000;72:637-46.
14. Marangoni F, Poli A. Phytosterols and cardiovascular health. Pharm Res. 2010; 61:193-99.
15. Hernandez EM, Kamal‐Eldin A. Processing and nutrition of fats and oils. John Wiley & Sons; 2013.
16. McClements DJ, Decker, EA. Lipídeos. In: Damodaran S, Parkin KL, organizadores. Quimica de Alimentos. Porto Alegre: Artmed; 2019. p. 175-238.
17. American Oil Chemists’ Society. Official methods and recommended practices of the American Oil Chemists’ Society. AOCS; 2009.
18. Duchateau GSMJE, Bauer-Plank CG, Louter AJH, Van Der Ham M, Boerma JA, Van Rooijen JJM, et al. Fast and accurate method for total 4-desmethy sterol(s) content in spreads, fat-blends an raw material. J Am Oil Chem Soc. 2002; 79:273-78.
19. Banzatto DA, Kronka SN. Experimentação agrícola. 4. ed. Funep; 2006.
20. Shen MY, Zhao SS, Zhang F, Huang MQ, Xie JH. Characterization and authentication of olive, camellia and other vegetable oils by combination of chromatographic and chemometric techniques: role of fatty acids, tocopherols, sterols and squalene. Eur Food Res Technol. 2020; 247:411-26.
21. Faria-Machado AF, Antoniassi R, Guedes AMM, Wihelm AE. Método de análise de tocoferóis em azeite de oliva por cromatografia líquida de alta eficiência em fase reversa. Embrapa; 2018.
22. Wu L, Zhao J, Wu L, Zhang Y, Li J. Simultaneous determination of squalene, tocopherols and phytosterols in edible vegetable oil by SPE combined with saponification and GC-MS. LWT-Food Sci Technol. 2022; 169:1-10.
23. Masson L, Camilo C, Torija ME. Caracterización del aceite de coquito de palma chilena (Jubaea chilensis). Grasas y Aceites. 2008; 59:33-8.
24. Rodrigues JN, Mancini Filho J, Torres RP, Gioielli LA. Caracterização físico-química de creme vegetal enriquecido com ésteres de fitoesteróis. Rev. Bras Cienc Farm. 2004; 40:505-20.
25. Scholz B, Guth S, Engel KH, Steinberg P. Phytosterol oxidation products in enriched foods: occurrence, exposure, and biological effects. Mol Nutr Food Res. 2015; 59, 1339-52. 26. Leal-Castañeda EJ, Inchingolo R, Cardenia V, Hernandez-Becerra JA, Romani S, Rodríguez-Estrada MT, et al. Effect of microwave heating on phytosterol oxidation. J Agric Food Chem. 2015; 63:5539-47.


