
ELABORAÇÃO E CARACTERIZAÇÃO FÍSICO-QUÍMICA E MICROBIOLÓGICA DA BEBIDA FERMENTADA VEGETAL DO EXTRATO DE COCO (COCUS NUCIFERAS L.).
Capítulo de livro publicado no livro do VIII ENAG E CITAG. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/786585062046-14
Este trabalho foi escrito por:
Alisson da Silva Gomes *, Francisco Sandro Vidal da Silva , Paulo Felipe Câmara de Macedo , Allyne Mayara de Medeiros Bezerra ,Thiago Leite de Souza , Beatriz de Cassia Salomão
*Autor correspondente (Corresponding author) – Email:[email protected]
Resumo: Segundo a RDC N.º 83 de 15 setembro 2000 da ANVISA, o leite de coco é definido como uma emulsão aquosa obtida do endosperma. No mercado existem vários derivados primários do coco, e poucos produtos que o empregam como base. Diante disso, esta pesquisa teve por objetivo o desenvolvimento de uma bebida fermentada à base de extrato de coco. As análises microbiológicas realizadas foram a quantificação de coliformes totais e termotolerantes, bactérias aeróbias mesófilas, Staphylococcus aureus e bolores e leveduras. Ademias, para as análises físico-químicas mediu-se a acidez titulável, pH, atividade de água, e umidade. Para a acidez titulável, obteve-se um valor de 0,57 ± 0,009 g de ácido lático /100g de amostra, o pH encontrado de foi de 3,54. Já para a atividade de água os valores obtidos foram de 0,989 ± 0,003 e umidade uma porcentagem de 85,11% ± 0,71 (m/m). Os resultados das análises microbiológicas obtiveram para os coliformes totais e termotolerantes <3 NMP/ml, para S. aureus 3,0×109 UFC/mL, para as bactérias mesófilas 1,8×105 UFC/mL e bolores e leveduras de 3,0×105 UFC/mL. Portanto, a elaboração da bebida fermentada do extrato de coco, demonstra-se viável, e novos estudos serão realizados para aprimoramento da formulação do produto final.
Palavras-chaves: bebida fermentada; coco; produtos vegetais
Abstract: According to ANVISA’s RDC No. 83 of September 15, 2000, coconut milk is defined as an aqueous emulsion obtained from the endosperm. There are several primary coconut derivatives on the market, and few products that use it as a base. Therefore, this research aimed to develop a fermented beverage based on coconut extract. The microbiological analyzes performed were the quantification of total and thermotolerant coliforms, mesophilic aerobic bacteria, Staphylococcus aureus and molds and yeasts. Ademics, for the physicochemical analysis, titratable acidity, pH, water activity, and humidity were measured. For the titratable acidity, a value of 0.57 ± 0.009g of lactic acid /100g of sample was obtained, the pH found was 3.54. As for the water activity, the values obtained were 0.989 ± 0.003 and humidity a percentage of 85.11% ± 0.71 (m/m). The results of the microbiological analyzes obtained for the total and thermotolerant coliforms < 3 NMP/mL, for the S. aureus 3,0×109 UFC/mL, for mesophilic bacteria 1,8×105 UFC/mL and molds and yeasts of 3,0×105 UFC/mL. Therefore, the elaboration of the fermented drink of coconut extract is viable, and new studies will be carried out to improve the formulation of the final product.
Keywords:, coconut; fermented beverage; vegetable products
INTRODUÇÃO
A alimentação brasileira e mundial encontra-se em crescentes modificações que tendem a ser importantes para o organismo e para as relações psicossociais, às quais estão atreladas a alguma restrição, alergia ou intolerância a certo tipo de alimento, seja de origem vegetal ou animal1. Um dos principais exemplos dessas restrições é ao leite e seus derivados, que é responsável pelo fornecimento de grande parcela de nutrientes para o organismo, estimando-se que cerca de 40 milhões de brasileiros são intolerantes a lactose 3.
Além da parcela da população que possui restrições alimentares, surge também o progressivo aumento da preocupação com uma boa alimentação e da substituição de alimentos de origem animal por de origem vegetal, ou seja, o vegetarianismo e veganismo. Dessa forma, a procura por alimentos processados mais saudáveis de origem vegetal, os chamados “plant based” também aumentaram4. Assim, o zelo com a saúde e a demanda de mercado vem mudando as perspectivas da indústria, forçando empresas a reduzir cada vez mais o uso de substâncias sintéticas e de origem animal, e passam a utilizar insumos vegetais5,6.
Um dos principais alimentos utilizados em dietas atualmente, como fonte de gorduras saturadas, fibras, açucares e substituto do leite é o coco. O coco (Cocus nucifera L.) possui muitos benefícios para a saúde humana, podendo-se citar: ação anti-inflamatória, antimicrobiana e previne doenças cardiovasculares, como também outras doenças. Ademais, existe uma diversidade de produtos derivados do endosperma do coco, tais como, o óleo de coco, coco ralado, o extrato do coco, comumente chamado de “leite de coco” 5. Segundo a RDC N.º 83 de 15 de setembro de 20007 da ANVISA, o leite de coco é definido como uma emulsão aquosa obtida do endosperma do coco. Ele é uma emulsão, como o leite de vaca, óleo-água, obtida pela trituração do endosperma (copra), sendo este um dos principais derivados produzidos no país8.
Além de tantos derivados primários do coco, existem poucos produtos que o empregam como base. Entretanto, existem pesquisas de desenvolvimento de produtos à base de coco, tanto com a utilização do seu extrato quanto de sua água. A exemplo disso a bebida vegetal a base de quinoa e leite de coco desenvolvido por Solorzano (2011)1, sobremesa gelada cremosa de leite de coco produzida por Sanches (2018)6; bebida probiótica de leite de coco desenvolvida por Messa et.al (2019)5.
Apesar de existirem opções para a demanda de mercado para os intolerantes a lactose, os chamados “leites vegetais”, existem alguns que possuem outros tipos de alergênicos, a exemplo disso as proteínas isoladas da soja, as quais chegam no total de 15 espécies que podem causar algum tipo de alergia alimentar9. Assim, a indústria cada vez mais busca novos produtos que substituam os derivados do leite, sendo um desses produtos o “iogurte vegetal”.
A Instrução Normativa Nº 46 de 23 de outubro de 200710 do Ministério da Agricultura, Pecuária e Abastecimento (MAPA) define iogurte como sendo a fermentação do leite por cultivos de Streptococcus salivarius subsp. thermophilus e Lactobacillus delbrueckii subsp. Bulgaricus, produzindo ácido lático, e um coágulo firme, obtendo características sensoriais próprias do produto. Na elaboração de bebidas fermentadas pode-se utilizar espessantes para que haja uma maior coesão da fase liquida com os componentes adicionados na formulação, exemplo disso é a utilização de gomas, como a xantana ou a guar10.
Diante desse uso de amidos modificados (gomas), pode-se fazer sua substituição por produtos naturais como o ágar e mucilagem da chia ou de outra variedade. A chia (Salvia hispanica L), possui um alto poder nutricional devido ao seu valor de ácido linolênico ser elevado, grande quantidade de fibras, proteínas, minerais, e a presença de polifenóis11. Ela vem sendo integralmente utilizada na indústria de alimentos, pois se faz a extração das fibras (mucilagem), do óleo e da farinha, nada se perde. Essa fibra alimentar é obtida assim que a semente entra em contato com a água, sendo um ótimo agente espessante e emulsificante, com capacidade de absorção de água12.
Diante da busca por inovações de produtos vegetais, esta pesquisa teve por objetivo o desenvolvimento de uma bebida fermentada à base de extrato de coco que melhor se enquadre para o público vegano, intolerantes a lactose, e a qualquer outro que se procure um melhor desempenho da microbiota intestinal a partir de bebidas fermentadas, a fim de atender as demandas do mercado em relação ao consumo de bebidas lácteas sem a adição do leite, com condições análogas ao iogurte natural.
MATERIAIS E MÉTODOS
A elaboração da bebida fermentada do extrato de coco foi realizada no laboratório de controle de qualidade de alimentos no complexo Laboratorial de Engenharia de Alimentos (LEA) da Universidade Federal do Rio Grande do Norte (UFRN), compus Natal. E para sua formulação foram utilizadas as matérias primas: coco ralado integral congelado adquirido no mercado local, semente de chia integral (Aster®), fermento lácteo (Vilaac Foods®), ácido cítrico (Vilaac Foods®) e sacarose.
- Mucilagem da chia
A extração da mucilagem de chia foi realizada pelo método descrito por Ruaro (2015)13, para o qual foi pesado, em balança semi-analítica, um total de 20g de semente de chia e adicionando 800 mL de água destilada, tendo a proporção de 1:40 (chia:água). Essa mistura foi mantida sob agitação e aquecimento à uma temperatura de 80ºC por 2 horas. Após o término do tempo, realizou-se a separação da mucilagem do grão da chia em centrifuga por 10 min a 20ºC em 5600 rpm.
- Extrato de coco
O extrato de coco ou comumente chamado de “Leite de coco”, foi elaborado a partir do endosperma ralado do coco integral congelado. Para sua obtenção foi utilizado 250g de coco ralado integral e adicionado a 500 mL de água destilada em temperatura de 40ºC, perfazendo assim uma proporção de 1:2 (coco:água). Após adicionada a água foi batido por 10 minutos em liquidificador industrial para maior extração e peneirado em peneira de inox simples.
- Bebida fermentada do extrato do coco
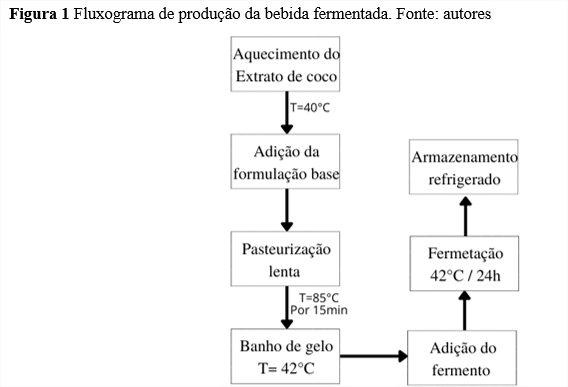
Para a elaboração da bebida fermentada foi aquecido o extrato até 45ºC e adicionado aos poucos a formulação base que consta na Tabela 1, sendo em seguida levado à pasteurização em temperatura constante de 85ºC por 15 minutos no banho-maria QUIMIS®.

Antes do preparo da formulação da bebida fermentada fez-se o starter da cultura láctea. Para isso preparou-se a proporção de acordo com recomendações do fabricante e pesou-se 0,6g para e incubado a 42,5ºC por 2 horas. Após realizar a pasteurização da formulação, levou-a para um banho de gelo até atingir a temperatura de 42ºC e adicionou-se a culturalevou-a para um banho de gelo até atingir a temperatura de 42ºC e adicionou-se a cultura starter, fazendo a homogeneização e deixou fermentar por 24 horas em Incubadora LimaTec® assim, como descrito no fluxograma da Figura 1.
- Análises microbiológicas
As análises foram realizadas no laboratório de controle de qualidade do complexo laboratorial de engenharia de alimentos (LEA). Para tanto utilizaram-se as metodologias da American Public Health Association (APHA) descritas por Silva et. al (2010)14 adaptadas para determinação e quantificação de coliformes totais e termotolerantes, bactérias aeróbias mesófilas, Staphylococcus aureus e bolores e leveduras.
- Análises Físico-químicas
As análises físico-químicas foram realizadas de acordo com a metodologia de Lutz (2008)15 e Castanheira (2012)16. As principais quantificações foram acidez titulável em ácido lático, pH, atividade de água (Aw) e umidade. A medição do potencial hidrogeniônico (pH) foi medido em potenciômetro mPA21o MS Tecnopon®. Para a quantificação da umidade, foram utilizados cadinhos secos por 1h e pesado amostras de 5g e seco na estufa TE-393/2 TECNAL® à 105ºC por 8h. Adicionalmente, a atividade de água foi medida no aqualab PRE®.
RESULTADOS E DISCUSÕES
- Análises físico-químicas
Os resultados para a análises físico-químicas da bebida fermentada se encontram na Tabela 2 abaixo:
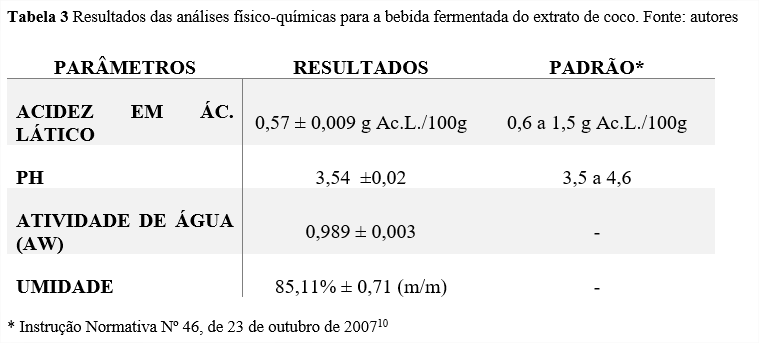
A quantidade de ácido lático presente em uma bebida fermentada está totalmente relacionada ao metabolismo da cultura láctea utilizada e também ao substrato que será consumido por ela17. Para a acidez titulável expressa em ácido lático, obteve-se um valor de 0,57 ± 0,009 g de ácido lático /100g de amostra, sendo que o parâmetro de acidez definido pela IN Nº 46/200710 para o iogurte é entre 0,6 a 1,5 g de ácido lático /100g, estando apenas a 0,03 g abaixo do padrão. Entretanto, para uma bebida fermentada a partir de um extrato vegetal, no qual não possui uma quantidade açúcares elevada, a adição da sacarose na formulação auxiliou na substituição da lactose presente no leite, tendo então um substrato para a cultura láctea. Destarte, Dantas (2019)18 em seu trabalho de desenvolvimento de uma bebida fermentada de leite de coco potencialmente probiótica obteve um resultado de 0,439 g de ácido lático/100g, estando próximo ao encontrado na bebida fermenta desenvolvida no presente estudo. Segundo Santos (2020)19 a sacarose, quando utilizada como substrato para o fermento, libera uma boa quantidade de ácidos orgânicos e resulta na produção de ácido lático pelas bactérias ácido láticas (BAL).
O pH está também relacionado com o metabolismo das BALs e com a acidez do meio. No mesmo estudo de Santo (2020)19 sua formulação totalmente vegetal de grão-de-bico e coco, obteve um pH final de 3,74 e em comparação com potencial hidrogeniônico encontrado de 3,54 relaciona-se totalmente com a quantidade ácido lático e ácido cítrico da formulação presente na bebida fermentada. Segundo Moreira (2019)20 o pH pode influenciar as caraterísticas organolépticas do produto, como também aspectos visuais e de viscosidade. Ademais, foi observado que no produto final desenvolvido houve uma ligeira mudança de coloração do branco para um róseo claro.
A atividade de água (aW) está relacionada com o conceito de água livre presente no alimento, estando disponível para qualquer tipo de reações químicas e para o desenvolvimento de microrganismos. Quando esse valor é alto pode acelerar a deterioração de certos tipos de alimentos21. Neste trabalho, os valores obtidos para a aW foram de 0,989 ± 0,003. Resultados similares também foram encontrados no trabalho de Messa et. al (2019)5 apresentando valores de 0,995 ± 0,001 para a bebida fermentada probiótica de leite de coco. Em suma, valores tão altos de atividade de água podem favorecer o crescimento microbiano, e esse fator foi observado nas análises microbiológicas realizadas neste mesmo estudo.
Assim como a aW, a umidade também está relacionada com a água presente nos alimentos, entretanto a umidade de um alimento é a contabilidade da quantidade total de água presente, ou seja, a água ligada aos componentes do alimento e a livre22. Neste trabalho, a porcentagem de umidade obtida foi de 85,11% ± 0,71 (m/m), semelhantemente no trabalho de Junior (2019)23 onde a umidade para a bebida simbiótica de castanha-do-Brasil obteve um valor de 83,04±0,21
- Análises microbiológicas
Os resultados para as análises microbiológicas da bebida fermentada do extrato de coco obtidos estão dispostos na Tabela 3:
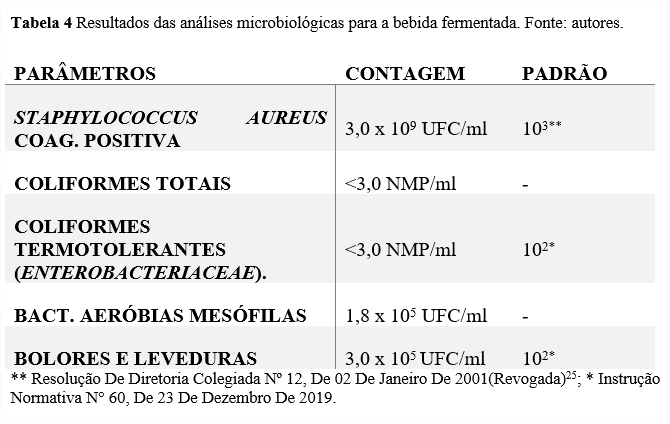
O S. aureus é uma bactéria gram-negativa, com atividade de crescimento ótimo de pH entre 6,0 e 7,0, porém podendo desenvolver-se em extremos de 4,2 a 9,0, sendo considerado um microrganismo indicador de contaminação principalmente do ambiente e do manipulador, pois essa bactéria está presente nas mãos e nas mucosas humanas, sendo este um dos principais motivos de intoxicações alimentares por enterotoxinas24. Staphylococcus aureus coag. positiva apresentou uma contagem de 3,0×109 UFC/mL. Levando-se em consideração os padrões estabelecidos pela RDC Nº12/200125 para o leite de coco o produto está em desconformidade, pois ultrapassa o limite máximo de 103 UFC/mL. A nova regulamentação, a IN Nº. 60/201926 não dispõe de limites máximos para a presença de S. aureus em leite de coco ou derivados do coco.
Apesar da bebida fermentada ter sido pasteurizada antes do processo fermentativo, e levando em consideração o pH da formulação do extrato do coco que foi de 4,7, o esperado seria de uma baixa contagem. Entretanto, mesmo a pasteurização tendo sido realizada, a temperatura utilizada pode ter sido baixa, para que todas cepas fossem eliminadas. Além disso, o coco utilizado já poderia conter uma alta contaminação antes da formulação do extrato
O grupo dos coliformes são microrganismos indicadores de higiene importantes em alimentos. Tal grupo se divide em dois, os totais, que são bactérias relacionadas com contaminação oriunda do ambiente, e os termotolerantes que são indicativos de uma possível contaminação por bactérias presentes no trato intestinal de humanos e animais29. As análises para coliformes totais e termotolerantes, obtiveram resultados negativos para a formação de gás no método do número mais provável, sendo assim, apresentaram valores menores que 3 NMP/mL na bebida fermentada. Outrossim, apesar da legislação não apresentar um padrão máximo de NMP/mL para os coliformes totais, um valor baixo de NMP é um ótimo indicativo que as condições higiênicas dos utensílios utilizados na elaboração foram seguidos . Ademias, para os coliformes termotolerantes a contagem também foi menor que 3 NMP/mL estando então, em conformidade com o padrão máximo de 102 NMP/ml apresentado pela legislação26, indicando que a pasteurização realizada foi efetiva contra o grupo dos coliformes. Contudo outro aspecto pode ter contribuído para ausência de coliformes, como o que foi relatado por Bicudo et. al (2012)30 em sua pesquisa de elaboração de uma bebida fermentada vegetal a base de quinoa, onde a ausência de coliformes foi associada ao baixo pH do produto final, podendo ter injuriado as células desses microrganismos tornando-os inviáveis.
As bactérias mesófilas aeróbias podem ter representantes que fazem parte da família das Enterobacteriaceae, compostas principalmente por gram-positivas, tais como Clostridium e o Streptococcus, sendo assim, sua contagem auxilia no monitoramento higiênico-sanitário dos processos de produção31. O resultado para as mesófilas aeróbias foi de 1,8×105 UFC/mL da bebida fermentada. Dança (2015)32 em sua pesquisa com bebida vegetal de soja, obteve uma contagem para as mesófilas aeróbias de 2,4×107 UFC/ml, sendo este valor mais levado ao que foi encontrado no presente estudo, desse modo, ele discorre que um limite tolerável para a contagem seria de 106 UFC/ml. Levando em consideração a contagem tolerável por Dança (2015)32, o resultado obtido indica um ótimo fator de controle higiênico-sanitário.
O crescimento de bolores e leveduras em alimentos é um dos fatores determinantes da shelf life, principalmente para alimentos com acidez e atividade de água (aW) elevados33. O resultado obtido para os bolores e leveduras foi de 4×105 UFC/mL, estando em discordância com a legislação vigente, que apresenta um valor máximo de 102 UFC/ml. Na pesquisa de desenvolvimento de uma bebida probiótica de leite de coco realizada por Messa et. al (2019)5 , os valores para a contagem de bolores e leveduras foram de 3,38 a 9,48 log UFC/g, estando com valores próximos aos encontrados na presente pesquisa. Apesar disso, o autor correlaciona esses valores altos com a existência desses microrganismos na matéria-prima, e recomenda um tratamento térmico adicional antes da formulação da bebida fermentada. Ademais, pode-se ressaltar que o crescimento de bolores e leveduras pode ser conveniente em bebidas fermentadas, as quais desenvolvem-se juntamente com as BAL, pois a acidez e o pH proporcionado pela fermentação propiciam o seu crescimento34,porém altas contagens podem acarretar deterioração, o que não foi observado no produto final. Sendo assim, novos estudos e pesquisas serão realizadas com o fim de revisar toda a formulação, desenvolver, adicionar novos processos e operações unitárias, afim de tornar a bebida mais nutritiva, segura e sensorialmente aceitável
CONCLUSÃO
A bebida fermentada do extrato de coco, apresentou valores físico-químicos em conformidade com os parâmetros previstos pela IN Nº46/2007 do MAPA. Em contrapartida, para os parâmetros microbiológicos nem todos padrões previstos foram atendidos. Portanto, a elaboração da bebida fermentada do extrato de coco é viável, demonstrado que é possível obter um alimento nutritivo e saboroso para a população que sofre com restrições alimentares e também para quem busca uma alimentação mais saudável.
REFERÊNCIAS
1.Solorzano J. L. Bebida à base de quinoa real e leite de coco: desenvolvimento, caracterização físico-química, análise microbiológica e aceitabilidade.. 2011. 36 f. TCC (Graduação) – Curso de Nutrição, Centro Universitário de Brasília, Brasília, 2011.
2.Berzuino MB, Fernandes RCS., Lima MA, Matias ACG.; Pereira IRO. Alergia alimentar e o cenário regulatório no brasil. Revista Eletrônica de Farmácia, [S.L.], v. 14, n. 2, p. 23-26, 18 set. 2017. Universidade Federal de Goias. http://dx.doi.org/10.5216/ref.v14i2.43433.
3.Alves AS, Lima NC, Martins GBC. Diferenciação de diagnósticos e tratamentos entre alergia e intolerância ao leite. Research, Society And Development, [S.L.], v. 10, n. 15, p. 1-10, 15 nov. 2021. Research, Society and Development. http://dx.doi.org/10.33448/rsd-v10i15.22643.
4.Jesus EP, Bertan LC. Uso de fonte alternativa no desenvolvimento de iogurte vegano adicionado de inulina. XI Jornada de Iniciação Científica e Tecnológica, Laranjeiras do Sul, v. 1, n. 1, p. 1-5, out. 2021.
5. Messa SP, Nespolo CR, Sehn CP, Pinheiro FC, Ferreira MB, Soares GM. Desenvolvimento De Alimento Probiótico De Leite De Coco Sem Açúcar Adicionado. Revista Contexto & Saúde, [S.L.], v. 19, n. 37, p. 52-58, 17 dez. 2019. Editora Unijui. http://dx.doi.org/10.21527/2176-7114.2019.37.52-58.
6.Sanches FL.Utilização de leite de coco na elaboração de sobremesa cremosa sabor cacau. 2018. 60 f. TCC (Graduação) – Curso de Engenharia de Alimentos, Universidade Federal da Fronteira Sul, Laranjeiras do Sul, 2018.
7. Brasil, Resolução RDC Nº 83 de 15 de setembro de 2000. Dispõe sobre o Regulamento Técnico para Fixação de Identidade e Qualidade de Leite de Coco. Diário Oficial da União, Brasília, 2000.
8. TEXEIRA, EAM, Maia GA, Holanda LFE de H, Oliveira GSF de, Júnior JCG, Figueiredo RW de. Processo alternativo para conservação do leite de coco produzido para consumo comercial. Pesq. Agropec. Bras, Brasília, v. 6, n. 24, p. 761-768, jun. 1989.
9. Junior MS, Bassinello PZ, CM, Velasco P, Reis RC dos, Carvalho WT de. Bebidas saborizadas obtidas de extratos de quirera de arroz, de arroz integral e de soja. Ciência e Agrotecnologia, [S.L.], v. 34, n. 2, p. 407-413, abr. 2010. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s1413-70542010000200019.
10.Brasil. Instrução Normativa nº 46, de 23 de outubro de 2007. Aprova o Regulamento Técnico de Identidade e Qualidade de Leites Fermentados. Diário Oficial da União, Brasília, DF; 2007.
11. Spada JC, Crizel TM, Gonçalves ACM, Borges KM, Laranja DC, Cardozo NSM, et. al. Influência da adição de inulina e mucilagem de chia nas propriedades reológicas e sensoriais de iogurtes com reduzido teor de gordura. In: Congresso Brasileiro De Engenharia Química, 2014, Florianópolis. XX Congresso Brasileiro de engenharia química. Florianópolis: Blucher, 2014. p. 1-8.
12.Bacovicz, MR. Aplicação De Mucilagem De Chia (Salvia Hispanica L.) E Orapronóbis (Pereskia Aculeata M.) Em Pó No Desenvolvimento De Frozen Yogurt De Abacaxi. 2021. 50 f. TCC (Graduação) – Curso de Engenharia de Alimentos, Departamento Acadêmico de Engenharia de Alimentos, Universidade Tecnológica Federal do Paraná, Medianeira, 2021.
13.Ruaro, TT. Elaboração De Geleia De Abacaxi Com Adição De Mucilagem De Chia (Salvia Hispânica). 2015. 36 f. TCC (Graduação) – Curso de Tecnologia em Alimentos, Universidade Tecnológica Federal do Paraná, Medianeira, 2015.
14.Silva N da, Junqueira VCA, Silveira NFA, Taniwaki MH, Santos RFS dos, Gomes RAR. Manual de Métodos de Análise Microbiológica de Água e Alimentos.4. ed. São Paulo – Sp: Varela, 2010.
15. Instituto Adolfo Lutz (São Paulo). Métodos físico-químicos para análise de alimentos/coordenadores: Odair Zenebon, Neus Sadocco Pascuet e Paulo Tiglea – São Paulo: Instituto Adolfo Lutz, p. 1020, 2008
16. Castanheira, ACG. Controle de qualidade de leite e derivados. 2. ed. São Paulo: Cap-Lab, 2012. 1 v.
17. Faria APA, Penna CF de AM, Pinto MS, Endo É. Influência do leite com elevada contagem de células somáticas sobre características físico-químicas e processo de fermentação de iogurte. Ciência Animal Brasileira, [S.L.], v. 21, n. 1, p. 1-14, nov. 2020. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/1809-6891v21e-44773.
18.Dantas, D S. Bebida fermentada de leite de coco (Cocos nucifera) adicionada de cultura nativa potencialmente probiótica e polpa de jambolão (Syzygium cumini (L.) Skeels). 2019. 72 f. Dissertação (Mestrado) – Curso de Ciências Farmacêuticas, Universidade Estadual da Paraíba, Campina Grande, 2019.
19.Santos MCM dos. Bebida De Grão-De-Bico E Coco fermentada por lactobacillus paracasei subsp. Paracasei lbc 81 elaborada com diferentes teores de açúcar. 2020. 98 f. Tese (Doutorado) – Curso de Nutrição Humana, Universidade de Brasília, Brasília, 2020.
20. Moreira PZ. Elaboração e caracterização físico-química de bebida vegetal fermentada saborizada com ameixa seca. 2019. 48 f. TCC (Graduação) – Curso de Gastronomia, Universidade Federal Rural de Pernambuco, Recife-Pe, 2019.
21.Srinivasan D, Kirk L, Fennema OR. Química de alimentos de Fennema. 4. ed. Porto Alegre: Artmed, 2010.
22. Santos, MIS dos, Oliveira MPG de. Determinação do teor de umidade em farinhas de coco industrializadas e comercializadas a granel na região metropolitana do recife. 2020. 20 f. TCC (Graduação) – Curso de Nutrição, Faculdade Pernambucana de Saúde, Recife-Pe, 2020.
23.Júnior PC da C. Desenvolvimento de bebida simbiótica à base de castanha-do-Brasil. 2019. 71 f. Dissertação (Mestrado) – Curso de Ciência dos Alimentos, Universidade Federal do Rio de Janeiro, Seropédica, RJ, 2019.
24. Silva JFM, Feitosa AC, Rodrigues RM. Staphylococcus Aureus Em Alimentos. Desafios – Revista Interdisciplinar da Universidade Federal do Tocantins, [S.L.], v. 4, n. 4, p. 15-31, 3 out. 2017. Universidade Federal do Tocantins. http://dx.doi.org/10.20873/uft.2359-3652.2017v4n4p15.
25.Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução RDC nº 12, de 02 de janeiro de 2001. Aprova o Regulamento Técnico sobre padrões microbiológicos para alimentos. Diário Oficial da União: seção 1, Brasília, DF, ano 139, n. 7, p. 40- 53, 2 jan. 2001.
26.Brasil. Ministério Da Saúde. Agência Nacional De Vigilância Sanitária (ANVISA). Instrução Normativa N° 60, De 23 De Dezembro De 2019. Estabelece as listas de padrões microbiológicos para alimentos. Diário Oficial da União: seção 1, Brasília, DF, n. 7, p. 133, 16 dez. 2019.
27.Júnior FP de A, Lima BT de M, Alves TWB, Menezes ME da S. Fatores que propiciam o desenvolvimento de Staphylococcus aureus em alimentos e riscos atrelados a contaminação: uma breve revisão. Revista de Ciências Médicas e Biológicas, [S.L.], v. 18, n. 1, p. 89-93, 3 jul. 2019. Universidade Federal da Bahia. http://dx.doi.org/10.9771/cmbio.v18i1.25215.
28.Pavanelli MF, Santos IC. Coliformes totais e termotolerantes em ervas de tereré nacionais e importadas. SaBios [Internet]. 31º de julho de 15(2):6-10.
29. Valentim AB, Souza GMR de, Monteiro GR, Assis RC de. Contagem de coliformes totais e Escherichia coli em alimentos no comércio ambulante: uma revisão integrativa. Cadernos Unifoa, [S.L.], v. 16, n. 47, p. 129-137, 6 set. 2021. Fundação Oswaldo Aranha – FOA. http://dx.doi.org/10.47385/cadunifoa.v16.n47.3537.
30. Bicudo MOP, Vasques É de C, Zuim DR, Candido LMB. Elaboração E Caracterização De Bebida Fermentada À Base De Extrato Hidrossolúvel De Quinoa Com Polpa De Frutas. Boletim do Centro de Pesquisa de Processamento de Alimentos, [S.L.], v. 30, n. 1, p. 19-26, 20 ago. 2012. Universidade Federal do Paraná. http://dx.doi.org/10.5380/cep.v30i1.28468.
31.Stadtlober GAW. Avaliação de facas, superfícies de contato e carcaças quanto a contaminação por bactérias aeróbias mesófilas e Enterobacteriaceae em um frigorifico de suínos do Rio Grande Do Sul. 2021. 57 f. Dissertação (Mestrado) – Curso de Ciência e Tecnologia de Alimentos, Universidade Federal de Pelotas,, Pelotas, 2021.
32.Dança J da AE. Avaliação Físico-Química e microbiológica do Leite de soja para a produção do Iogurte na cidade de Chimoio. 2015. 58 f. Monografia (Especialização) – Curso de Engenharia de Alimentos, Universidade Católica de Moçambique, Chimoio, 2015.
33.Fazio MLS, Campana GHG, Geromel MR. Bolores/Leveduras e Staphylococcus aureus em pães franceses comercializados na região de Catanduva– SP. Revista Interciência, Catanduva, v. 1, n. 4, p. 17-24, jul. 2020.
34.Rezende LV. Desenvolvimento de bebida fermentada neutracêutica por Weissella confusa utilizando o extrato da amêndoa de Baru (Dipteryx alata Vogel) como substrato. 2018. 40 f. Dissertação (Mestrado) – Curso de Ciência e Tecnologia de Alimentos, Universidade Federal da Grande Dourados, Dourados, 2018.
Tag:ENAG


