
CARACTERIZAÇÃO DO AZEITE DE PEQUI (Caryocar brasiliensis Camb.) SOB AQUECIMENTO
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Mara Lina Rodrigues1; Irene Rodrigues Freitas2; Neuza Jorge3*
1Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
3Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected]
Resumo: Devido ao alto teor de lipídios encontrados na polpa do pequi, uma forma de aproveitamento secular deste fruto desenvolvida pelos agricultores familiares da região do Cerrado é a fabricação do azeite de pequi. Entretanto, pouco se sabe sobre as características desse azeite quando utilizado sob aquecimento. Assim, o objetivo deste trabalho foi caracterizar o azeite de pequi comercial (APC) e o azeite de pequi extraído em condições controladas (APECC) sob aquecimento acelerado em estufa (60°C/20 dias) em comparação com a gordura de palma comercial (GPC) e o óleo de soja comercial (OSC). As amostras foram avaliadas fisicoquimicamente e quanto à estabilidade dos seus compostos bioativos. As análises físico-químicas revelaram comportamentos semelhantes para o APC e APECC, com resultados aproximados aos da GPC; enquanto para o OSC, os resultados foram maiores em relação aos demais. A estabilidade oxidativa dos azeites de pequi e da GPC foi similar e diminuiu ao longo da estocagem. Na análise de cor, os óleos avaliados não sofreram grandes alterações. Quanto aos compostos bioativos, os carotenoides e os fenólicos totais dos azeites de pequi resistiram até o final da estocagem. Os maiores teores de fitosteróis foram encontrados nos azeites de pequi e os maiores teores de tocoferóis foram identificados no OSC, que foram degradados ao longo do teste acelerado em estufa. Pode-se concluir que, embora ambos os processos de extração sejam laboriosos, independentemente deles, o azeite de pequi tem elevado potencial para ser utilizado sob aquecimento brando.
Palavras-chave: aquecimento; Caryocar brasiliensis Camb.; estocagem
INTRODUÇÃO
O bioma Cerrado ocupa aproximadamente 24% do território nacional, sendo o 2° maior do Brasil e localizado, principalmente, no estado de Goiás e Distrito Federal. Possui uma flora formada por vegetação herbácea, arbustos, árvores pequenas e solo com pouca fertilidade (PEREIRA et al., 2021). Apresenta inúmeros recursos naturais renováveis adaptados às duras condições climáticas, edáficas e hídricas que determinam sua própria existência (MAROUELLI, 2003). Segundo Batista e Sousa (2019), o Cerrado tem várias espécies nativas com potencial extrativista. Dentre as espécies frutíferas que merece atenção, destaca-se a Caryocar brasiliense Camb, cujo nome popular é pequizeiro.
Na região do Cerrado, o pequizeiro apresenta-se como espécie importante: primeiro por constituir-se como fonte alimentícia e como elemento gerador de renda para os agricultores familiares que residem nesta região e, segundo porque esta espécie pode ser utilizada na recuperação de áreas degradadas do Cerrado. A família Caryocaraceae engloba dois gêneros e cerca de 25 espécies, sendo que no Brasil há 13 espécies, distribuídas em 10 Caryocar e três Anthodiscus (SOUZA; LORENZI, 2005).
O fruto do pequizeiro, conhecido como pequi, é constituído pelo exocarpo de coloração esverdeada ou marrom-esverdeada, mesocarpo externo e mesocarpo interno, que constitui a porção comestível do fruto, possuindo coloração amarelada (pirênios). Possui grandes quantidades de lipídios, proteínas, vitamina A e carotenoides (MELO JUNIOR et al., 2004).
O azeite de pequi é muito apreciado pela população, embora ainda seja obtido artesanalmente por meio de um processo laborioso e demorado e, apresente baixo rendimento, ou seja, para cada 100 dúzias de pirênios são obtidos, em média, dois litros de azeite (AQUINO, 2007). O azeite de pequi tem ação anti-inflamatória, antioxidante, antimicrobiana, antifúngica e reduz problemas cardiovasculares (NUNES et al., 2021; PEREIRA et al., 2021), podendo ser utilizado como substituto do óleo de soja na cozinha.
Desta maneira, faz-se necessário investigar o comportamento do azeite de pequi quando submetido ao aquecimento por meio de avaliações físico-químicas e de substâncias bioativas.
MATERIAL E MÉTODOS
Material
Foram utilizados dois diferentes azeites de pequi, um extraído de forma comercial (APC) e outro em condições controladas (APECC). Comercialmente, o azeite de pequi é extraído da polpa por meio de sucessivas fervuras dos pirênios, seguidas de solidificação com água fria e secagem em chama para eliminação de água residual. Aproximadamente, 20 L de azeite comercial foram adquiridos de uma empresa localizada em Canedo-GO.
Para a extração sob condições controladas, os frutos de pequi foram adquiridos em Catalão-GO e transportados ao Laboratório de Processamento de Alimentos do Instituto Federal de Goiás (IFG), em Aparecida de Goiânia-GO. Os pequis foram mantidos em temperatura ambiente por três dias, e, depois, excluíram-se os frutos que apresentavam excesso de injúrias e os que não estavam completamente maduros. Em seguida, as cascas dos frutos foram retiradas manualmente, para a obtenção dos pirênios. Os pirênios foram colocados em recipiente de alumínio, na proporção de 1:5 de pirênios:água (m:v), e aquecidos em um fogão industrial (Focco, Pagolli, Goiânia, Goiás, Brasil) por 5 horas. Após esse período, o azeite sobrenadante foi retirado e colocado sob refrigeração (4 ± 2°C) por 2 horas. Novamente o azeite obtido foi aquecido em béquer por 5 ± 2 minutos para eliminação do excesso de água.
Ambos os azeites foram transportados para São José do Rio Preto-SP, fundidos em banho-maria (40 ± 5°C), filtrados em cinco camadas de nylon para a remoção de eventuais resíduos, de acordo com o método de Rodrigues et al. (2013). Em seguida, foram envasados em vidros âmbares de 1 L, inertizados com nitrogênio gasoso e estocados sob congelamento (-18°C) até o momento das análises.
Além disso, foi utilizada a gordura de palma comercial (GPC)obtida da polpa do fruto da palmeira oleaginosa Elaeis Guineensis por métodos físicos, embalada em balde de 15 kg e adquirida no comércio de Aparecida de Goiânia-GO. E também foi usado óleo de soja comercial (OSC) adquirido em São José do Rio Preto-SP. Tanto a gordura de palma, quanto o óleo de soja foram homogeneizados, e, posteriormente, envasados em vidros âmbares de 1 L, inertizados com nitrogênio gasoso e estocados sob congelamento (-18°C) até o momento das análises. Os óleos foram analisados no Laboratório de Óleos e Gorduras do IBILCE-UNESP em São José do Rio Preto-SP.
Teste acelerado em estufa
Os óleos (± 85 mL de cada) foram colocados em béqueres de 250 mL, com relação superfície/volume de 0,4/cm. Foram mantidos continuamente a 60 ± 2°C em estufa com circulação forçada de ar (MA 035, Marconi, Piracicaba, São Paulo, Brasil), retirados nos períodos de 0, 5, 10, 15 e 20 dias de estocagem, transferidos para frascos âmbar de 100 mL, inertizados com nitrogênio gasoso e acondicionados à temperatura de -18°C até a realização das análises.
Métodos
Propriedades físico-químicas
Os ácidos graxos livres, índice de peróxidos, dienos conjugados e ρ-anisidina foram determinados de acordo com a AOCS (2009). Os compostos polares totais foram realizados por meio do instrumento Testo 270 (Campinas, São Paulo, Brasil) com os óleos previamente aquecidos a 90 ± 5°C, seguindo a metodologia de Osawa et al. (2012). O índice de estabilidade oxidativa foi medido conforme a AOCS (2009) utilizando o Rancimat (modelo 743, Metrohm Ltda., Herisau, Switzerland) a 110ºC, com fluxo de ar de 20 L/h. A análise de cor foi realizada em colorímetro (ColorFlex EZ 45/0, Hunterlab, Virginia, Estados Unidos) conectado a um computador provido de software (Universal Versão 4.10, Hunterlab, Virginia, Estados Unidos), de acordo com Nyam e Lau (2015).
Compostos bioativos
Os carotenoides totais foram determinados por meio de espectrofotômetro (modelo UV mini 1240, Shimadzu, Tóquio, Japão) e detectados a λ = 446 nm segundo Lin, Sue e Ain (1995) e Mustapa et al. (2011). Os teores de carotenoides foram calculados por meio da equação: carotenoides totais (mg de β-caroteno/kg) = (V x 383 x Abs)/(100 x m), onde V representa o volume utilizado na diluição, Abs representa a absorvância da amostra em λ = 446 nm, e m é a massa da amostra de óleo.
Os compostos fenólicos totais foram determinados conforme Kalantzakis et al. (2006), utilizando uma curva padrão de ácido gálico (R2 = 0,9985), sendo detectados a λ = 765 nm em espectrofotômetro (UV-VIS mini 1240, Shimadzu, Chiyoda-ku, Tóquio, Japão) e os resultados expressos em mg ácido gálico/kg.
Os tocoferóis foram analisados de acordo com a AOCS (2009) em cromatógrafo líquido de alta eficiência (modelo 210-263, Varian, Walnut Creek, Estados Unidos) equipado com detector de fluorescência, injetor manual e coluna empacotada com sílica (Microsorb 100-5 Si, Varian, Walnut Creek, Estados Unidos). O fluxo isocrático foi de 1,20 mL/min., os comprimentos de onda de excitação e emissão foram 290 e 330 nm, respectivamente. A fase móvel foi uma mistura de n-hexano:isopropanol (99,5:0,5 v/v). Uma curva padrão de α-, β-, γ- e δ-tocoferol (Supelco, Bellefonte, Estados Unidos) com elevado grau de pureza foi elaborada sob as mesmas condições de operação para quantificar os resultados por meio de comparação com o tempo de retenção. Os resultados foram expressos em mg/kg, sendo os limites de detecção α ≤ 3,15 mg/kg, β ≤ 1,10 mg/kg, γ ≤ 8,65 mg/kg e δ ≤ 2,30 mg/kg.
Antes da análise de fitosteróis, os óleos foram saponificados conforme metodologia proposta por Duchateau et al. (2002). Os teores de fitosteróis foram quantificados conforme a AOCS (2009), em cromatógrafo a gás (modelo Plus-2010, Shimadzu, Chiyoda-ku, Toquio, Japão) equipado com detector de ionização de chama, sistema de injeção split e coluna capilar de sílica fundida (Restek RTX 5, Shimadzu, Toquio, Japão). O forno foi aquecido a 300°C/12 min. e as temperaturas utilizadas no injetor e no detector foram de 280 e 320°C, respectivamente. Os isômeros foram identificados por comparação com o tempo de retenção dos padrões puros (Supelco, Bellefonte, Estados Unidos) analisados sob as mesmas condições da amostra e quantificados por padronização interna (5α-cholestano-3β-ol) baseado na área de cada pico. Os teores de fitosteróis foram expressos em mg/100 g, sendo os limites de detecção: campesterol ≤ 5,20 mg/100 g; estigmasterol ≤ 5,60 mg/100 g; estigmastanol ≤ 4,25 mg/100 g e brassicasterol ≤ 2,70 mg/100 g.
Análise estatística
Foram realizadas análises de variância (ANOVA) e teste de Tukey (ao nível de 5% de probabilidade) utilizando o Software R.
RESULTADOS E DISCUSSÃO
Propriedades físico-químicas
Sendo um produto de degradação hidrolítica dos triacilgliceróis, o teor de ácidos graxos livres é considerado um importante índice de qualidade para os óleos. Esse teor varia de acordo com o tipo de óleo e sua classe comercial, sendo regulamentado pelo Codex Alimentarius Commission (2009) um limite de até 2,0% de ácidos graxos livres expressos em ácido oleico. Assim, durante toda a estocagem, embora os teores de ácidos graxos livres tenham aumentado na GPC e OSC, em 20 dias ainda atendiam ao preconizado pela legislação, enquanto o APC e o APECC mostraram comportamentos diferentes durante a estocagem. O teor de ácidos graxos livres do APC oscilou entre 0,4 e 0,5%, em relação aos tempos; enquanto no APECC, os valores diminuíram com o tempo de estocagem, atingindo 0,7% em 20 dias (Figura 1a).
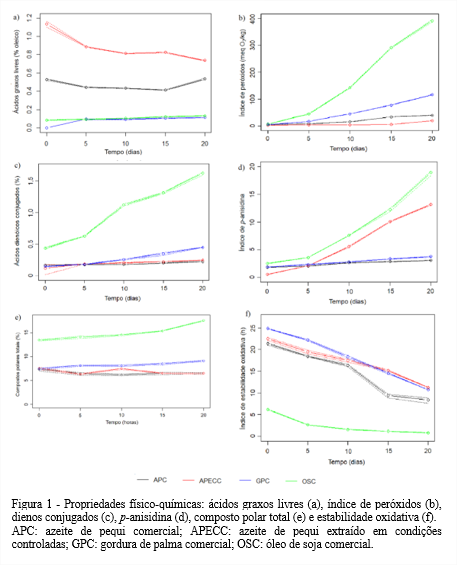
Para avaliar a degradação oxidativa foram determinados os índices de peróxidos, dienos conjugados e ρ-anisidina. Inicialmente, os óleos apresentaram índices de peróxidos estatisticamente iguais, e houve aumento até o final da estocagem. O aumento do índice de peróxidos é atribuído à formação de hidroperóxidos, que são produtos primários da oxidação. Os hidroperóxidos podem decompor-se em produtos secundários voláteis e não voláteis que deterioram a qualidade dos lipídios (O’KEEFE; PIKE, 2010).
O Codex Alimentarius Commission (2009) estabelece para peróxidos em óleos brutos o limite de 15 meq O2/kg. Assim, tanto o APC quanto o APECC apresentaram valores dentro dos limites durante a estocagem (Figura 1b). Diferentemente do encontrado por Silva (2017), que estudando o óleo de pequi provindo do município de Babaçulândia, no Tocantins, encontrou inicialmente, 16,31 meq O2/kg. Viroli et al. (2022) caracterizando o óleo de pequi produzido artesanalmente em Pium, no Tocantins, concluíram que a região de coleta influencia sobre os parâmetros físico-químicos, centesimais e microbiológicos do óleo de pequi.
Durante o teste acelerado em estufa, o APC e o APECC apresentaram maior resistência à elevação do índice de peróxidos quando comparados com os valores obtidos para a GPC e o OSC. Ambos os azeites apresentaram aumento similar no índice de peróxidos até 10 dias de estocagem, porém, o APC mostrou maior elevação do que o APECC, a partir dos 15 dias, possivelmente associado ao teor de carotenoides desses azeites. Como o teor de carotenoides do APC foi menor que o do APECC, o APC foi mais susceptível às reações de alterações durante o teste acelerado em estufa. Por outro lado, o OSC apresentou maiores valores com o decorrer da estocagem, provavelmente por apresentar grande quantidade de ácidos graxos poli-insaturados, susceptíveis à oxidação, e ser refinado.
O APC e o APECC durante o período de estocagem mostraram ser mais resistentes à formação de ácidos dienóicos conjugados e seus teores não ultrapassaram 0,3%. Enquanto, a GPC e o OSC sofreram aumento, sendo que o OSC aumentou em 200% entre os tempos inicial e final (Figura 1c).
Para avaliar os produtos secundários da oxidação, determinou-se o índice de ρ-anisidina dos óleos (Figura 1d). Pode-se notar que o aumento da formação de compostos secundários no APC e na GPC foi baixo e que seus valores permaneceram similares ao longo de todo o teste acelerado em estufa, corroborando com os resultados obtidos no índice de peróxidos (Figura 1b), onde o APC apresentou baixos índices desses compostos. O APECC obteve elevado índice de ρ-anisidina ao final do teste acelerado em estufa, diferentemente da GPC, que se mostrou resistente à formação de compostos secundários de degradação. Essa resistência ao longo da estocagem pode estar relacionada com seu perfil de ácidos graxos, cuja característica é baixo teor de insaturados. Dentre os óleos avaliados, o OSC apresentou o maior índice de ρ-anisidina ao final do teste acelerado em estufa. Esse valor possivelmente foi consequência da elevada formação de compostos primários de degradação, devido à alta reatividade das insaturações desse óleo com o oxigênio singlete (ZHANG et al., 2012).
Os compostos polares totais têm polaridade maior que os triacilgliceróis e são resultantes de alterações térmicas, hidrolíticas e oxidativas (GHARACHORLOO et al., 2010). A fração polar é constituída, então, por moléculas resultantes de degradação e de decomposição da fração não-polar. A avaliação do teor de compostos polares totais (Figura 1e) dos azeites de pequi mostrou, para ambos, valores semelhantes e pequena variação ao longo do teste acelerado em estufa. O OSC foi o que apresentou os maiores percentuais de compostos polares totais. Lee e Choe (2012) ao estudarem o óleo de gergelim torrado em teste acelerado em estufa durante quatro semanas, verificaram que o percentual de compostos polares formados aumentou, passando de cerca de 3,0 para 6,5% ao final deste período. Os valores obtidos por estes autores foram semelhantes aos obtidos neste estudo tanto para o APC, quanto para o APECC em 20 dias.
Inicialmente, os azeites de pequi apresentaram boa estabilidade oxidativa, com tempos de indução de 21,5 e 22,5 h para o APC e APECC, respectivamente. Ao longo do período de estocagem, houve redução do tempo de indução para ambos, sendo que o APC sofreu decréscimo mais intenso entre 10 e 15 dias de estocagem. Ao final dos 20 dias, o APC demonstrou período de indução (9,5 h) semelhante ao encontrado para azeites de oliva não aquecidos (9,53 h) produzidos em diferentes regiões do Brasil e da Espanha, de acordo com o estudo de Borges et al. (2017). Tais valores indicam que os azeites de pequi avaliados são resistentes ao processo oxidativo, possivelmente devido à combinação do seu perfil de ácidos graxos e das substâncias bioativas naturalmente presentes em sua composição.
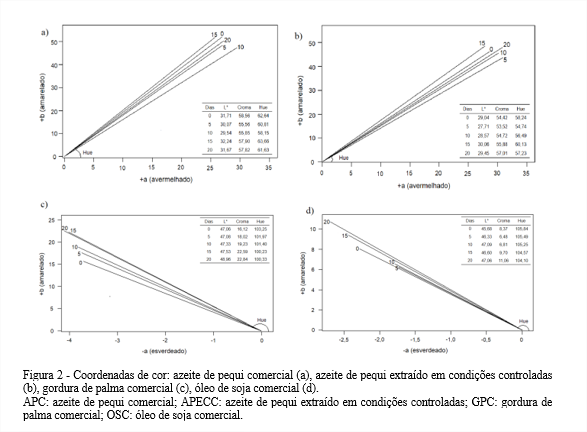
Devido à diversidade de suas matérias-primas, mesmo no tempo inicial, os óleos avaliados já apresentavam cores distintas. Ao longo do teste acelerado em estufa pode-se verificar que ocorreram pequenas alterações de cor, como pode ser observado nas Figuras 2a, b, c, d.
Para a GPC e o OSC, que passaram por processo de refinação, visualmente não foi verificada diferença de cor entre os tempos iniciais e finais no teste acelerado em estufa e essa percepção foi validada na análise instrumental.
Compostos bioativos
Apenas os azeites de pequi apresentaram elevados teores de carotenoides totais (Figura 3a). O APC apresentou teor inicial de carotenoides totais estatisticamente menor que o APECC e essa diferença se manteve até o final da estocagem. A diferença no teor de carotenoides do APC e do APECC no tempo inicial pode estar relacionada à variação das condições edafoclimáticas, pois são frutos de origens distintas. Nota-se, ainda, que houve um declínio mais acentuado entre os dias 5 e 10 no teor de carotenoides do APECC, enquanto para o APC houve um maior declínio desse teor entre os dias 15 e 20 de estocagem. Com o decorrer do teste acelerado em estufa, houve redução nos teores de carotenoides totais do APC e APECC.
A GPC e o OSC, pelo fato de serem refinados, apresentaram apenas 2,4 e 0 mg de β-caroteno/kg, respectivamente. Szydłowska-Czerniak et al. (2011) comprovaram a redução do teor de carotenoides por meio do processo de refinação em estudo com óleo de palma. Na avaliação de dois processos de refinação física, um tradicional e um modificado, a degradação dos carotenoides totais foi de 43,8 para 0,30 e de 38,5 para 0,18 mg β-caroteno/100 g óleo, respectivamente.
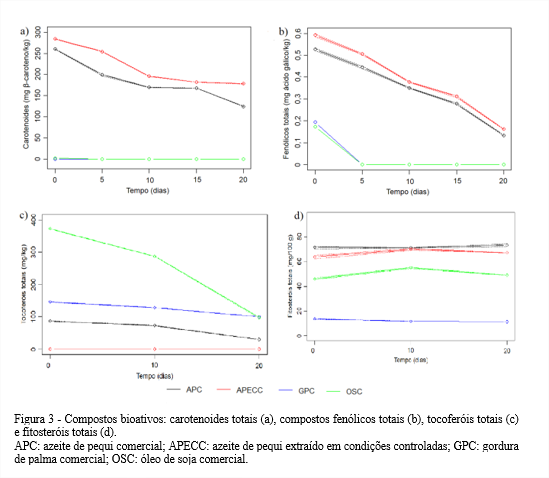
No início, tanto os azeites APC e APECC, quanto a GPC e OSC apresentaram baixas quantidades de compostos fenólicos, destacando-se o OSC com 0,2 mg ácido gálico/kg (Figura 3b). Apesar de serem óleos brutos, os azeites de pequi foram extraídos utilizando-se longos tempos de fervura em água. Como os compostos fenólicos são substâncias termo-sensíveis, ainda que estivessem presentes na polpa do pequi estes foram degradados durante o processo de extração (CHENG et al., 2014). Por outro lado, o baixo teor de compostos fenólicos totais encontrados na GPC e no OSC pode estar relacionado às perdas ocasionadas principalmente pela etapa de neutralização no processo de refinação (FARHOOSH; EINAFSHAR; SHARAYEI, 2009).
Entre 0 e 5 dias de estocagem, os compostos fenólicos presentes na GPC e OSC foram totalmente degradados. Baixas quantidades de compostos fenólicos totais são comuns em óleos vegetais, devido a sua polaridade, com exceção para o azeite de oliva, que é rico em compostos fenólicos podendo variar conforme as condições da matéria-prima e do processo de extração, de 100 até 1.200 mg EAG/kg (DE LEONARDIS; MACCIOLA, 2012).
O APECC foi o único a não apresentar tocoferóis totais, conforme Figura 3c. O APC, no início, apresentava 87,2 mg de tocoferóis totais/kg, porém, teve um declínio acentuado a partir de 10 dias de estocagem, e, consequentemente, ao final apresentou apenas 29,9 mg de tocoferóis totais/kg. Verificou-se também que OSC foi o que apresentou maiores quantidades de tocoferóis totais.
Os maiores teores de fitosteróis totais foram evidenciados para APC e APECC, os quais se tornaram estatisticamente iguais em 10 dias (Figura 3 d). Além disso, os azeites apresentaram quantidades de fitosteróis totais superiores às encontradas na GPC e no OSC. A GPC apresentou os menores teores de fitosteróis, não sofrendo diminuição significativa ao final do processo de estocagem.
CONCLUSÕES
As análises físico-químicas dos óleos submetidos ao teste acelerado em estufa mostraram que os azeites de pequi, em geral, apresentaram características similares à GPC e foram mais resistentes que o OSC durante a estocagem. Devido à temperatura amena utilizada neste teste não foram verificadas variações significativas de cor.
Os azeites de pequi no tempo inicial apresentaram mais de 250 mg β-caroteno/kg. Os carotenoides e os compostos fenólicos totais dos azeites de pequi foram resistentes até o final do teste acelerado em estufa. Pode-se destacar nos azeites de pequi, ainda, os fitosteróis, que foram encontrados em maior quantidade, enquanto para os tocoferóis, os maiores teores foram identificados no OSC.
Por meio das análises físico-químicas e compostos bioativos foi possível averiguar que o azeite de pequi, independentemente do tipo de extração, tem elevado potencial para ser utilizado sob estocagem envolvendo aquecimento brando.
AGRADECIMENTOS
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa produtividade em pesquisa.
REFERÊNCIAS
AOCS. AMERICAN OIL CHEMISTS’ SOCIETY. Oficial Methods and Recommended Practices of the American Oil Chemists’ Society. 6 ed. Champaign: AOCS, 2009.
AQUINO, L. P. Extração do óleo da polpa de pequi (Caryocar brasiliense): influência das variáveis operacionais. 2007. 95 f. Dissertação (Mestrado em Ciência de Alimentos) – Departamento de Ciência dos Alimentos, Universidade Federal de Lavras, Lavras, 2007.
BATISTA, F. O.; SOUSA, R. S. Compostos bioativos em frutos pequi (Caryocar brasiliense camb) e baru (Dipteryx alata vogel) e seus usos potenciais: uma revisão. Brazilian Journal of Development, v. 5, n. 7, p. 9259-9270, 2019.
BORGES, T. H.; PEREIRA, J. A.; CABRERA-VIQUE, CARMEN; LARA, L.; OLIVEIRA, A. F.; SEIQUER, I. Characterization of arbequina virgin olive oils produced in different regions of Brazil and Spain: Physicochemical properties, oxidative stability and fatty acid profile. Food Chemistry, London, v. 215, p. 454-462, 2017.
CHENG, Y.; XU, Q.; LIU, J.; ZHAO, C.; XUE, F.; ZHAO, Y. Decomposition of five phenolic compounds in high temperature water. Journal of the Brazilian Chemical Society, v. 25, n. 11, p. 2102-2107, 2014.
CODEX. CODEX ALIMENTARIUM COMMISSION. Codex Stan 210-1999: codex standard for named vegetable oils. Rome, 2009.
DE LEONARDIS, A.; MACCIOLA, V. Heat-oxidation stability of palm oil blended with extra virgin olive oil. Food Chemistry, London, v. 135, n. 3, p. 1769-1776, 2012.
DUCHATEAU, G. S. M. J. E; BAUER-PLANK, C. G.; LOUTER, A. J. H.; HAM, M.; BOERMA, M.; ROOIJEN, J. J. M.; ZANDBELT, P. A. Fast and accurate method for total 4-desmethy sterol’s, content in spreads, fat-blends and raw materials. Journal of the American Oil Chemists’ Society, Chicago, v. 79, n. 3, p. 273-278, 2002.
FARHOOSH, R.; EINAFSHAR, S.; SHARAYEI, P. The effect of commercial refining steps on the rancidity measures of soybean and canola oils. Food Chemistry, London, v. 115, n. 3, p. 933-938, 2009.
GHARACHORLOO, M.; GHAVAMI, M.; MAHDIANI, M.; AZIZINEZHAD, R. The effects of microwave frying on physicochemical properties of frying and sunflower oils. Journal of the American Oil Chemists’ Society, Chicago, v. 87, n. 3, p. 355-360, 2010.
KALANTZAKIS, G.; BLEKAS, G.; PEGKLIDOU, K.; BOSKOU, D. Stability and radical-scavenging activity of heated olive oil and other vegetable oils. European Journal of Lipid Science and Technology, Weinheim, v. 108, n. 4, p. 329-335, 2006.
LEE, E.; CHOE, E. Changes in oxidation-derived off-flavor compounds of roasted sesame oil during accelerated storage in the dark. Biocatalysis and Agricultural Biotechnology, v. 1, n. 1, p. 89-93, 2012.
LIN, S. W.; SUE, T. T.; AIN, T. Y. PORIM Test Methods. Kuala Lumpur: Palm Oil Research Institute of Malaysia, 1995.
MAROUELLI, R. P. O desenvolvimento sustentável da agricultura no cerrado brasileiro. 2003. 54 f. Monografia (Especialização latu-sensu em Gestão Integrada da Agricultura Irrigada) – Faculdade Getúlio Vargas, Brasília, 2003.
MELO JUNIOR, A. F.; CARVALHO, D.; PÓVOA, J. S. R.; BEARZOTI, E. Estrutura genética de populações naturais de pequizeiro (Caryocar brasiliense Camb.). Scientia Forestalis, v. 66, p. 56-65, 2004.
MUSTAPA, A. N.; MANAN, Z. A.; AZIZI, C. Y.; SETIANTO, W. B.; OMAR, A. K. Extraction of β-carotenes from palm oil mesocarp using sub-critical R134a. Food Chemistry, London, v. 125, n. 1, p. 262-267, 2011.
NUNES, A. C.; SOUZA, A. L. C.; SANTOS, T. A.; SILVA, T. P. Extração de óleos essenciais de Caryocar Coriaceum (pequi) por vias enzimáticas. Research, Society and Development, v. 16, n. 16, e237101623496, 2021.
NYAM, K. L.; LAU, H. W. Effects of microwave pre-treatment on the quality of kenaf (hibiscus cannabinus l.) seed oil. Journal of Food Science and Engineering, Valley Cottage, v. 5, n. 1, p. 14-21, 2015.
O’KEEFE, S. F.; PIKE, O. A. Fat characterization. In: NIELSEN, S. S. Food Analysis. New York: Springer Science & Business Media, 2010.
OSAWA, C. C.; GONÇALVES, L. A. G.; MENDES, F. M. Avaliação dos óleos e gorduras de fritura de estabelecimentos comerciais da cidade de Campinas/SP. As Boas Práticas estão sendo atendidas? Alimentos e Nutrição, Araraquara, v. 21, n. 1, p. 47-55, 2010.
PEREIRA, T. F.; SOUSA, M. V.; LEITE, I. F. Caryocar brasiliense do Cerrado brasileiro ao tratamento de feridas – Revisão integrativa. Research, Society and Development, v. 10, n. 6, 2021.
RODRIGUES, M. L.; SOUZA, A. R. M.; LIMA, J. C. R. de; MOURA, C. J.; GERALDINE, R. M. Cinética de degradação de carotenoides e da alteração de cor do azeite de pequi submetido ao aquecimento em temperatura de fritura. Ciência Rural, Santa Maria, v. 43, n. 8, p. 1509-1515, 2013.
SILVA, T. R. Caracterização química do óleo de pequi (Caryocar Brasiliense) das cidades de Babaçulândia, Araguaína e Jalapão (BAJA). 2017. Monografia (Licenciatura em Química) – Universidade Federal do Tocantins, Araguaína, 2017.
SOUZA, V. C.; LORENZI, H. Botânica sistemática: Guia ilustrado para identificação das famílias de Angiospermas da flora brasileira, baseado em APG II. Nova Odessa: Instituto Plantarum, 2005. 640 p.
SZYDŁOWSKA-CZERNIAK, A.; TROKOWSKI, K.; KARLOVITS, G.; SZŁYK, E. Effect of refining processes on antioxidant capacity, total contents of phenolics and carotenoids in palm oils. Food Chemistry, London, v. 129, n. 3, p. 1187-1192, 2011.
VIROLI, S. L. M.; RODRIGUES, F. M.; VIROLI, S. G.; CARVALHO, N. P.; ALVES, T. T.; LANÇA, A. C.; VIVIAN, J V.; RMOS, M. P.; VELOSO, C.; GOMES, N. B.; COSTA, F. A. Extraction and characterization of oil from the pulp of pequi (Caryocar brasiliense) produced manually in the allotment Piauzinho Municipality of Pium – TO. Research, Society and Development, v. 11, n. 4, e49911427711, 2022.
ZHANG, X.; DAI, B.; ZHANG, B.; WANG, Z. Vitamin A and risk of cervical cancer: a meta-analysis. Gynecologic Oncology, v. 124, n. 2, p. 366-373, 2012.
