
AUTENTICIDADE E QUALIDADE DO ÓLEO DE LICURI (Syagrus coronata)
Capítulo de livro publicado no livro do “ÓLEOS VEGETAIS: PROPRIEDADES FÍSICO-QUÍMICAS, BIOATIVAS E ANTIOXIDANTES“. Para acessa-lo clique aqui.
Este capítulo de livro foi escrito por:
Luciene Mendes da Silva1; Ana Carolina da Silva2; Susana Isabel Pereira Casal Vicente3; Neuza Jorge4*
1Doutora em Engenharia e Ciência de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP.
2Docente do Depto de Engenharia de Alimentos, Instituto de Ciências Tecnológicas e Exatas, Universidade Federal do Triângulo Mineiro – UFTM.
3Docente do Depto de Ciências Químicas, Faculdade de Farmácia da Universidade do Porto.
4Docente do Depto de Engenharia e Tecnologia de Alimentos, Instituto de Biociências, Letras e Ciências Exatas, Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP; *E-mail: [email protected]
Resumo: A Caatinga é um bioma estritamente brasileiro e, em particular, destaca-se por apresentar diversas espécies ainda pouco estudadas, a exemplo do licuri (Syagrus coronata), que possui elevado teor de lipídios na amêndoa. O óleo de licuri costuma ser extraído por prensagem a frio e é comercializado, principalmente, para saboarias e para fins alimentícios. Atrai o público devido à similaridade com o óleo de coco e a alta estabilidade. O presente trabalho teve como objetivo caracterizar óleos brutos de licuri advindos de diferentes localidades do estado da Bahia, comparando-os ao óleo de coco. Como resultado observou-se que o óleo de licuri, independente da localidade, época do ano e pré-tratamento, possui boa estabilidade oxidativa, boas características de qualidade e similaridade com o óleo de coco. Os óleos de licuri apresentaram baixos índices de peróxidos, ρ-anisidina, ácidos graxos livres e totox quando comparados com a legislação, sinalizando a sua boa qualidade, indicando que este óleo pode ser explorado para uso alimentício. Os óleos de licuri independente da localidade, forma de tratamento dado à amêndoa antes da extração do óleo e da época da colheita, apresentaram similaridade entre si e com o óleo de coco, principalmente na composição de ácidos graxos, tocotrienóis e triacilgliceróis.
Palavras-chave: compostos polares; óleos láuricos; tocoferóis; tocotrienóis; triacilgliceróis
INTRODUÇÃO
Os biomas brasileiros são caracterizados por uma elevada biodiversidade e riqueza em espécies nativas únicas, que nas últimas décadas, vêm sendo intensamente investigadas. Segundo Giulietti (2003), a Caatinga dentre os biomas brasileiros, provavelmente, é o mais desvalorizado e mal conhecido botanicamente, decorrente de uma crença injustificada, mas que não deve mais ser aceita, de que seria o resultado da modificação de uma outra formação vegetal, associada a uma diversidade muito baixa de plantas, sem espécies endêmicas e altamente modificada pelas ações antrópicas.
Porém, levantamentos mostram que este ecossistema possui um considerável número de espécies endêmicas e remanescentes de vegetação ainda bem preservada que devem ser consideradas como um patrimônio biológico de valor incalculável (CAVALCANTE, 2009; SANTOS, 2011).
Syagrus coronata é uma dessas espécies nativas de regiões semiáridas, e possui diversas potencialidades para as comunidades da Caatinga. O licuri é um dos produtos mais importantes das áreas mais típicas da Caatinga, explorado quase que exclusivamente na Bahia, principalmente nas microrregiões dos munícipios de Jacobina, Itaberaba e Euclides da Cunha (GIULIETTI, 2003). O licuri possui coloração verde, laranja e marrom, de acordo com o estádio de maturação (Figura 1).

Fonte: Imagens originais de Silva, L. M.
Aroucha e Aroucha (2013) afirmam que todas as partes do licurizeiro podem ser aproveitadas: raízes, caule, folhas por completo (bainhas, talos, palhas, fibras, talinhos, cera dos folíolos e capembas) e todo o coquinho (polpa, endocarpo e amêndoa). As aplicações são diversas: as folhas são usadas para construções, artesanatos diversos (chapéus, bolsas, esteiras, abanadores, vassouras e espanadores); os coquinhos são usados na alimentação humana e animal (ainda verdes cozidos ou secos ao sol) e para fabricação de artesanatos, sabões e óleos.
O licuri é fonte de renda para as comunidades das regiões que o possuem largamente. Os usos mais frequentes são da própria amêndoa (Figura 2) que pode ser consumida in natura, torrada ou cozida; na fabricação de doces, cocadas, licores, sorvetes, iogurtes, cervejas; sendo ainda possível a extração de óleo, o qual é destinado em sua maior parte para a saboaria.

Fonte: Imagens originais de Silva, L. M.
Como ainda não foi encontrado nas bases de dados consultadas um estudo mais detalhado do óleo extraído da amêndoa do licuri, este trabalho fornecerá dados mais precisos do seu uso em alimentos, além de ampliar o conhecimento científico em relação à produção de óleos vegetais no Brasil, uma vez que, ainda, não foram publicados dados a respeito da composição de fitosteróis, tocoferóis e tocotrienóis e da estabilidade oxidativa do óleo de licuri bruto.
MATERIAL E MÉTODOS
Material
Os óleos de licuri foram fornecidos, de acordo com a disponibilidade, por três cooperativas localizadas em cidades diferentes da Bahia: Caldeirão Grande (11°02’15.5″S 40°15’18.9″W), Monte Santo (10°26’45.5″S 39°29’28.6″W) e Capim Grosso (11°22’58.0″S 40°00’27.3″W). As três cidades estão localizadas em regiões de clima semiárido. As amêndoas destinadas à extração do óleo passaram por processo de secagem ao sol ou por secagem em fornos artesanais, cujos parâmetros tempo e temperatura são desconhecidos.
Os óleos de licuri foram codificados como: LIC1, LIC2, LIC3, LIC4, LIC5, LIC6 e LIC7. Os óleos LIC1, LIC2, LIC3 e LIC4 foram procedentes de Caldeirão Grande. Para todos os casos, as amêndoas passaram por processo de secagem ao sol. Os óleos LIC5 e LIC6 foram obtidos de amêndoas que passaram por secagem em fornos artesanais, e vieram das cidades de Caldeirão Grande e Capim Grosso, respectivamente. Já o LIC7 foi obtido da cooperativa localizada em Monte Santo. Os cooperados afirmam que o óleo é destinado para a produção de sabões. Para comparação foram realizadas algumas análises para o óleo de coco comercial, o qual foi adquirido no comércio do Porto em Portugal.
Métodos
As medidas de índice de refração, ponto de fusão, densidade, índices de iodo e de saponificação, matéria insaponificável, ácidos graxos livres, índice de peróxidos, ρ-anisidina e coeficientes de extinção, K232 e K268, foram determinados segundo métodos da AOCS (2009). O valor total de oxidação (Totox) foi calculado utilizando a equação: Totox = 2 (índice de peróxidos) + (valor de ρ-anisidina).
A estabilidade oxidativa foi conduzida pelo método proposto pela AOCS (2009), utilizando o Rancimat (modelo 982, Metrohm Ltda., Herisau, Switzerland). A determinação foi realizada a 120 ± 1,6ºC, com fluxo de ar de 20 L/h. O período de indução foi expresso em horas.
O parâmetro de cor foi mensurado em colorímetro (Minolta CR-400, Konica Minolta Optics, Toquio, Japão) pelo método CIELAB calibrado com uma placa branca, estimando os valores de a* (variação de cor do vermelho ao verde), b* (variação de cor do amarelo ao azul) e L* (luminosidade). As amostras foram analisadas em copo medidor de 7 mm de altura.
A composição de ácidos graxos foi realizada a partir do extrato lipídico transesterificado com solução metanólica de hidróxido de potássio (2 M) de acordo com ISO 2966-2 (2011). O perfil de ácidos graxos foi determinado usando cromatógrafo gasoso (Chrompack CP 9001, Middelburg, Holanda), com injetor split-splitless, detector de ionização de chama e amostrador automático (Chompack CP-9050). Os compostos foram separados em coluna capilar de sílica fundida CP-Sil 88 (50 m x 0,25 mm). As temperaturas do detector e injetor foram 250 e 230°C, respectivamente. A razão de divisão foi de 1:50 e o volume injetado 1 µL. O gás de arraste foi o hélio. A identificação dos picos cromatográficos foi realizada por comparação com uma mistura comercial de ésteres metílicos (supelco-37 FAME MIX), e os resultados foram expressos em porcentagem.
Os triacilgliceróis dos óleos de licuri foram separados usando cromatografia líquida de alta performance (CLAE), com base no método de Laureles et al. (2002). Uma solução foi preparada com 300-350 mg óleo dissolvido em 10 mL de tetrahidrofurano, 20 µL desta solução foram submetidos, a temperatura ambiente, a CLAE (Jasco, Toquio, Japão) com uma coluna Germini-NX 5 µm, 150 x 4,6 mm (Phenomenex Column) e um detector de índice de refração, usando propionitrilo como fase móvel a uma taxa de fluxo de 1 mL/min. Os números de carbono dos principais picos foram identificados usando o tempo de retenção de padrões saturados de triacilgliceróis tricaprilina (C24), tricaprina (C30), trilaurina (C36), trimiristina (C42) e tripalmitina (C48). Os resultados foram expressos em porcentagem relativa.
A separação dos isômeros de tocotrienóis e a sua quantificação foram realizadas em cromatógrafo líquido, equipado com uma bomba profusora modelo PU-980, uma câmara de mistura HG-980-30 e injetor automático AS2057 Plus. A detecção foi efetuada num detector de fluorescência (modelo FP2020 Plus, Jasco, Japão). As amostras foram preparadas de acordo com o método padrão ISO 9936 (2006), com pequenas modificações. Resumidamente, preparou-se uma solução diluindo o óleo em n-hexano com adição precisa do padrão interno e homogeneizou- se por agitação. Para a separação de diferentes compostos de vitamina E, 20 µL de amostra foram injetadas. Foi usada uma coluna de sílica de fase normal (SupelcosilTM LC-SI, 7,50 cm x 3 mm x 3 mm) (Supelco, EUA), condicionada a 25°C (ECOM, ECO 2000, República Checa) e eluída com fase móvel de hexano: dioxano (97:3, v/v), a um fluxo de 0,70 mL/min. A detecção foi programada para excitação em 290 nm e emissão em 330 nm. Os diferentes compostos de vitamina E foram identificados comparando os tempos de retenção com autênticos padrões e quantificados por curvas de calibração individuais, sendo expressos em mg/kg. Para os tocotrienóis foi utilizado como padrão apenas o α-tocotrienol.
Os esteróis foram determinados com base no Regulamento de Execução (UE) Nº 1348 (2013). Inicialmente, separou-se o extrato insaponificável presente na amostra e posteriormente, separou-se os esteróis e diálcoois triterpênicos dos compostos restantes através de cromatografia em camada delgada (CCD) utilizando placa de sílica (Merck). Os esteróis e diálcoois triterpênicos foram derivatizados e, seguidamente, foram analisados por GC-FID (Thermo Finnigan, Milão, Itália) usando coluna Zebron-5HT (15 x 0,25 x 0,10 µm) J & W Scientific, com gradiente de temperatura de 200ºC durante 1 min; 20ºC/min até 260ºC; 10ºC/min até 280ºC durante 5 min. O hélio (Gasin, Lessa da Palmeira, Portugal) foi utilizado como gás de arraste, com uma vazão de 0,8 mL/min. A injeção foi realizada por injetor automático (Thermo Scientific Al 1310, Itália), usando split de 1:100, volume de 0,20 µL e temperatura no injetor igual a 280ºC. A identificação de esteróis e dos diálcoois triterpênicos foi realizada por meio da comparação do tempo de retenção com padrões comerciais e por referências bibliográficas. Os resultados dos esteróis individuais foram relatados em percentagem relativa, enquanto, os esteróis totais foram representados em mg/kg. Nesta análise, utilizou-se a α-colestanol (0,20%) como padrão interno.
Análise estatística
Foram realizadas análises de variância (ANOVA) e teste Tukey para comparação entre médias (ao nível de 5% de probabilidade) para os diferentes tipos de óleos (LIC1, LIC2, LIC3, LIC4, LIC5, LIC6, LIC7 e coco) utilizando o Software SAS 9.0. As variáveis-resposta estudadas foram os parâmetros de identidade e qualidade.
RESULTADOS E DISCUSSÃO
O índice de refração de óleos e gorduras está diretamente relacionado com o comprimento da cadeia do ácido graxo e com as insaturações, podendo ser concatenado com o índice de iodo, que permite conhecer o grau de insaturação das moléculas (JORGE, 2009). No presente estudo, os valores de índice de refração variaram de 1,450 a 1,451 e o índice de iodo apresentou valores pertencentes ao intervalo 14,5 a 17,8 g I2/100 g (Tabela 1). Damodaran, Parkin e Fennema (2010) afirmam que óleos líquidos costumam ter valores de índices de refração entre 1,430 e 1,450, o que condiz com os resultados obtidos nesse trabalho que também é semelhante ao valor determinado pelo Codex Alimentarius Commission (2009), para o óleo de coco. Dentre os óleos estudados, o que apresentou maior índice de iodo foi o LIC4, e todos tiveram valores superiores aos estabelecidos para o óleo de coco e inferiores ao encontrado por Salles et al. (2010), 18,5 g I2/100 g. Essa diferença pode estar associada ao método de análise e às condições de extração do óleo e condições de armazenamento das amêndoas antes da extração do óleo.
O ponto de fusão depende da estrutura e do tamanho das moléculas dos triacilgliceróis puros. Os óleos são uma mistura de ácidos graxos, sendo que o ácido graxo majoritário terá mais influência nas características do ponto de fusão da mistura (DAMODARAN; PARKIN; FENNEMA, 2010). Os óleos analisados que têm em sua composição maior percentual de ácidos graxos saturados não apresentaram diferença significativa no ponto de fusão e o valor foi em torno de 21ºC.
A densidade de um óleo depende da cadeia dos ácidos graxos que o compõe, óleos com maiores teores de ácidos graxos saturados e de cadeias lineares tendem a ter uma maior densidade, pois terão maior facilidade de ocorrência de interações intermoleculares (DAMODARAN; PARKIN; FENNEMA, 2010). Na Tabela 1, pode-se observar que os valores de densidade encontrados para os óleos de licuri variaram de 0,93 a 0,96 g/cm3, valores semelhantes aos encontrados por Salles et al. (2010) ao analisar óleo de licuri com pretensão de usá-lo na produção de biodiesel, que obteve 0,93 g/cm3.
Os valores de índice de saponificação variaram entre 244,8 e 248,7 mg KOH/g. Ponte et al. (2017), em estudo com óleos de babaçu (Orbinya speciosa) e coco (Cocos nucifera), encontraram valores de índice de saponificação de 281,80 e 272,60 mg KOH/g, respectivamente, superiores aos preconizados pelo Codex Alimentarius Commission (2009) e também aos valores encontrados nessa pesquisa. Essa diferença pode estar associada ao método utilizado para análise, à composição dos ácidos graxos, dentre outros fatores.
Quanto ao teor de matéria insaponificável, não houve diferença significativa nas porcentagens encontradas, para todos os óleos, cujo teor foi de 2,5%. Como a matéria insaponificável inclui substâncias naturais como esteróis, tocoferóis, pigmentos e hidrocarbonetos, os óleos podem conter quantidades consideráveis desses compostos.
Quanto aos ácidos graxos livres, os óleos LIC1, LIC2, LIC3, LIC4 não apresentaram diferença estatística e tiveram valores inferiores aos encontrados para LIC5, LIC6 e LIC7. Essa diferença pode ter sido causada porque as amêndoas de LIC5 e LIC6 foram torradas antes da extração; desta forma, pode ter ocorrido a decomposição dos glicerídeos por hidrólise, liberando ácidos graxos livres.
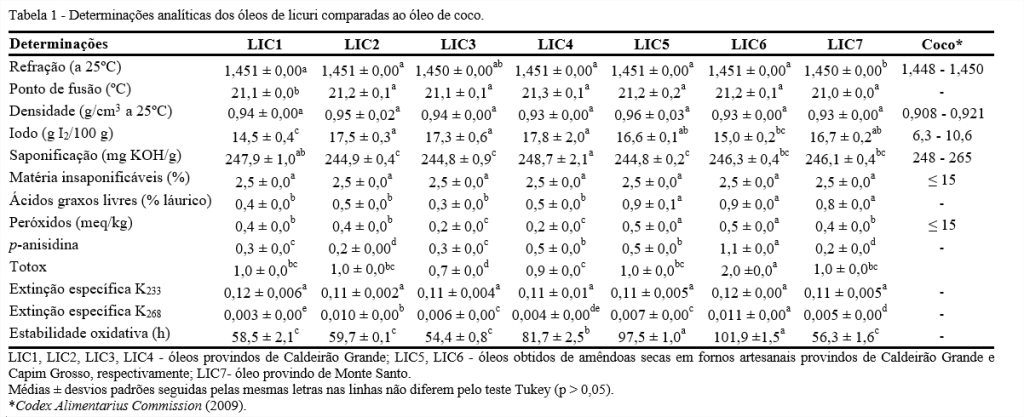
O óleo LIC7, por ser destinado à saboaria, pode não ter tido controle de qualidade durante e processamento e armazenamento. Além disso, as amêndoas podem ter sofrido injúrias por exposição à luz, oxigênio, dentre outros fatores que podem ter acelerado a formação dos ácidos graxos livres. Dentre os óleos estudados, LIC5 e LIC6 foram os que apresentaram maiores valores de ácidos graxos livres, 0,9% de ácido láurico. Esse valor ao ser convertido em % de ácido oleico resulta em 1,3, e, mesmo sendo valor mais alto com relação aos demais óleos analisados, ainda se encontra dentro do permitido pelo Codex Alimentarius Commission que admite o máximo de 5% em ácido oleico para óleos e/ou gorduras de coco brutos.
O índice de peróxidos está relacionado com a formação de compostos primários de oxidação. Os óleos estudados apresentaram valores de peróxidos dentro do intervalo de 0,2 a 0,5 meq/kg, abaixo do limite adotado pelo Codex Alimentarius Commission (2009), que estabelece até 15 meq/kg para óleos brutos, assim como para o óleo de coco. Srivastava e Semwal (2015) encontraram valor de peróxidos de 3,25 meq/kg para óleo de coco, superior aos encontrados para o óleo de licuri. Porém, de acordo com Damodaran, Parkin e Fennema (2010), um nível baixo de peróxidos não indica garantia de estabilidade oxidativa, uma vez que estes compostos são voláteis e ao longo do processo oxidativo podem ser decompostos a produtos que não seriam quantificados como peróxidos.
Os produtos da oxidação secundária como aldeídos insaturados, principalmente 2-alquenais e 2,4-alcadienos, foram quantificados como índice de p-anisidina. O óleo de licuri mostra uma baixa formação desses compostos (0,2-1,1) indicando boa estabilidade oxidativa. A legislação não estabelece limite para o valor de p-anisidina, mas em conjunto com o índice de peróxidos, pode ser calculado o valor total de oxidação ou Totox, que não deve ser superior a 10. Assim, quanto menor o valor de Totox, melhor a qualidade do óleo analisado (SILVA, 2015). Dentre as amostras, os valores totox foram baixos, indicando que os óleos estudados possuem boa estabilidade.
Os coeficientes específicos de extinção são também índices relacionados com os produtos da oxidação, e complementam os resultados obtidos para o índice de peróxidos, indicando a formação de compostos primários (K232) e a presença de compostos carboxílicos e secundários de oxidação (K268), respectivamente (MALHEIRO et al., 2012). Os óleos tiveram baixos valores para os coeficientes de extinção específica. Embora não existam valores máximos de K232 e K268 para óleos brutos, Casal et al. (2010) alegam que para azeites extra virgens, os valores limites são 2,50 e 0,20, respectivamente, o que indica que os óleos estudados apresentam boa qualidade, uma vez que os valores máximos foram 0,12 e 0,011 para K232 e K268, respectivamente.
A estabilidade do óleo de licuri bruto variou de 54,4 a 101,9 h, enquanto para o óleo de coco não existe valor pré-estabelecido. Por se tratar de índice de qualidade, os valores variaram independente da localidade e da época do ano. O óleo de licuri tem em sua composição majoritariamente ácidos graxos saturados, o que pode justificar a alta estabilidade oxidativa. Porém, as diferenças encontradas entre os óleos podem ser associadas ao tipo de tratamento e armazenamento das amêndoas antes do processo de extração.
Conforme Tabela 2, os resultados mostram que há tendência ao escurecimento maior nas amêndoas torradas e maior luminosidade nos óleos obtidos de amêndoas secas ao sol, o parâmetro L* tem maior valor para o óleo de coco.
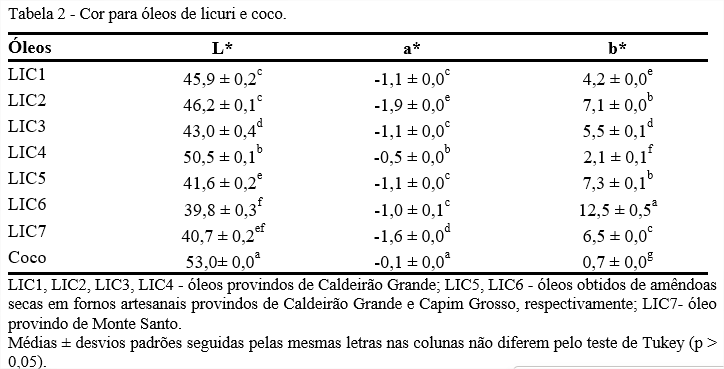
A coloração mais escura para os óleos obtidos de amêndoas torradas se deve ao processo de torrefação em que os açúcares redutores e aminoácidos reagem formando melanoidinas, produtos de cor castanha. Essa reação, conhecida como reação de Maillard, tem grande influência nos dados obtidos, principalmente visto pelo parâmetro L* (GÖKMEN; ŞENYUVA, 2006; WALL; GENTRY, 2007). Todos os óleos avaliados apresentaram tonalidades verdes e amarelas, verificadas pelos valores de a* (negativo) e b* (positivo) e tiveram baixa saturação indicando fraca coloração.
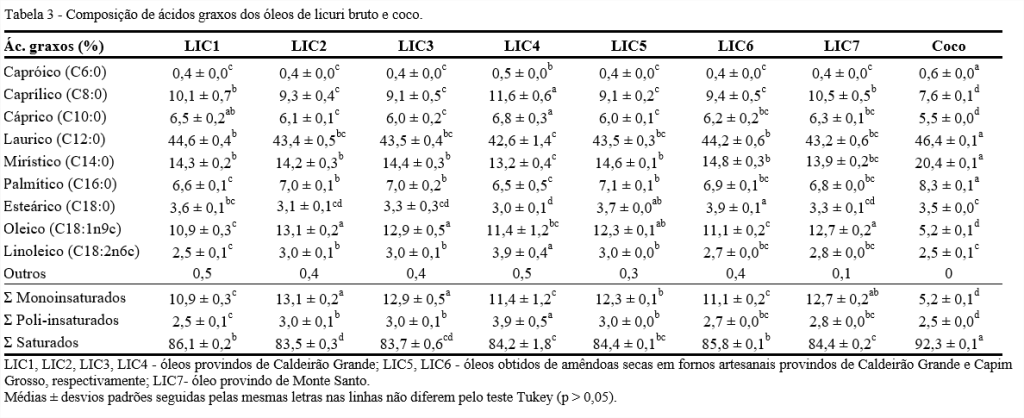
De acordo com a Tabela 3, o ácido láurico (C12:0) é o ácido graxo majoritário nos óleos de licuri, com teores que variam de 42,6 a 44,6%, seguidos de míristico (C14:0) que representa entre 13,2 e 14,8% e oleico (C18:1n9) com valores de 10,9 a 13,1%. Outras frações consideráveis são ácidos caprílico (C8:0) com valores de 9,1 a 11,6% e palmítico (C16:0) com teor de 6,6 a 7,1%. Os óleos de licuri apresentaram perfis de ácidos graxos semelhantes, porém, como houve diferenças significativas entre os ácidos avaliados, há um indicativo de que a época do ano, a localidade e o tratamento dado às amêndoas podem interferir nas características dos óleos.
Comparando-se o perfil de ácidos graxos dos óleos de licuri ao de coco, essa diferença é ainda mais notada. Tomando como exemplos os ácidos mirístico e oleico, observa-se que o coco teve valor aproximadamente 7% a mais e 6% a menos, respectivamente, com relação ao óleo de licuri.
O óleo de licuri, como observado, é uma fonte rica de ácidos graxos de cadeia média e, dessa forma, pode ser adequado para aplicações biomédicas (indústrias cosmética e farmacêutica), como mostrado por Leal et al. (2013); para produção de biodiesel (SALLES et al., 2010; IHA et al., 2014); como um importante antimicrobiano com ação comprovada para Staphylococcus aureus (KITAHARA et al., 2006; LEAL et al., 2013) e como potencial uso para alimentos (BAUER et al., 2013). No óleo da amêndoa do jerivá, outra palmeira encontrada no Cerrado, também predominam os ácidos láurico e oleico (JORGE; SILVA; VERONEZI, 2021).
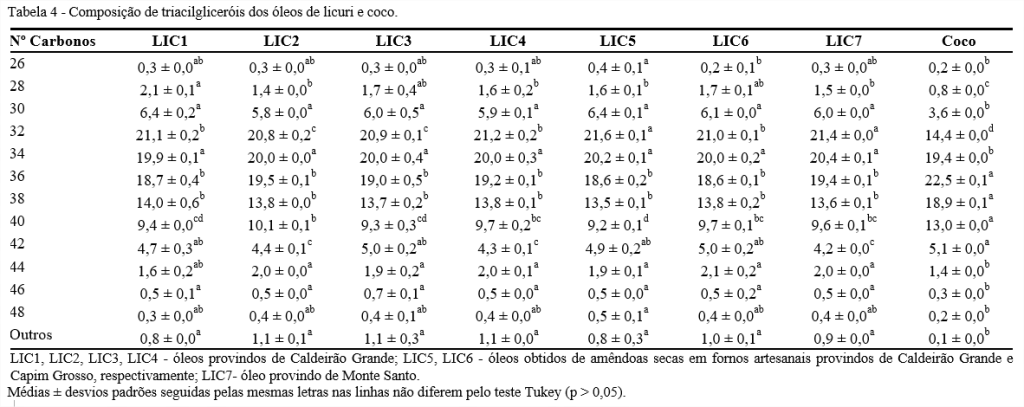
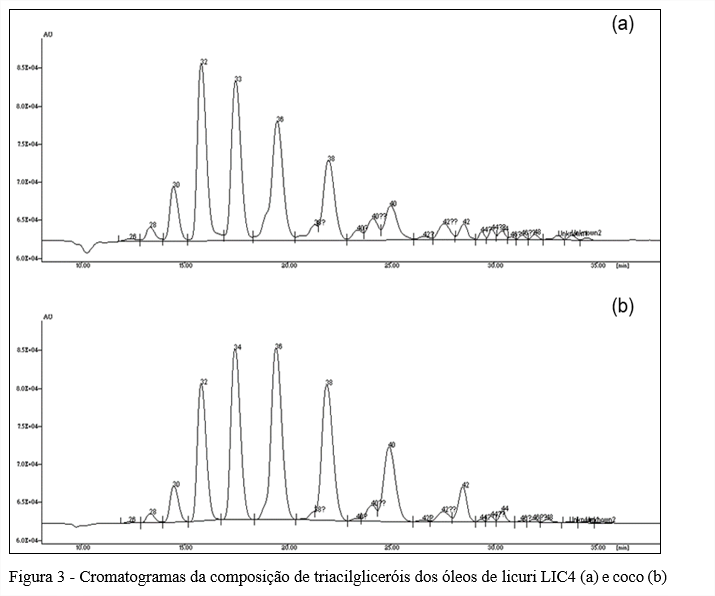
Os óleos de licuri e coco apresentaram 12 espécies de triacilgliceróis (C26 a C48), predominando os de C32 (20,8-21,6%) em todos os óleos de licuri analisados, enquanto para o óleo de coco, o triacilglicerol de C36 foi maior (22,5%), conforme Tabela 4 e Figura 3.
Nota-se que para os triacilgliceróis de C30, C34, C36, C38 e C46 não houve variação significativa entre os óleos de licuri, sendo observado a variação somente entre estes e o óleo de coco. Dessa forma, a composição de triacilgliceróis pode servir como um bom parâmetro de autenticidade do óleo de licuri. Os valores de triacilgliceróis aqui relatados são similares ao encontrados por Laureles et al. (2002) quando estudaram a composição de triacilgliceróis de óleos de diferentes cultivares de coco e híbridos.
O α-tocotrienol (α-T3) foi predominante para todos os óleos analisados com valores que vão do 61,2 a 64,9% (Tabela 5). Segundo o Codex Alimentarius Commission (2009), o óleo de coco também tem o α-T3 como isômero predominante (nd-44 mg/kg). O γ-tocotrienol (γ-T3) apresentou quantidades relevantes para todos os óleos estudados, nos óleos de licuri (21,8-29,3%), e no de coco este valor foi de 17,9%.
Segundo Qureshi et al. (2000), tocotrienóis são encontrados em cereais e vegetais, como óleos de palma, farelo de arroz, coco, gérmen de cevada, gérmen de trigo e urucum. Óleos de palma e farelo de arroz contêm quantidades particularmente altas de tocotrienóis, 940 e 465 mg/kg, respectivamente (AGGARWAL et al., 2010). Outras fontes de tocotrienóis incluem óleos de aveia, avelã, milho, azeite, baga de espinheiro, centeio, sementes de uva, linho, papoula e girassol (KANNAPPAN et al., 2012).
Os tocotrienóis têm excelentes propriedades antioxidantes e são capazes de prevenir o processo de peroxidação lipídica autocatalítica (SERBINOVA; PACKER, 1994). Segundo Sen, Khanna e Roy (2007), os seus isômeros possuem poderosas propriedades hipocolesterolêmicas, anticancerígenas e neuroprotetoras, que, muitas vezes, não são exibidas pelos tocoferóis. Afirmam, ainda, que os tocotrienóis são capazes de inibir a biossíntese de colesterol, além de possuírem importante ação antioxidante.
Os valores de esteróis totais variaram de 756,3 mg/kg (LIC1) até 912,32 mg/kg (LIC4); o óleo de coco foi o que obteve menor valor 708,6 mg/kg, conforme Tabela 6. Ngampeerapong, Chavasit e Durst (2018) determinaram o perfil de fitosteróis do leite de coco, óleo de coco centrifugado e óleo de coco fermentado e, para esses dois últimos, os fitosteróis totais foram superiores, 89,89 e 95,12 mg/100 g, respectivamente, aos encontrados neste estudo. Esses valores podem ser justificados devido ao processo de obtenção e forma de conservação do óleo, entre outros fatores.
De acordo com o Codex Alimentarius Commission (2009), o valor médio de β-sitosterol em óleos vegetais é de 60%. Nos óleos de licuri, o β-sitosterol tem prevalência confirmada (61,7-63,9%), seguidos pelo campesterol (14,3-16%), ∆5-avenasterol (10,9-12,1%) e estigmasterol (5,6-7%), com pequenas quantidades de outros esteróis.
Os principais esteróis presentes nos óleos de licuri também foram observados para o óleo de coco, porém, as quantidades foram diferentes apresentando 70,4; 7,4; 29,4 e 21,3% para β-sitosterol, campesterol, ∆5-avenasterol e estigmasterol, respectivamente, e, neste caso, também apresenta o β-sitosterol como predominante entre os esteróis na fração insaponificável.
CONCLUSÕES
Os óleos de licuri possuíram baixos índices de peróxidos, p-anisidina, ácidos graxos livres e totox quando comparados com a legislação, sinalizando a sua boa qualidade, indicando que este óleo pode ser explorado para uso alimentício. Os óleos de licuri independente da localidade, forma de tratamento dado à amêndoa antes da extração do óleo e da colheita, apresentaram similaridade entre si e com o óleo de coco, principalmente na composição de ácidos graxos, tocotrienóis e triacilgliceróis.
AGRADECIMENTOS
Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelas bolsas de doutorado e produtividade em pesquisa, respectivamente, e ao Programa Erasmus Mundos – Projeto Euroinka.
REFERÊNCIAS
AGGARWAL, B. B.; SUNDARAM, C.; PRASAD, S.; KANNAPPAN, R. Tocotrienols, the vitamin e of the 21st century: its potential against cancer and other chronic diseases. Biochemical Pharmacology, New York, v. 80, p. 1613-1631. 2010.
AOCS. AMERICAN OIL CHEMISTS’ SOCIETY. Oficial Methods and Recommended Practices of the American Oil Chemists’ Society. 6 ed. Champaign: AOCS, 2009.
AROUCHA, E. P. L.; AROUCHA, M. L. Boas práticas de manejo para o extrativismo sustentável do licuri – Brasília: Instituto Sociedade, População e Natureza. 2013. 92 p.
BAUER, L. C.; DAMÁSIO; J. M. A.; SILVA, M. V.; SANTANA, D. A.; GUALBERTO S. A.; SIMIONATO, J. I. Chemical characterization of pressed and refined licuri (Syagrus coronata) oils. Acta Scientiarum Technology, Maringá, v. 35, p. 771-776, 2013.
CASAL, S.; MALHEIRO, R.: SENDAS, A.; OLIVEIRA, B. P. P.; PEREIRA, J. A. Olive oil stability under deep-frying conditions. Food and Chemical Toxicology, Oxford, v. 48, n. 10, p. 2972-2979, 2010.
CAVALCANTE, M. B. Ecoturismo no Bioma Caatinga: O Caso do Parque Estadual da Pedra da Boca, Paraíba. Revista Nordestina de Ecoturismo, São Paulo, v. 2, n. 1, p. 25-38, 2009.
CODEX ALIMENTARIUS COMISSION (FAO/WHO). Codex standart for named vegetable oils: codex stan 210-1999. Codex Alimentarius, Rome, v. 10, 2009.
DAMODARAN, S.; PARKIN, K. L.; FENNEMA, O. R. Química de alimentos de Fennema. 4ª ed, Porto Alegre: Artmed, 2010.
GÖKMEN, V.; ŞENYUVA, H. Z. S. Study of colour and acrylamide formation in coffee, wheat flour and potato chips during heating. Food Chemistry, London, v. 99, n. 2, p. 238-243, 2006.
IHA, O. K.; ALVES, F. C. S. C.; SUAREZ, P. A. Z.; OLIVEIRA, M. B. F.; MENEGHETTI, S. M. P.; SANTOS, B. P. T.; SOLETTI, J. I. Physicochemical properties of Syagrus coronata and Acrocomia aculeata oils for biofuel production. Industrial Crops and Products, Amsterdan, v. 62, p. 318-322, 2014.
ISO 9936. Animal and vegetable fats and oils – Determination of tocopherol and tocotrienol contents by high performance liquid chromatography. Geneva. 2006.
ISO 12966-2. Animal and vegetable fats and oils – Gas chromatography of fatty acid methyl esters – Part 2: Preparation of methyl esters of fatty acid. Geneva. 2011.
GIULIETTI, A. M. Diagnóstico da vegetação nativa do bioma Caatinga. In: SILVA, J. M. C.; TABARELLI, M.; FONSECA, M. T.; LINS, L. V. (Org.). Biodiversidade da caatinga: áreas e ações prioritárias para a conservação. Brasília, DF: Ministério do Meio Ambiente, Universidade Federal de Pernambuco, 2003, 382 p.
JORGE, N. Química e tecnologia de óleos vegetais. São Paulo: Cultura Acadêmica, 2009, 165p.
JORGE, N.; SILVA, A. C.; VERONEZI, C. M. Syagrus romanzoffiana. In: LIMA, F. F.; LESCANO, C. H.; OLIVEIRA, I. P. (org.). Fruits of the Brazilian Cerrado: composition and functional benefits. Gewerbestrasse: Srpinger Nature, 2021, p. 141-159.
KANNAPPAN, R.; GUPTA, S. C.; KIM, J. H.; AGGARWAL. B. B. Tocotrienols fight cancer by targeting multiple cell signaling pathways. Genes & Nutrition, Easton, v. 7, n. 1, p. 43-52, 2012.
KITAHARA, T.; AOYAMA, Y.; HIRAKATA, Y.; KAMIHIRA S.; KOHNO S; ICHIKAWA N.; NAKASHIMA, M.; SASAKI, H.; HIGUCHI, S.; In vitro activity of lauric acid or myristylamine in combination with six antimicrobial agents against methicillin-resistant Staphylococcus aureus (MRSA). International Journal of Antimicrobial Agents, Oxford, v. 27, p. 51-57, 2006.
LAURELES, L. R.; RODRIGUEZ, F. M.; REANO, C. E.; SANTOS, G. A.; LAURENA, A. C.; MENDOZA, E. M. T. Variability in Fatty Acid and Triacylglycerol Composition of the Oil of Coconut (Cocos nucifera L.) Hybrids and Their Parentals. Journal of Agricultural and Food Chemistry, Easton, v. 50, p. 1581-1586, 2002.
LEAL, L. B.; SOUSA, G. D.; SEIXAS, K. B.; DE SOUZAI, P. H. N.; SANTANA, D. P. Determination of the critical hydrophile-lipophile balance of licuri oil from Syagrus coronata: Application for topical emulsions and evaluation of its hydrating function. Brazilian Journal of Pharmaceutical Sciences, São Paulo, v. 49, p. 167- 173. 2013.
MALHEIRO, R.; CASAL, S.; LAMAS, H.; BENTO, A.; PEREIRA, J. A. Can tea extracts protect extra virgin olive oil from oxidation during microwave heating? Food Research International, Barking, v. 48, n. 1, p. 148-154, 2012.
NGAMPEERAPONG, C.; CHAVASIT, V.; DURST, R. W. Bioactive and nutritional compounds in virgin coconut oils. Malaysian Journal of Nutrition, Selangor, v. 24, n. 2, p. 257-267, 2018.
PONTE, F. A. F.; RODRIGUES, MALVEIRA, J. S.; J. Q.; RAMOS FILHO, J. S; ALBUQUERQUE, M. C. G. Avaliação físico-química dos óleos de babaçu (Orbignya speciosa) e coco (Cocos nucifera) com elevado índice de acidez e dos ácidos graxos (C6 a C16). Scientia Plena, São Cristovão, v. 13, p. 085301, 2017.
QURESHI, A. A.; QURESHI N. HALSER-RAPACZ, J. O. WEBER, F. E.; CHAUDHARY, V.; CRENSHAW, T. D.; GAPOR, A.; ONG, A. S.; CHONG, Y. H.; PETERSON, D. Dietary tocotrienols reduce concentrations of plasma cholesterol, apolipoprotein B, thromboxane B2, and platelet factor 4 in pigs with inherited hyperlipidemias. The American Journal of Clinical Nutrition, New York, v. 53, p. 1042S-1046S, 2000.
Regulamento de Execução (UE) n.º 1348/2013 da Comissão, de 16 de Dezembro de 2013, que altera o Regulamento (CEE) n.º 2568/91, relativo às características dos azeites e dos óleos de bagaço de azeitona, bem como aos métodos de análise relacionados. Jornal Oficial da União Europeia, L338, 17 de Dezembro de 2013.
SALLES, T. S., K; MENEGHETTI, S. M. P.; SALLES, W.F. L.; MENEGHETTI, M. R.; SANTOS, I. C. F.; SILVA C. J. P. V.; SOLETTI, S.H.V. J. I. Characterization of Syagrus coronata (Mart.) Becc. oil and properties of methyl esters for use as biodiesel. Industrial Crops and Products, Amsterdan, v. 32, n. 3, p. 518-521, 2010.
SANTOS, J. A. R. Avaliação das propriedades físico-químicas, fluidodinâmicas e oxidativas do biodiesel de licuri (Syagrus coronata) e das blendas (Licuri/Soja). 2011. 82 f. Dissertação (Mestrado em Química) – Universidade Federal da Paraíba, João Pessoa, 2011.
SEN, C. K.; KHANNA, S.; ROY, S. Tocotrienols in health and disease: the other half of the natural vitamin E family. Molecular Aspects of Medicine, Elmsford, v. 28, n. 5- 6, p. 692-728, 2007.
SERBINOVA, E. A.; PACKER, L. Antioxidant properties α-tocopherol and α- tocotrienol. Methods in Enzymology, New York, v. 234, p. 354-366, 1994.
SILVA, S. A. Óleos vegetais extraídos a frio comercializados na cidade de São Paulo: avaliação das características de identidade e qualidade e da ocorrência de hridrocarbonetos policíclicos aromáticos. 2015. 129 f. Dissertação (Mestrado em Nutrição em Saúde Pública) – Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo, 2015.
SRIVASTAVA, Y.; SEMWAL, A. D. Study on monitoring of frying performance and oxidative stability of virgin coconut oil (VCO) during continuous/prolonged deep fat frying process using chemical and FTIR spectroscopy. Journal of Food Science and Technology, Mysore, v. 52, n. 2, p. 984-991, 2015.
WALL, M. M.; GENTRY, T. S. Carbohydrate composition and color development during drying and roasting of macadamia nuts (Macadamia integrifolia). LWT – Food Science and Technology, London, v. 40, p. 587-593, 2007.
