
TOLERÂNCIA DE ISOLADOS DE ACINETOBACTER SPP. PROVENIENTES DE ALIMENTOS AO ÁCIDO PERACÉTICO
Capítulo de livro publicado no livro do I Congresso Latino-Americano de Segurança de Alimentos. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/08082023-36
Este trabalho foi escrito por:
Luana Monteiro Fernandes ; Rogerio Caldeira Rodrigues Malta *; Gustavo Luis de Paiva Anciens Ramos ; Janaína dos Santos Nascimento
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Acinetobacter spp. são bactérias extremamente relevantes em ambientes clínicos. Recentemente, elas surgiram como potenciais patógenos oportunistas de origem alimentar. Estudos sobre a tolerância de Acinetobacter spp. de origem alimentar a sanitizantes utilizados na indústria de alimentos e residências são necessários para ajudar a mitigar a contaminação dos alimentos por esses micro-organismos. Neste trabalho, isolados de saladas prontas (n = 11) e de leite de cabra cru (n = 4) foram avaliados quanto à tolerância ao ácido peracético (PAA). A Food and Drug Administration (FDA) recomenda que a concentração desse sanitizante em equipamentos e utensílios de processamento de alimentos e outros artigos em contato com alimentos não exceda 200 partes por milhão (ppm). Apenas três isolados de saladas e os quatro isolados de leite de cabra foram inibidos por concentrações mínimas inibitórias (MIC) e bactericidas (MBC) inferiores a 200 ppm de PAA. Nossos resultados demonstram, portanto, que Acinetobacter spp. isolados de alimentos podem ser tolerantes às concentrações recomendadas de PAA, o que representa um risco à saúde dos consumidores.
Palavras–chave: Acinetobacter spp., ácido peracético, alimentos, sanitizantes.
Abstract: Acinetobacter spp. are extremely relevant bacteria in clinical settings. Recently, they have emerged as potential food-borne opportunistic pathogens. Studies on the tolerance of Acinetobacter spp. products to sanitizers used in the food industry and households are needed to help mitigate food contamination by these microorganisms. In this work, isolates from ready-to-eat salads (n = 11) and from raw goat’s milk (n = 4) were evaluated for tolerance to peracetic acid (PAA). The Food and Drug Administration (FDA) recommends that the concentration of this sanitizer in food processing equipment, utensils and other food contact articles not exceed 200 parts per million (ppm). Only three salad isolates and the four goat milk isolates were inhibited by minimum inhibitory (MIC) and bactericidal (MBC) concentrations below 200 ppm of PAA. Our results demonstrate, therefore, that Acinetobacter spp. isolated from foods may be tolerant to recommended concentrations of PAA, which poses a risk to the health of consumers.
Keywords: Acinetobacter spp., peracetic acid, food, sanitizers.
INTRODUÇÃO
As mudanças no estilo de vida fizeram com que alguns alimentos se tornassem muito populares por serem frescos, saudáveis, práticos e sem aditivos. Como exemplos desses alimentos podem ser citados os estão os prontos para o consumo, frescos, crus e minimamente processados. No entanto, esses produtos, apesar de serem considerados saudáveis, podem ter alguns perigos ocultos. Alimentos frescos podem ser considerados de alto risco do ponto de vista microbiológico, uma vez que são consumidos de maneira direta, ou seja, sem que passem por qualquer processo de inativação microbiana. Evidência disto é o aumento do número de surtos de doenças associadas ao consumo desses alimentos (1,2). Produtos frescos e crus, como leite, ou produtos minimamente processados, como saladas prontas, podem ser fontes de Acinetobacter spp.
Acinetobacter baumannii é um patógeno classificado como uma ameaça urgente pelo Centro de Controle e Prevenção de Doenças (CDC), principalmente por conta de sua resistência a vários antibióticos (3). A maioria das infecções por A. baumannii são causadas por cepas resistentes a múltiplos antibióticos (MDR, “multidrug-resistant”); este fato dificulta no tratamento adequado e muitas vezes resulta em surtos hospitalares. Outro fato ainda mais relevante é que A. baumannii pode sobreviver em diferentes ambientes e condições adversas, incluindo longos períodos em superfícies (4). Portanto, é importante que o processo de descontaminação dessas superfícies aconteça de adequadamente para que a propagação dessas bactérias seja evitada.
Acinetobacter spp. não são apenas uma preocupação em ambientes clínicos. A presença dessas bactérias em indústrias e outros ambientes que produzem ou processam alimentos é uma preocupação. Cepas patogênicas resistentes a múltiplos antibióticos foram isoladas de diferentes amostras de alimentos e alguns estudos têm mostrado que os alimentos podem atuar como um vetor para a transmissão dessas bactérias aos consumidores (5-10).
Agentes sanitizantes são usados em hospitais e indústrias envolvidas com a produção, preparação e distribuição de alimentos (11). No entanto, diversos isolados de A. baumannii são resistentes a alguns desses agentes, contribuindo ainda mais para sua capacidade de sobreviverem em superfícies mesmo após os processos de higienização e se difundirem por meio de alimentos (4).
A eficiência dos sanitizantes utilizados para a eliminação desses microrganismos na indústria de alimentos e no ambiente doméstico precisa ser validada para garantir que esses agentes, nas concentrações recomendadas, sejam eficazes contra Acinetobacter spp. Neste estudo, a tolerância de Acinetobacter spp. isolados de leite cru de cabra e saladas prontas ao ácido peracético, sanitizante geralmente utilizado no processo de higienização de áreas de preparação de alimentos, foi avaliada.
MATERIAL E MÉTODOS
Isolados de Acinetobacter spp.
Os isolados foram identificados por espectrometria de massa com ionização por dessorção a laser assistida por matriz (MALDI-TOF) em estudos anteriores realizados no Instituto Federal do Rio de Janeiro (IFRJ) (12) e Universidade Federal Fluminense (UFF) (13) e foram obtidos de leite de cabra cru (4 isolados: 1708, 2017, 2008,1715) e de saladas prontas para consumo (11 isolados: F4R15/7, F3R18/7, F4R15/6, F5R14/3, F3R12/7, F1R13/7, F3R13/1, F1R13/6, F2R21, F2R13/7 e F4R15/3). As espécies identificadas estão apresentadas na Figura 1. Os isolados foram ativados a partir de estoques congelados a -20°C por meio de inoculação em placas contendo ágar Casoy. As placas foram incubadas a 37ºC por 18 a 24h.
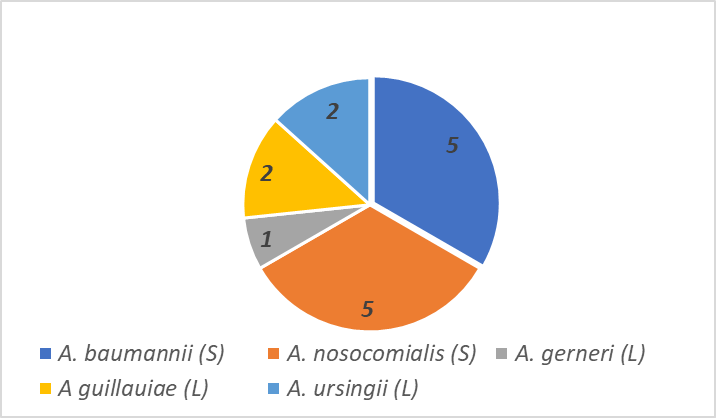
Figura 1 – Identificação dos isolados de Acinetobacter spp. utilizados neste trabalho. S, isolados provenientes de saladas prontas para consumo; L, isolados provenientes de leite de cabra cru.
Determinação da concentração inibitória mínima (MIC)
As concentrações inibitórias mínimas (MIC) de ácido peracético (PAA) foram determinadas pelo método de microdiluição em caldo em placas de microtitulação de poliestireno de 96 poços, conforme descrito por Obe e colaboradores (14), com pequenas alterações. Colônias de cada isolado de Acinetobacter spp., obtidas por isolamento em uma placa de ágar Casoy, foram inoculadas em 10 mL de solução salina a 0,85% (p/v) até a obtenção de turvação equivalente à escala 0,5 de McFarland (aproximadamente 1,5 x 108 UFC/mL). Um volume de 200 µL do sanitizante a ser testado foi adicionado ao primeiro poço das placas de microtitulação e 100 µL de caldo Casoy foi adicionado aos poços restantes na mesma linha. O sanitizante foi diluído transferindo-se 100 µL do primeiro poço até o último poço. Em seguida, 100 µL do inóculo preparado com os isolados bacterianos foram adicionados a cada poço, perfazendo o volume final, em cada poço, de 200 µL e a concentração de aproximadamente 106 UFC por poço (confirmada por plaqueamento). A concentração final de sanitizantes nos poços foi 1,9–1.000 ppm para PAA (PERAX RIO, Rioquímica, São Paulo, Brasil). A MIC foi determinada como a menor concentração do sanitizante que inibiu o crescimento de cada isolado de Acinetobacter spp. O experimento foi repetido três vezes para cada isolado. Poços de controle positivo contendo 100 µL de caldo adicionados de 100 µL do inóculo bacteriano e poços de controle negativo contendo 200 µL de caldo TSB foram incluídos antes da incubação da placa a 37°C por 24 h. Após a incubação, o crescimento bacteriano foi determinado de forma visual, com base na turbidez. A CMI foi determinada como sendo a concentração mais baixa do sanitizante que inibiu o crescimento de cada isolado de Acinetobacter sp. O experimento foi repetido três vezes para cada isolado.
Determinação da concentração bactericida mínima (MBC)
A MBC foi determinada conforme descrito por Haubert e colaboradores (15). O MBC foi avaliado a partir de poços sem crescimento bacteriano visível, conforme obtido no experimento anterior. Alíquotas de 100 μL foram cultivadas em placas de ágar TSA (Himedia, São Paulo, Brasil) e incubadas a 37 °C por 24 horas. Após a incubação, as colônias foram contadas. A MBC foi definida como a menor concentração de desinfetante na qual 99,9% das células foram mortas. Três experimentos independentes foram conduzidos para cada isolado.
RESULTADOS E DISCUSSÃO
O PAA é comumente utilizado como substituto de compostos à base de cloro em processos de desinfecção e foi aprovado pelo FDA para uso na indústria de alimentos (16, 17). O risco de desenvolvimento de tolerância ou resistência a esse agente é considerado muito baixo devido à baixa especificidade das reações do PAA. Este agente funciona desnaturando proteínas, quebrando a permeabilidade da parede celular e oxidando sulfidrila e ligações de enxofre em proteínas, enzimas e outros metabólitos. Também induz a formação e acúmulo de radicais hidroxila na célula bacteriana, que são letais (18,19).
A MIC de oito (71,7%) dos 11 isolados de saladas prontas para PAA foi ≥ 250 ppm (Tabela 1). O MIC e MBC dos isolados de leite cru estavam entre 31,2-62,5 ppm.
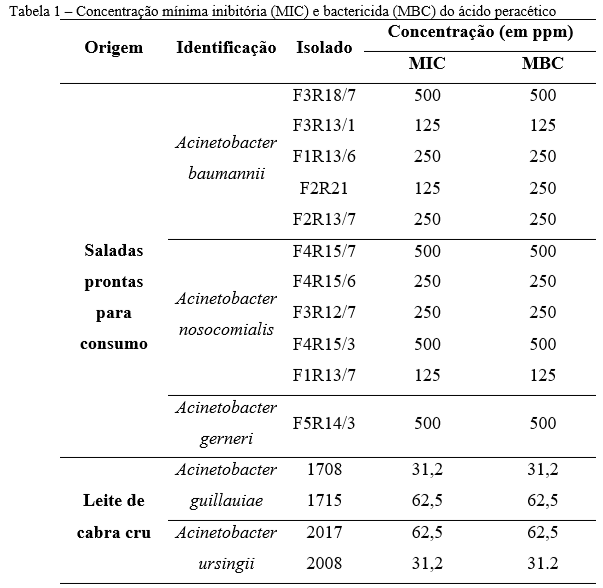
Nossos resultados mostraram que, no caso do PAA, os valores de MIC e MBC dos isolados de leite de cabra cru foram menores do que os isolados de saladas e ficaram abaixo da concentração recomendada pelo FDA (> 100 ppm e < 200 ppm). No entanto, a MIC para oito (71,7%) dos 11 isolados de saladas prontas foi maior ou igual a 250 ppm, sugerindo que o PAA na concentração recomendada não seria eficaz para a inibição desses isolados. Compreender a concentração efetiva de um agente sanitizante é de extrema importância, pois pode prevenir a propagação de bactérias através dos alimentos e sua permanência em superfícies por meio de biofilmes. Já foi descrito, inclusive, surtos em ambiente hospitalar, onde concentrações inadequadas de hipoclorito de sódio foram utilizadas para desinfecção e resultaram na disseminação de uma cepa de A. baumannii resistente a imipenem (IRAB) na unidade de terapia intensiva. Os autores verificaram que apenas concentrações de 5.000 ppm de NaClO fora capazes de controlar e erradicar o surto de IRAB (20).
CONCLUSÕES
Procedimentos eficientes de desinfecção são fundamentais para a prevenção e eliminação de patógenos em instalações agrícolas, saúde, indústria alimentícia e residências. Nossos resultados demonstraram que mesmo Acinetobacter spp. isolados de alimentos podem ser tolerantes às concentrações recomendadas de PAA, amplamente utilizadas na indústria de alimentos e residências.
Ababneh e colaboradores (21) também apontam que os consumidores também devem fazer sua parte para se proteger desse tipo de contaminação, garantindo que seus alimentos frescos sejam lavados e cozidos adequadamente antes de serem consumidos. Conforme apontado por Lee e colaboradores, é necessária a aplicação correta de ferramentas como o procedimento operacional padrão de saneamento e análise de perigos de pontos críticos de controle (22). Essas ferramentas, aliadas à inspeção completa e periódica de equipamentos e utensílios, são fundamentais para a prevenção da formação de biofilme em ambientes de processamento de alimentos.
REFERÊNCIAS
1. Callejón RM, Rodríguez-Naranjo MI, Ubeda C, Hornedo-Ortega R, Garcia-Parrilla MC, Troncoso AM. Reported foodborne outbreaks due to fresh produce in the United States and European Union: trends and causes. Foodborne Pathog Dis. 2015; 12: 32-38.
2. Castro-Ibáñez I, Gil MI, Allende A. Ready-to-eat vegetables: current problems and potential solutions to reduce microbial risk in the production chain. LWT-Food Sci Technol. 2017; 85: 284-292.
3. CDC – Centers for Disease Control and Prevention. AR threats report in: antibiotic/antimicrobial resistance (AR/AMR) [Internet]. 2019 [Acesso em: 2022 jul 10]. Disponível em: https://wwwcdcgov/drugresistance/biggest-threatshtml.
4. Betchen M, Giovinco HM, Curry M, Luu J, Fraimow H, Carabetta VJ, Nahra R. Evaluating the effectiveness of hospital antiseptics on multidrug-resistant Acinetobacter baumannii: understanding the relationship between microbicide and antibiotic resistance. Antibiotics. 2022; 11: 614.
5. Araújo BC, Moraes MS, Costa LEO, Nascimento JS. Multidrug-resistant Acinetobacter baumannii–calcoaceticus complex isolated from infant milk formula and utensils in a nursery in Rio de Janeiro, Brazil. J Dairy Sci. 2015; 98: 2303–2306.
6. Amorim AMB, Nascimento JS. Acinetobacter: an underrated foodborne pathogen? J Infect Dev Ctries. 2017; 11: 111-114. doi: 10.3855/jidc.8418.
7. Zekar FM, Granier SA, Marault M, Yaici L, Gassilloud B, Manceau C, Touati A, Millemann Y. From farms to markets: Gram-negative bacteria resistant to third-generation cephalosporins in fruits and vegetables in a region of North Africa. Front Microbiol. 2017; 8: 1569.
8. Carvalheira A, Silva J, Teixeira P. Lettuce and fruits as a source of multidrug resistant Acinetobacter spp. Food Microbiol. 2017; 64: 119–125.
9. Malta RCR, Ramos GLPA, Nascimento JS. From food to hospital: we need to talk about Acinetobacter spp. Germs. 2020; 10: 210-217.
10. Malta RCR, Cruz CHS, Santos JB, Ramos GLPA, Nascimento JS. Acinetobacter in food: an overwiew. 1. ed. Paraná: Atena Editora. 2020; 66 p.
11. Butucel E, Balta I, Ahmadi M, Dumitrescu G, Morariu F, Pet I, Stef L, Corcionivoschi N. Biocides as biomedicines against foodborne pathogenic bacteria. Biomedicines. 2022; 10: 379.
12. Ramos GLPA, Nascimento JS. Characterization of Acinetobacter spp. from raw goat Milk. Ciênc Rural. 2019; 49: e20190404.
13. Beltrão JC. Evaluation of the microbiological quality of ready-to-eat raw vegetable salads and identification of the antibiotic resistance profile of isolated enterobacteria [dissertação]. Niterói: Science Program Applied to Health Products, UFF; 2019
14. Obe T, Nannapaneni R, Schilling W, Zhang L, Kiess A. Antimicrobial tolerance biofilm formation and molecular characterization of Salmonella isolates from poultry processing equipment. J Appl Poult Res. 2021; 30: 100195.
15. Haubert L, Maia DSV, Rauber-Würfel SDF, Vaniel C, Silva WP. Virulence genes and sanitizers resistance in Salmonella isolates from eggs in southern Brazil. J Food Sci Technol. 2022; 59: 1097–1103.
16. Food and Drug Administration (FDA). Code of Federal Regulations. Title 21, v. 3, 21CFR178.1010, Part 178: Indirect food additives: adjuvants, production aids, and sanitizers. Subpart B: Substances utilized to control the growth of microorganisms. Sec. 178.1010, sanitizing solutions [Internet]. 2019 [Acesso em 2022 ago 04]. Disponível em: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?fr=178.1010.
17. Pironti C, Dell’Annunziata F, Giugliano R, Folliero V, Galdiero M, Ricciardi M, Mott O, Proto A, Franci G. Comparative analysis of peracetic acid (PAA) and permaleic acid (PMA) in disinfection processes. Sci Total Environ. 2021; 797: 149206.
18. European Chemicals Agency (ECHA). Opinion on the application for approval of the active substance: peracetic acid. Product-type: 2. ECHA/BPC/068/2015 [Internet]. 2015 [Acesso em 2022 jul 12]. Disponível em: https://echa.europa.eu/documents/10162/e10165ca10148f10165-10168c10158-10164baf-10168ced-10162ece65470ffa.
19. Kampf G. Peracetic acid. In Antiseptic stewardship. Springer Nature Switzerland, Gewerbestrasse, Cham, Switzerland. 2018; 63-98.
20. Liu WL, Liang HW, Lee MF, Lin HL, Lin YH, Chen CC, Chang PC, Lai CC, Chuang YC, Tang HJ. The impact of inadequate terminal disinfection on an outbreak of imipenem-resistant Acinetobacter baumannii in an intensive care unit. PLoS One. 2014; 9: e107975
21. Ababneh Q, Al-Rousan E, Jaradat, Z. Fresh produce as a potential vehicle for transmission of Acinetobacter baumannii. Int J Food Contam. 2022; 9: 5.
22. Lee SHI, Portinari MRP, Corassin CH, Oliveira CAF. Biofilms from pathogenic bacteria in food processing environments: formation and preventive disinfection procedures. Food Sci Eng. 2022; 3: 12-19.
