
MÉTODOS QUÍMICOS DE MICROENCAPSULAÇÃO DE ÓLEOS ESSENCIAIS PARA ADIÇÃO EM REVESTIMENTOS EM FRUTAS E VEGETAIS: REVISÃO DE LITERATURA
Capítulo de livro publicado no livro do I Congresso Latino-Americano de Segurança de Alimentos. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/08082023-03
Este trabalho foi escrito por:
Vanessa Caroline de Oliveira *; Nataly de Almeida Costa ; Maria José do Amaral e Paiva ; Isabela Soares Magalhães Daniele Juliana Rodrigues Gonçalves Érica Nascif Rufino Vieira ; Fabrícia Queiroz Mendes
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: Frutas e vegetais frescos são um dos grupos alimentares mais procurados em todo o mundo pra quem quer manter um estilo de vida saudável devido aos seus altos valores nutricionais e sabores desejáveis. Apesar disso, esses alimentos são suscetíveis a vários problemas de qualidade pós-colheita, como perda de peso, amadurecimento excessivo, podridão, e fragilidade a distúrbios fisiológicos. As pesquisas apresentadas nesta revisão, buscaram melhorar a capacidade de armazenamento e o prolongamento da vida útil dos frutos com foco em aplicação de revestimentos adicionados de óleos essenciais (OEs) microencapsulados. Os OEs são compostos de substâncias orgânicas voláteis e semivoláteis, apresentando características de instabilidade e facilidade de degradação se forem expostos aos fatores externos como o calor, luz e oxidação. A microencapsulação de OEs por métodos químicos (nanoemulsão/emulsão, gelificação iônica, coacervação complexa e por lipossomas) apresentam uma alta eficiência e maior biodisponibilidade, prevenindo a exposição dos OES e preservando seus compostos bioativos, criando uma barreira física, mas facilitando a sua liberação controlada quando são adicionados nos revestimentos. Pesquisas demonstraram potencial para utilização de OEs microencapsulados em revestimentos para controlar a incidência de infecção por diversos tipos de microrganismos, frutos revestidos tiveram pontuações mais altas em análises sensoriais, a perda de peso e alteração na textura foram diminuídos, uma melhor retenção de cor foi observada e uma menor taxa respiratória nos frutos tratados. São boas as perspectivas futuras para a aplicação de revestimento adicionados de OEs microencapsulados em frutas e vegetais sendo alternativas para melhorar a qualidade dos frutos.
Palavras–chave: conservação, processos químicos, micropartículas, OEs, pós-colheita
Abstract: Fresh fruits and vegetables are one of the most sought-after food groups worldwide for those who want to maintain a healthy lifestyle due to their high nutritional values and desirable flavors. Despite this, these foods are susceptible to various postharvest quality problems, such as weight loss, overripeness, rot, and fragility to physiological disorders. The research presented in this review sought to improve the storage capacity and extend the shelf life of fruits with a focus on the application of coatings added with microencapsulated essential oils (OEs). EOs are composed of volatile and semi-volatile organic substances, presenting characteristics of instability and ease of degradation if exposed to external factors such as heat, light, and oxidation. The microencapsulation of EOs by chemical methods (nanoemulsion, ionic gelation, complex coacervation, and by liposomes) presents a high efficiency and greater bioavailability, preventing the exposure of the EOs and preserving their bioactive compounds, creating a physical barrier, but facilitating their controlled release when are added to coatings. Research has shown potential for using microencapsulated EOs in coatings to control the incidence of infection by various types of microorganisms, coated fruits scored higher in sensory analyses, weight loss and change in texture was decreased, better color retention was observed, and a lower respiratory rate in treated fruits. The future perspectives for the application of coatings added with microencapsulated EOs in fruits and vegetables are good, being alternatives to improve the quality of the fruits.
Keywords: conservation; chemical methods; microparticles; OEs; postharvest
INTRODUÇÃO
Os óleos essenciais (OEs) são líquidos, aromáticos e podem ser sintetizados por todas as partes da planta, como por exemplo, em flores, brotos, folhas, galhos, caules, frutos, sementes, raízes, cascas ou madeira, sendo armazenados em células secretoras, cavidades, canais, em células da epiderme ou tricomas glandulares (1, 2). São extraídos por meio de vapor ou destilação (3). Segundo a Resolução – RDC nº 2, de 15 de janeiro de 2007 (4), os OEs são considerados produtos voláteis de origem vegetal obtidos por processo físico (destilação por arraste com vapor de água, destilação a pressão reduzida ou outro método adequado). Os OEs são caracterizados também como misturas complexas de substâncias de baixo peso molecular. Apresentam características de alta volatilidade e responsáveis por sabores, aromas e várias atividades biológicas como antifúngica, antimicrobiana, inseticida e outras (5).
A Food and Drug Administration (FDA) considera os OEs e seus constituintes bioativos como Geralmente Reconhecido como Seguro (GRAS), como soluções ecológicas e naturais, com características antioxidantes, não deixando resíduos em produtos, como os alimentos frescos (6,7,8).
Algumas limitações são observadas para a utilização de OEs em alimentos, devido aos fortes sabores pertencentes a essas substâncias, que na sua maioria, são ricas em terpenos e outros compostos. Essa limitação tem que ser levada em consideração ao uso de quantidades desses OEs, pois elevadas quantidades podem ser necessárias para aumentar a eficácia antimicrobiana, mas podem gerar problemas em relação ao limite sensorial para os consumidores (9). Dessa maneira, a técnica de microencapsulação estabelece um equilíbrio para as variáveis de eficiência nos efeitos antimicrobianos e nas características sensoriais (10).
A incorporação de OEs em revestimentos podem ser uma alternativa para controle de podridões, mas seu impacto na fitotoxicidade tem que ser avaliado. Quando são incorporados aos revestimentos, a cinética de liberação do princípio ativo é modulada. Uma maior concentração do agente antimicrobiano é mantida na superfície da fruta por mais tempo, inibindo também a fitotoxicidade ao impedir contato direto do OE com a casca do fruto pela técnica de microencapsulação (11). Altas perdas de óleo essencial foram observadas, durante a secagem das emulsões aquosas que formam os filmes, onde a emulsão foi desestabilizada e houve a evaporação do OE por arraste de vapor na superfície do filme (12). Essas perdas foram diminuídas com a microencapsulação em substâncias anfifílicas, utilizando lecitina, que aprisionaram os compostos dos OEs em estruturas de lipossomas (13,14).
Microencapsulação
Os processos de microencapsulamento de OEs abrangem várias áreas das ciências, envolvendo a físico-química, a química coloidal, química de polímeros e materiais e tecnologias de suspensão e secagem (15, 16). Com o surgimento e aprimoramento de várias técnicas de microencapsulamento ao longo do tempo, o encapsulamento foi definido em métodos químicos e físicos (17, 18, 19, 20). Na Figura 1 estão todos os métodos físicos e químicos utilizados para encapsulação de óleos essenciais.
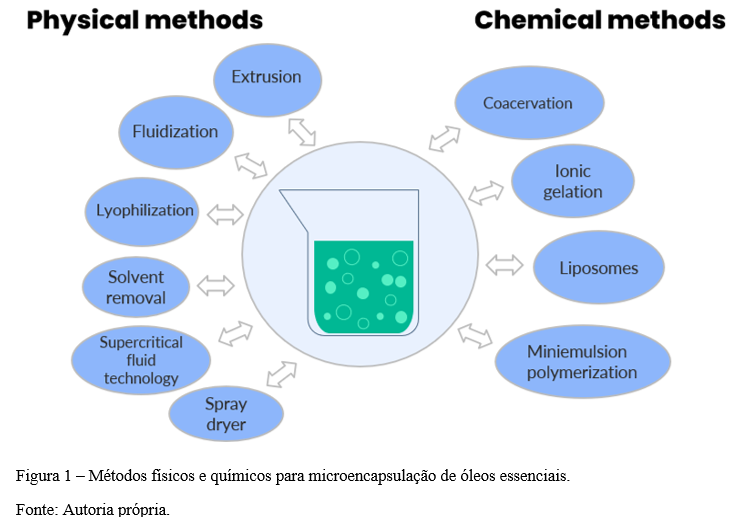
O microencapsulamento de compostos pode ser dividida em três características principais como: (1º) desenvolvimento de uma parede ao redor do núcleo; (2º) os compostos deverão se manter estáveis dentro da cápsula evitando qualquer liberação ou degradação do seu conteúdo; (3º) aplicação das cápsulas na matriz alimentícia e liberação dos componentes do óleo (21).
Nanoemulsão
As nanoemulsões (NEs) são caracterizadas por sistemas de partículas coloidais, compostas por diferentes proporções de óleo, água e surfactante (22). O microencapsulamento de OEs em NEs melhoram a entrega e a estabilidade desses compostos em produtos alimentícios (23) e são resistentes a separação de fases gravitacional e requerem uma clareza óptica (24).
As NEs possuem gotículas de óleo com diâmetro menor que 200 nm (24, 25, 26) e estão dispersas em um meio a base de água. A técnica de NEs melhora a atividade antioxidante, propriedades antibacterianas, biodisponibilidade e estabilidade físico-química dos OEs (25,26). A atividade antimicrobiana das NEs se devem ao tamanho nano que aumenta a área de superfície ativa. Sua atividade se torna superior do que as emulsões convencionais com tamanho de gota significativamente maior (27).
A preparação de NEs pode ser realizada usando técnicas de alta energia como microfluidização, homogeneização de válvula de alta pressão, homogeneização de alto cisalhamento e sonicação. Técnicas de baixa energia podem ser aplicados também, como métodos de emulsificação e inversão de fase, manipulando a tensão interfacial (24; 28). Técnicas de alta energia geram forças intensas disruptivas que quebram mecanicamente a fase oleosa em minúsculas gotículas que são dispersas na fase aquosa. Essas técnicas podem sofrer limitações para produzir emulsões ultrafinas, dependendo de equipamentos iniciais e custos operacionais elevados (24), as técnicas de alta energia apresentam maior potencial para quebrar as fases dispersas e retê-las em pequenas gotículas (29).
É preciso obter um equilíbrio hidrofílico-lipófilo com uma formulação correta de óleo e surfactantes na fase aquosa. Esse equilíbrio pode ser manipulado para que as fases hidrofílico-lipófilo fiquem próximas umas das outras para redução da tensão superficial, permitindo a autoemulsificação da fase oleosa como nanoemulsões (30). A escolha do surfactante também interfere na eficiência da NEs. Um surfactante hidrofílico e o co-surfactante são considerados por atrair a interface e diminuir a energia necessária para formar NEs, podendo melhorar a estabilidade (31). Liu et al. (32) observaram que o desempenho dos surfactantes mistos era superior quando se utilizou surfactantes individuais, onde o tamanho médio da gota da nanoemulsão foi de 100 nm, não foi observado alteração no seu tamanho após armazenamento a frio/quente, e o índice de polidispersante quase não teve flutuação.
Para caracterização das NEs pesquisas realizam várias análises como: tamanho da partícula; propriedades físicas (pH, densidade, viscosidade, cor); eficiência de microencapsulamento; porcentagem de separação de fase; atividade bacteriana; índice de refração; turbidez; estabilidade da emulsão (tamanho médio das gotas, índice de polidispersão, potencial zeta e pH ao longo do armazenamento/dias) (33, 34, 27). Para avaliar a estabilidade da emulsão carregadas com os OEs foram observados os efeitos do pH, efeito da força iônica, efeito do tratamento térmico e estabilidade no armazenamento (observou-se instabilidade visual como separação de fases ou floculação ou formação de creme) e a estabilidade cinética (27).
Gelificação iônica
A gelificação iônica é uma das técnicas de microencapsulamento de OEs. No geral, essa metodologia é amplamente usada devido a sua grande adaptabilidade a diferentes tipos de princípios ativos e principalmente de baixo custo (35, 36). Essa técnica baseia-se em pingar uma solução polimérica aniônica contendo os nutrientes/composto ativo isolados ou emulsionados em uma solução iônica para a formação de um complexo (37). Ou seja, é um processo que consiste em interações iônicas entre polímeros de cargas opostas (38), ou entre um polímero e um policátion ou poliânios (39). Essa técnica é recomendada para compostos bioativos hidrofóbicos (40) como os óleos essenciais.
Quando ocorre uma gelificação iônica-emulsão, o coagulante é adicionado ao material, assim as microcápsulas são formadas por coagulação iônica da mistura de duas fases. Quando o material do núcleo das microcápsulas é a fase oleosa, como no caso dos óleos essenciais, a adição de emulsificante pode ajudar a afetar a distribuição de partículas na emulsão contendo as microcápsulas, produzindo com alta qualidade (41, 42). Os materiais de revestimento mais utilizados são a quitosana e o alginato (43, 44).
Essa técnica apresenta reticulação física reversível por interações eletrostáticas, podendo eliminar o uso de solventes orgânicos que diminui a possibilidade de toxicidade de reagentes químicos e outros possíveis efeitos que não são desejáveis em sistemas alimentares (45). Também não requer alta energia, utilização de/ou tecnologias muito complicadas (46,47).
Para avaliar o microencapsulamento por gelificação iônica são realizadas várias análises como: tamanho da partícula; dispersão dinâmica de luz (DLS); movimento eletroforético (ζ); eficiência de Encapsulamento (EE); cinética de liberação; microscopia eletrônica de varredura (MEV); calorimetria de varredura diferencial (DSC); espectroscopia de infravermelho (IR); refletância difusa; capacidade antioxidante; conteúdo de óleo essencial (48).
Lipossomas
A técnica de microencapsulamento por lipossoma produz pequenas vesículas geradas pela dispersão de fosfolipídios no meio aquosa, aprisionando o meio aquoso entre suas esferas concêntricas fechadas por uma ou mais bicamadas fosfolipídicas, sendo as camadas externas hidrofóbicas (49, 50, 51, 52).
O mecanismo de formação dos lipossomas compreende basicamente na ausência de atração entre os fosfolipídios e as moléculas de água: os grupos das cabeças polares dos fosfolipídios são expostos às fases aquosas (camada interna e externa) e as caudas de hidrocarbonetos hidrofóbicos são forçadas a se enfrentar, formando uma bicamada (53).
Os lipossomas podem carrear compostos hidrofílicos e lipofílicos (54). As vesículas fosfolipídicas, formadas pela técnica de lipossomas, aumentam a penetração de compostos nelas incorporados e/ou encapsulados, biocompatibilidade, biodisponibilidade e liberação sustentada (55,56).
Essa técnica de microencapsulação é indicada para aplicações alimentícias, apresentando alta viabilidade no encapsulamento de aminoácidos, vitaminas, corantes, enzimas, minerais, microrganismos, ácidos graxos e principalmente OEs (57, 58, 59). Pesquisas recentes têm apresentado novas perspectivas de aplicações de óleos essenciais microencapsulados por lipossomas compostos por lipídios e colesterol (60).
Para caracterização dos lipossomas microencapsulados com OEs, são realizadas análises de: morfologia, tamanho de partícula, estabilidade, eficiência de encapsulação, ensaio antimicrobiano in vitro (61).
Coacervação complexa
A coacervação complexa é uma técnica de separação de fases que consiste em três etapas básicas: emulsificação, coacervação e reticulação (62). Geralmente dois ou mais polímeros com cargas opostas formam coacervados por meio de interação ou complexação que é impulsionada pela interação eletrostática sob condições adequadas (63). O processo é geralmente realizado usando polissacarídeos aniônicos e proteínas carregadas positivamente (64). Outra definição desse processo se refere a fase líquida que é rica em um colóide e se separa de uma solução devido à redução da solubilidade por meios físicos ou químicos. A nova fase formada aparece na estrutura de gotículas líquidas, que eventualmente coalescem, onde há a precipitação de uma camada contínua com formação da parede da cápsula. No final do processo, a parede das cápsulas endurecem e são isoladas (65, 66, 67).
Para caracterização das cápsulas de coacervados são realizadas algumas análises como: eficiência de microencapsulamento; rendimento; morfologia; distribuição de tamanho; medição de espectroscopia de infravermelho com transformada de Fourier (FTIR), espectroscopia de fluorescência, calorimetria diferencial de varredura (DSC), estabilidade térmica e de pH, estabilidade de armazenamento e atividade de eliminação de radicais DPPH (64).
Revestimentos
Após a colheita, os frutos frescos são propícios a sofrerem alterações fisiológicas e bioquímicas que causam alterações prejudiciais na qualidade e na vida útil dos mesmos. A respiração, a transpiração e a produção de etileno são os principais fatores que contribuem para a deterioração de frutas e vegetais (68). O etileno é um hormônio produzido por frutas climatéricas, ou quando as frutas sofrem estresse, e é parcialmente responsável por alterações no sabor, cor e textura de frutas e vegetais. Além disso, frutas e vegetais frescos perdem água durante o armazenamento devido a processos respiratórios e de transpiração (69).
O estresse hídrico também causa alterações metabólicas e alterações na atividade enzimática, causando senescência acelerada, declínio no valor nutricional e aumento da suscetibilidade a danos causados pelo frio e infestação de patógenos. A respiração celular consiste na quebra oxidativa das reservas orgânicas em moléculas mais simples, incluindo dióxido de carbono (CO2) e água, com liberação de energia (70).
Um método econômico, conveniente e seguro para manter a qualidade e estender a vida útil de frutas e vegetais frescos são os revestimentos (71, 72).
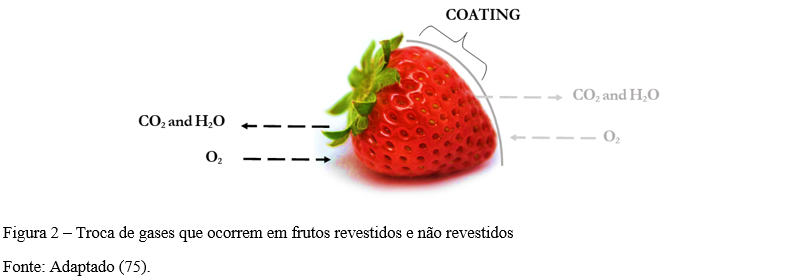
Os revestimentos podem formar uma barreira para perda de água e respiração, eles diminuem a saída de CO2 e H2O e a entrada de O2 nos frutos. É importante ressaltar que o revestimento na epiderme do fruto, tem que construir uma barreira que não seja totalmente impermeável, que ocorra a troca de gases de maneira mais lenta. Caso o revestimento comprometa completamente a troca pode haver fermentação do fruto.
Os revestimentos tem características não apenas de manter os produtos frescos, mas também podem garantir a qualidade e a segurança dos produtos, evitando a contaminação e deterioração microbiana (73, 74).
A Figura 2 representa a velocidade dessa troca de gases que ocorre em frutos revestidos e não revestidos, na parte esquerda observa-se o fruto sem revestimento, onde a troca de gases e perda água ocorre na velocidade normal, na parte direita o fruto foi revestido e a troca de gases e perda de água ocorre de maneira diminuída, favorecendo a manutenção e prolongamento da vida útil dos frutos.
Os OEs podem ser incorporados na composição dos revestimentos (76) devido a todas suas propriedades antimicrobianas e outros, pesquisadores recomendam o microenpsulamento para menor perda dos compostos voláteis durante o revestimento e armazenamento. Na Tabela 1 estão apresentados pesquisas que microencapsularam óleos essenciais por métodos químicos e incorporaram nos revestimentos.




Quando os frutos são colhidos, eles consomem de maneira contínua seus próprios nutrientes devido à respiração e perdem continuamente água devido à transpiração. Essas características, juntamente com a ausência de água externa, fazem com que os frutos murchem naturalmente, resultando em senescência do tecido e diminuição do frescor (89) e consequentemente perda de peso. Pesquisadores observaram que com o revestimento a perda de peso dos frutos foi significantemente menor em comparação com frutos não revestidos (79,80,81,88). Os revestimentos utilizados nos trabalhos combinaram propriedades de alta barreira com propriedades antibacterianas dos OEs, o que pode ter reduzido a volatilização do vapor de água enquanto houve redução da concentração de O2 na superfície dos tecidos, havendo inibição das atividades enzimáticas e diminuindo as taxas respiratórias (80). Para a grande maioria dos frutos frescos, a perda de massa fresca que é permitida para evitar o murchamento ou enrugamento da superfície do tecido do fruto pode ocorrer entre 5 e 10% dependendo da espécie (90).
A taxa de respiração é uma importante característica de maturidade dos frutos. Quanto maior a taxa de respiração, mais rápida a taxa de reação redox em frutas e vegetais – ou seja, mais rápido os nutrientes orgânicos são consumidos. Em frutos climatéricos, a sua maturidade tende a aumentar significativamente após o pico da respiração. Se esse pico puder ser adiado, o ciclo de armazenamento dos frutos podem ser prolongado (80,92). Os revestimentos são eficazes para diminuir o processo respiratório nos frutos, tendo efeito altamente significativo. Esse efeito pode ser atribuído à redução das trocas gasosas entre o meio e os frutos revestidos (91). Uma diminuição na taxa de respiração de frutos revestidos foi observada (80,81,82) o prolongamento do pico climatérico, aumentando o tempo de armazenamento e qualidade dos frutos (91).
O uso extensivo de agroquímicos para controlar doenças em plantas e frutos causa prejuízos ao meio ambiente e pode haver seleção de espécies de fungos com resistência a fungicidas. Pesquisas vem mostrando o interesse por tecnologias alternativas de controle, como controle biológico e a indução de resistência em plantas com a utilização de extratos vegetais e OEs e outros (93). O mecanismo de ação dos OEs se deve a sua composição complexa e sua interação entre os componentes principais e secundários de cada OE e a natureza da bactéria (94,95,96). Os mecanismos relacionados a atividade antimicrobiana dos OEs são vários e foram descobertos ao longo dos anos. Um deles propõe que a natureza lipofílica dos OEs pode romper a estrutura da parede celular e provocar a disfunção celular do microrganismo. Resumindo quando os compostos dos OEs penetram através das membranas das bactérias para o interior da célula, afetam tanto o envelope externo quanto o citoplasma da célula, levando a alterações na composição lipídica da membrana (moléculas de polissacarídeos, bicamadas de fosfolipídios e ácidos graxos), aumentando a permeabilidade da membrana celular bacteriana gerando perda de íons (fosfato, potássio e outros metabólitos) (95,97). Esse mecanismo atinge as atividades celulares vitais como o processamento de nutrientes, o transporte de membrana, a produção de energia, a síntese de componentes estruturais e outras funções que regulam o metabolismo, causando a morte das células (98,99,100).
Em sua pesquisa Sapper et al. (77) observaram que a aplicação do revestimento teve um efeito antifúngico positivo tanto em maçãs (redução significativa na severidade do mofo cinzento) quanto em caquis (redução significativa na incidência de mancha preta), mas esse efeito antifúngico foi mais suave do que o observado em trabalho in vitro com EO incorporado no mesmo tipo de filmes. Apesar dos estudos in vitro, observa-se uma grande variabilidade na eficácia do controle de doenças nos frutos, dependente de inúmeros fatores que influenciam as características antifúngicas de revestimentos com compostos antifúngicos. Os fatores mais importantes observados são: tipo e concentração do (s) composto (s) antifúngico (s); natureza da matriz composta do revestimento; espécie e cepa do patógeno pós-colheita alvo; cultivar, espécie e condição fisiológica do hospedeiro dos frutos e fatores ambientais pós-colheita (101). Arabpoor et al. (79) observaram que a incorporação do Eryngium campestre L na concentração até 0,16% pareceu ter uma mudança estatisticamente insignificante na contagem total, enquanto as cerejas tratadas com concentração de 0,32% tiveram uma redução considerável na população de total bactérias, mantendo-se em torno de 4 log UFC/mL após 21 dias de armazenamento. Esse dado aponta que a concentração do composto antifúngico é um fator importante a ser testado para ter bons resultados. Ferreira et al. (85) também observaram que a concentração do OE interferia na capacidade antibacteriana do filme para morangos frescos em Escherichia coli e Bacillus subtillis. Os filmes mostraram comportamento biológico semelhante para ambas as bactérias, com atividade antimicrobiana somente para 3% de OE. Chen et al. (82) observaram que o filme adicionado de OE puro teve um efeito significativo na inibição de bactérias (Escherichia coli, Staphylococcus aureus, Trichoderma) no estágio inicial de preservação. No entanto, com o passar do tempo, os microrganismos cresceram nas superfícies de frutas e vegetais, e foi necessário estender o tempo de seu efeito inibitório. O OE microencapsulado obteve um efeito inibitório mais prolongado, devido a liberação mais lenta do OE. Basumatary et al. (84) encontraram maior atividade antimicrobiana contra bactérias Gram negativas do que bactérias Gram positivas para as mesmas concentrações de OE de cravo utilizados em revestimentos no abacaxi, devido à dissolução da membrana externa em bactérias Gram negativas por OE resultando em fácil penetração da camada de peptidoglicano que é muito mais espessa em bactérias Gram positivas (102). O OE de cravo exibiu também boa atividade antifúngica contra fungos isolados (84). O revestimento com nanoemulsão OE de cravo e quitosana exibiu a maior atividade antibacteriana contra B. gladioli, indicando que a atividade antibacteriana foi melhor do que a do revestimento somente com OE, e com uma inibição (>85%) contra B. gladioli quando a concentração foi de 1,25 g/L (87).
CONCLUSÕES
Os estudos mostram que os revestimentos enriquecidos com microcápsulas de OEs podem ser alternativas eficazes para melhorar a qualidade dos frutos. Pesquisas demonstraram potencial para utilização de OEs microencapsulados em revestimentos para controlar a incidência de infecção por diversos tipos de microrganismos, frutos revestidos tiveram pontuações mais altas em análises sensoriais, a perda de peso e alteração na textura foram diminuídos, uma melhor retenção de cor foi observada e uma menor taxa respiratória nos frutos tratados. A concentração e material carreador do revestimento pode interferir na eficácia antimicrobiana da tecnologia de revestimento. Assim, a seleção e processamento de matérias-primas para revestimentos devem ser cuidadosamente considerados em trabalhos futuros.
O presente trabalho foi realizado com apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.
REFERÊNCIAS
- Burt S. Essential oils: their antibacterial properties and potential applications in foods – a review. International Journal of Food Microbiology. 2004; 94:223-253.
- Simões CMO, Schenkel EP, Gosman G, Mello JCP, Mentz LA, Petrovick PR. Farmacognosia – Da Planta ao Medicamento. 5. ed. UFRGS/ UFSC; 2004.
- Barbosa, LN. Propriedade antimicrobiana de óleos essenciais de plantas condimentares com potencial de uso como conservante em carne e hambúrguer bovino e testes de aceitação [dissertação]. Botucatu: UNESP; 2010;
- Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução – RDC nº 2, de 15 de janeiro de 2007. Dispõe sobre o regulamento técnico sobre aditivos aromatizantes. Diário Oficial da União, 21 ago 2006.
- Acácio R, Pamphile-Adrian AJ, Florez-Rodriguez PP, Freitas JD de, Goulart HF, Santana, AEG. Dataset of Schinus terebinthifolius essential oil microencapsulated by spray-drying. Data in Brief. 2023; 47:108927.
- Gunny AAN, Fang LP, Misnan NM, Gopinath SC, Salleh NHM, Hashim RHR, Mat MHC. Microwave-assisted solvent-free extraction of essential oil from Coleus aromaticus: anti-phytopathogenic potential for fruit post-harvesting. Biotech. 2021; 11:1-11.
- Basavegowda N, Baek KH. Synergistic Antioxidant and Antibacterial Advantages of Essential Oils for Food Packaging Applications. Biomolecules. 2021; 11:1267.
- Chrysargyris A, Rousos C, Xylia P, Tzortzakis N. Vapour Application of Sage Essential Oil Maintain Tomato Fruit Quality in Breaker and Red Ripening Stages. Plants. 2021; 10:2645.
- Diniz-Silva HT, Sousa JB de, Guedes JDS, Queiroga RCR do E, Madruga MS, Tavares JF, Souza EL de, Magnani M. A synergistic mixture of Origanum vulgare L. and Rosmarinus officinalis L. essential oils to preserve overall quality and control Escherichia coli O157:H7 in fresh cheese during storage. Lwt. 2019; 112:107781.
- Guo Q, Du G, Jia H, Fan Q, Wang Z, Gao Z, Yue T, Yuan Y. Essential oils encapsulated by biopolymers as antimicrobials in fruits and vegetables: A review. Food Bioscience. 2021; 44:101367.
- Sapper M, Bonet M, Chiralt A. Wettability of starch-gellan coatings on fruits, as affected by the incorporation of essential oil and/or surfactants. Lwt. 2019; 116: 108574.
- Perdones A, Chiralt A, Vargas M. Properties of film-forming dispersions and films based on chitosan containing basil or thyme essential oil. Food Hydrocolloids. 2016; 57: 271-279.
- Sapper M, Wilcaso P, Santamarina MP, Roselló J, Chiralt A. Antifungal and functional properties of starch-gellan films containing thyme (Thymus zygis) essential oil. Food Control. 2018; 92:505-515.
- Valencia-Sullca C, Jiménez M, Jiménez A, Atarés L, Vargas M, Chiralt A. Influence of liposome encapsulated essential oils on properties of chitosan films. Polymer International. 2016; 65:979-987.
- Gouin S. Microencapsulation: Industrial appraisal of existing technologies and trends. Trends Food Science Technology. 2004; 15:330-347.
- Martins IM, Barreiro MF, Coelho M, Rodrigues AE. Microencapsulation of essential oils with biodegradable polymeric carriers for cosmetic applications. Chemical Engineering Journal. 2014; 245:191-200.
- Gibbs BF, Kermasha S, Alli I, Mulligan CN. Encapsulation in the food industry: A review. International Journal of Food Science Nutrition. 1999; 50:213-224.
- Kata M, Wayer M, Gyorgy E. Microencapsulation by spray drying. Acta Pharmaceutica Hungarica. 1983; 53:36-43.
- Kuang SS, Oliveira JC, Crean AM. Microencapsulation as a tool for incorporating bioactive ingredients into food. Critical Reviews in Food Science Nutrition. 2010; 50:951-968.
- Tyagi VV, Kaushik SC, Tyagi SK, Akiyama T. Development of phase change materials based microencapsulated technology for buildings: A review. Renewable Sustainable Energy Reviews. 2011; 15:1373-1391.
- Macías-Cortés E, Gallegos-Infante JA, Rocha-Guzmán NE, Moreno-Jiménez MR, Medina-Torres L, González-Laredo RF. Microencapsulation of phenolic compounds: Technologies and novel polymers. Revista Mexicana de Ingeniería Química. 2020; 19: 491-521.
- Ghaderi L, Aliahmadi A, Ebrahimi SN, Rafati H. Effective Inhibition and eradication of Pseudomonas aeruginosa biofilms by Satureja khuzistanica essential oil nanoemulsion. Journal of Drug Delivery Science and Technology. 2021; 61:102260, 2021.
- Patrignani F, Siroli L, Braschi G, Lanciotti R. Combined use of natural antimicrobial based nanoemulsions and ultra high-pressure homogenization to increase safety and shelf-life of apple juice. Food Control. 2019; 111: 107051.
- McClements DJ, Rao J. Food-grade nanoemulsions: formulation, fabrication, properties, performance, biological fate, and potential toxicity. Critical Reviews Food Science and Nutrition. 2011; 51: 285-330.
- Chuesiang P, Sanguandeekul R, Siripatrawan U. Enhancing effect of nanoemulsion on antimicrobial activity of cinnamon essential oil against foodborne pathogens in refrigerated Asian seabass (Lates calcarifer) fillets. Food Control. 2021; 122:107782.
- Rodrigues P, Ferrari FT, Barbosa, LB, Righi A, Laporta L, Garlet QI, Baldisserotto B, Heinzmann BM. Nanoemulsion boosts anesthetic activity and reduces the side effects of Nectandra grandiflora Nees essential oil in fish. Aquaculture. 2021; 545:737146.
- Falleh H, Jemma MB, Neves MA, Isoda H, Nakajima M, Ksouri R. Formulation, physicochemical characterization, and anti- E. coli activity of food-grade nanoemulsions incorporating clove, cinnamon, and lavender essential oils. Food Chemistry. 2021; 359:129963.
- Azmi NAN, Elgharbawy AAM, Motlagh SR, Samsudin N, Salleh HM. Nanoemulsions: factory for food, pharmaceutical and cosmetics. Processes. 2019; 7:617.
- Garavand F, Jalai-Jivan M, Assadpour E, Jafari SM. Encapsulation of phenolic compounds within nano/microemulsion systems: A review. Food Chemistry. 2021; 364: 130376.
- Pouton CW. Lipid formulations for oral administration of drugs: non-emulsifying, self-emulsifying and ‘self-microemulsifying’ drug delivery systems. European Journal Pharmaceutical Sciences. 2000; 11: 93-8.
- Gupta A, Eral HB, Hatton TA, Doyle PS. Nanoemulsions: formation, properties and applications. Soft Matter, vol. 12, p. 2826-2841, 2016.
- Liu X, Chen L, Kang Y, He D, Yang B, Wu K. Cinnamon essential oil nanoemulsions by high-pressure homogenization: Formulation, stability, and antimicrobial activity, LWT. 2021; 147:111660.
- Dávila-Rodriguez M, López-Malo A, Palou E, Ramírez-Corona N, Jiménez-Munguía T. Antimicrobial activity of nanoemulsions of cinnamon, rosemary, and oregano essential oils on fresh celery. LWT; 112:108247, 2019.
- Cossetin LF, Garlet QI, Velho MC, Gündel S, Ourique AF, Heinzmann BM, Monteiro SG. Development of nanoemulsions containing Lavandula dentata or Myristica fragrans essential oils: Influence of temperature and storage period on physical-chemical properties and chemical stability. Industrial Crops and Products. 2021; 160:113115.
- Menin A, Zanoni F, Vakarelova M, Chignola R, Donà G, Rizzi C, Mainente F, Zoccatelli G. Effects of microencapsulation by ionic gelation on the oxidative stability of flaxseed oil. Food Chemistry. 2018; 269: 293-299.
- Cáceres LM, Velasco GA, Dagnino EP, Chamorro ER. Microencapsulation of grapefruit oil with sodium alginate by gelation and ionic extrusion: Optimization and modeling of crosslinking and study of controlled release kinetics. Revista Tecnología y Ciencia. 2020; 41: 41-61.
- Paglione I dos S, Galindo MV, Medeiros JAS de, Yamashita F, Alvim ID, Grosso CRF, Sakanaka LS, Shirai MA. Comparative study of the properties of soy protein concentrate films containing free and encapsulated oregano essential oil. Food Packaging and Shelf Life. 2019; 22: 100419.
- Saravanan M, Rao KP. Pectin-gelatin and alginate-gelatin complex coacervation for controlled drug delivery: Influence of anionic polysaccharides and drugs being encapsulated on physicochemical properties of microcapsules. Carbohydrate Polymers. 2010; 80:808-816.
- De Oliveira EF, Paula HCB, De Paula RCM. Alginate/cashew gum nanoparticles for essential oil encapsulation. Colloids and Surfaces. B, Biointerfaces. 2014; 113: 146-151.
- Ribeiro AJ, Neufeld RJ, Arnaud P, Chaumeil JC. Microencapsulation of lipophilic drugs in chitosan-coated alginate microspheres. International Journal of Pharmaceutics. 1999; 187:115-123.
- Martins IM, Rodrigues SN, Barreiro MF, Rodrigues A. E. Polylactide-based thyme oil microcapsules production: evaluation of surfactants. Industrial & Engineering Chemistry Research. 2010; 50: 898-904.
- Petrovic LB, Sovilj VJ, Katona JM, Milanovic JL. Influence of polymer–surfactant interactions on o/w emulsion properties and microcapsule formation. Journal Colloid Interface Science. 2010; 342:333-339.
- Leong JY, Lam WH, Ho KW, Voo WP, Lee MFX, Lim HP, Lim SL, Tey BT, Poncelet D, Chan ES. Advances in fabricating spherical alginate hydrogels with controlled particle designs by ionotropic gelation as encapsulation systems. Particuology. 2016; 24:44-60.
- Otálora MC, Carriazo JG, Iturriaga L, Osorio C, Nazareno MA. Encapsulating betalains from Opuntia ficus-indica fruits by ionic gelation: Pigment chemical stability during storage of beads. Food Chemistry. 2016; 202:373-382.
- Usmiati S, Richana N, Mangunwidjaja D, Noor E, Prangdimurti E. The Using of Ionic Gelation Method Based on Polysaccharides for Encapsulating the Macromolecules-A Review. International Conference of Food Security and Nutrition. 2014; 67:79-84.
- Gheorghita R, Lobiuc A, Dimian M, Covasa M. Alginate: From food industry to biomedical applications and management of metabolic disorders. Polymers. 2020; 12:2417.
- Pedroso-Santana S, Fleitas-Salazar N. Ionotropic gelation method in the synthesis of nanoparticles/microparticles for biomedical purposes. Polymer International. 2020; 69:443-447.
- González-Reza R, Hernández-Sánchez H, Quintanar-Guerrero D, Alamilla-Beltrán L, Cruz-Narváez Y, Zambrano-Zaragoza ML. Synthesis, Controlled Release, and Stability on Storage of Chitosan-Thyme Essential Oil Nanocapsules for Food Applications. Gels. 2021; 7:212.
- Ge L, Möhwald H, Li J. Phospholipid liposomes stabilized by the coverage of polyelectrolyte. Colloids and Surfaces Physicochemical and Engineering Aspects. 2003; 221:49-53.
- Mehta PP, Ghoshal D, Pawar AP, Kadam SS, Dhapte-Pawar VS. Recent advances in inhalable liposomes for treatment of pulmonary diseases: concept to clinical stance. Journal of Drug Delivery Science and Technology. 2020; 56:101509.
- Nam JH, Kim SY, Seong H. Investigation on physicochemical characteristics of a nanoliposome-based system for dual drug delivery. Nanoscale Research Letters. 2018; 13:101, 2018.
- Mozafari MR, Johnson C, Hatziantoniou S, Demetzos C. Nanoliposomes and their applications in food nanotechnology. Journal of Liposome Research. 2007; 18:309-327.
- Mazur F, Bally M, Städler B, Chandrawati R. Liposomes and lipid bilayers in biosensors. Advances in Colloid and Interface Science. 2017; 249: 88-99.
- Mu LM, Ju RJ, Liu R, Bu YZ, Zhang JY, Li XQ, Zeng F, Lu WL. Dual-functional drug liposomes in treatment of resistant cancers. Advanced Drug Delivery Reviews. 2017; 115:46-56.
- Managit C, Kawakami S, Nishikawa M, Yamashita F, Hashida M. Targeted and sustained drug delivery using PEGylated galactosylated liposomes. International Journal of Pharmaceutics. 2003; 266:77-84.
- Siyadatpanah A, Norouzi R, Mirzaei F, Haghirosadat BF, Nissapatorn V, Mitsuwan W, Nawaz M, Pereira ML, Hosseini SA, Montazeri M, Majdizadeh M, Almeida RS, Hemati M, Wilairatana P, Coutinho HDM. Green synthesis of nano-liposomes containing Bunium persicum and Trachyspermum ammi essential oils against Trichomonas vaginalis. Journal of Microbiology, Immunology and Infection. 2023; 56:150-162.
- Augustin MA, Hemar Y. Nano- and micro-structured assemblies for encapsulation of food ingredients. Chemical Society Review. 2009; 38:902-912.
- Kim HHY, Baianu IC. Novel liposome microencapsulation techniques for food applications. Trends in Food Science and Technology. 1991; 2:55-61.
- Singh H, Thompson A, Liu W, Corredig M. Liposomes as food ingredients and nutraceutical delivery systems. Encapsulation Technologies and Delivery Systems for Food Ingredients and Nutraceuticals. 2012; 24:287-318.
- Hammoud Z, Gharib R, Fourmentin S, Elaissari A, Greige-Gerges H. New findings on the incorporation of essential oil components into liposomes composed of lipoid S100 and cholesterol. International Journal of Pharmaceutics. 2019; 561:161-170.
- Chen P, Ference C, Sun X, Lin Y, Tan L, Zhongm T. Antimicrobial Efficacy of Liposome-Encapsulated Citral and Its Effect on the Shelf Life of Shatangju Mandarin. Journal of Food Protection. 2020; 83:315-1322.
- Madene A, Jacquot M, Scher J, Desobry S. Flavour encapsulation and controlled release – a review. International Journal of Food Science and Technology. 2006; 41:1-21.
- Schmitt C, Turgeon SL. Protein/polysaccharide complexes and coacervates in food systems. Advances in Colloid and Interface Science. 2011; 167:63-70.
- Guo Q, Li S, Du G, Chen H, Yan X, Chang S, Yue T, Yuan Y. Formulation and characterization of microcapsules encapsulating carvacrol using complex coacervation crosslinked with tannic acid. LWT. 2022; 165:113683.
- Azeredo HMC. Encapsulação: aplicação à tecnologia de alimentos. Alimentos e Nutrição. 2005; 16:89-97.
- Nairm JG. Coacervation-phase separation technology. Advances Pharmaceutic Science. 1995; 7: 93-219.
- Timilsena YP, Akanbi TO, Khalid N, Adhikari, B, Barrow CJ. Complex coacervation: Principles, mechanisms and applications in microencapsulation. International Journal of Biological Macromolecules. 2019; 121:1276-1286.
- Olivas G, Barbosa-Cánovas G. Edible films and coatings for fruits and vegetables. In Edible Films and Coatings for Food Applications; Embuscado ME, Huber KC Eds.; Springer: New York, NY, USA, 2009; p. 211–244.
- Maftoonazad N, Ramaswamy HS, Marcotte M. Shelf-life extension of peaches through sodium alginate and methyl cellulose edible coatings. International Journal Food Science Technology. 2008; 43:951–957.
- Fonseca SC, Oliveira FAR, Brecht JK. Modelling respiration rate of fresh fruits and vegetables for modified atmosphere packages: A review. Journal of Food Engineering. 2002; 52: 99–119.
- Mantilla N, Castell-Perez M, Gomes C, Moreira RG. Multilayered antimicrobial edible coating and its effect on quality and shelf-life of fresh-cut pineapple (Ananas comosus). LWT-Food Science and Technology. 2013; 51:37-43.
- Yousuf B, Qadri OS, Srivastava AK.Recent developments in shelf-life extension of fresh-cut fruits and vegetables by application of different edible coatings: A review. LWT- Food Science and Technology, 2018; 89:198-209.
- Campos CA.; Gerschenson LN, Flores SK. Development of edible films and coatings with antimicrobial activity. Food and Bioprocess Technology, 2011; 4:849-875.
- Tavassoli-Kafrani E, Shekarchizadeh H, Masoudpour-Behabadi M. Development of edible films and coatings from alginates and carrageenans. Carbohydrate Polymers. 2016; 137:360-374.
- Riva SC, Opara UO, Fawole OA. Recent developments on postharvest application of edible coatings on stone fruit: A review. Scientia Horticulturae. 2020; 262: 109074.
- Oliveira VC de, Mendes FQ. Técnicas de preservação pós-colheita de frutas e hortaliças: Uma Revisão Narrativa. In: Ciência e Tecnologia de Alimentos: pesquisa e práticas contemporâneas. Vol. 2. Editora Científica Digital; 2021.
- Sapper M, Palou L, Pérez-Gago MB, Chiralt A. Antifungal Starch–Gellan Edible Coatings with Thyme Essential Oil for the Postharvest Preservation of Apple and Persimmon. Coatings. 2019; 9:333.
- Alikhani-Koupaei M. Liposome-entrapped essential oils on in vitro and in vivo antioxidant activity in leafy vegetables. Quality Assurance and Safety of Crops & Foods. 2015; 7:369-373.
- Arabpoor B, Yousefi S, Weisany W, Ghasemlou M. Multifunctional coating composed of Eryngium campestre L. essential oil encapsulated in nano-chitosan to prolong the shelf-life of fresh cherry fruits. Food Hydrocolloids. 2021; 111: 106394.
- Yin C, Huang C, Wang J, Liu Y, Lu P, Huang L. Effect of Chitosan- and Alginate-Based Coatings Enriched with Cinnamon Essential Oil Microcapsules to Improve the Postharvest Quality of Mangoes. Materials. 2019; 12:2039.
- Das S, Chaudhari AK, Singh VK, Dwivedy AK, Dubey NK. Chitosan based encapsulation of Valeriana officinalis essential oil as edible coating for inhibition of fungi and aflatoxin B1 contamination, nutritional quality improvement, and shelf life extension of Citrus sinensis fruits. International Journal of Biological Macromolecules. 2023; 233:123565.
- Chen M, Yan X, Cheng M, Zhao P, Wang Y, Zhang R, Wang X, Wang J, Chen M. Preparation, characterization and application of poly (lactic acid)/corn starch/eucalyptus leaf essential oil microencapsulated active bilayer degradable film. International Journal of Biological Macromolecules. 2022; 195:264-273, 2022.
- Miranda M, Sun X, Marín A, Santos LC dos, Plotto A, Bai J, Assis OBG, Ferreira MD, Baldwin E. Nano- and micro-sized carnauba wax emulsions-based coatings incorporated with ginger essential oil and hydroxypropyl methylcellulose on papaya: Preservation of quality and delay of post-harvest fruit decay. Food Chemistry. 2022; 13:100249.
- Basumatary B, Mukherjee A, Katiyar V, Dutta J, Kumar S. Chitosan-based active coating for pineapple preservation: Evaluation of antimicrobial efficacy and shelf-life extension. LWT. 2022; 168:113940.
- Ferreira RR, Souza AGS, Quispe YM, Rosa DS. Essential oils loaded-chitosan nanocapsules incorporation in biodegradable starch films: A strategy to improve fruits shelf life. International Journal of Biological Macromolecules. 2021; 188:628-638.
- Zhang H, Zhang C, Wang X, Huang Y, Xio M, Hu Y, Zhang J. Antifungal electrospinning nanofiber film incorporated with Zanthoxylum bungeanum essential oil for strawberry and sweet cherry preservation. LWT. 2022; 169:113992.
- Wang H, Ma Y, Liu L, Liu Y, Niu X. Incorporation of clove essential oil nanoemulsion in chitosan coating to control Burkholderia gladioli and improve postharvest quality of fresh Tremella fuciformis. LWT. 2022; 170: 114059.
- Das S, Vishakha K, Banerjee S, Mondal S, Ganguli A. Sodium alginate-based edible coating containing nanoemulsion of Citrus sinensis essential oil eradicates planktonic and sessile cells of food-borne pathogens and increased quality attributes of tomatoes. International Journal of Biological Macromolecules. 2020; 162:1770-1779.
- Mastromatteo M, Conte A, Del Nobile MA. Packaging strategies to prolong the shelf life of fresh carrots (Daucus carota L.). Innovative Food Science & Emerging Technologies. 2012; 13:215–220.
- Finger FL, Vieira G. Controle da perda pós-colheita de água em produtos hortícolas. 2ª reimpressão. Viçosa: UFV, 2007.
- Oliveira VC de. Aplicação de revestimento a base de PVOH adicionados de óleos essenciais em frutos de abacate (Persea americana Mill. cv Hass) sob refrigeração [dissertação]. Minas Gerais: Universidade Federal de Viçosa; 2022.
- Caratan AG. Process for the Substantial Prolongation of the Storage Life of Grapes. U.S Patent. 2016; 9:295.
- Schwan-Estrada KRF, Stangarlin JR. Extratos e óleos essenciais de plantas medicinais na indução de resistência. In: CAVALCANTI, L.S. et al. Indução de resistência em plantas a patógenos e insetos. Piracicaba: Fealq, 2005.
- Wink M. Modes of action of herbal medicines and plant secondary metabolites. Medicines. 2015; 2:251-286.
- Bajpai VK, Sharma A, Baek KH. Antibacterial mode of action of Cudrania tricuspidata fruit essential oil, affecting membrane permeability and surface characteristics of food-borne pathogens. Food Control. 2013; 32:582-590.
- Ziaee E, Razmjooei M, Shad E, Eskandari MH. Antibacterial mechanisms of Zataria multiflora Boiss. essential oil against Lactobacillus curvatus. LWT. 2018; 87:406-412.
- Swamy MK, Akhtar MS, Sinniah UR. Antimicrobial Properties of Plant Essential Oils against Human Pathogens and Their Mode of Action: An Updated Review. Evidence-Based Complementary and Alternative Medicine. 2016; 1-21.
- Bajpai VK, Baek KH, Kang SC. Control of Salmonella in foods by using essential oils: A review. Food Research International. 2012; 45: 722-734.
- Fisher K, Phillips C. The mechanism of action of a citrus oil blend against Enterococcus faecium and Enterococcus faecalis. Journal of Applied Microbiology. 2009; 106: 1343-1349.
- Guinoiseau E, Luciani A, Rossi PG, Quilichini Y, Ternengo S, Bradesi P, Berti L. Cellular effects induced by Inula graveolens and Santolina corsica essential oils on Staphylococcus aureus. European Journal of Clinical Microbiology and Infectious Diseases. 2010; 29: 873-879.
- Valencia-Chamorro SA, Palou L, del Río MA, Pérez-Gago MB. Antimicrobial edible films and coatings for fresh and minimally processed fruits and vegetables: A review. Critical Review Food Science Nutrition. 2011; 51:872–900.
- Slavin YN, Asnis J, Häfeli UO, Bach H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. Journal of Nanobiotechnology. 2017; 15:65.



