INFLUÊNCIA DA MICROBIOTA INTESTINAL NO TRANSTORNO DE ESPECTRO AUTISTA
Capítulo de livro publicado no livro do I Congresso Internacional em Ciências da Nutrição. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062015-16
Este trabalho foi escrito por:
Alice de Araújo Torres *; Whitney Celine Ferreira Martins ;Raysse Tenório da Silva ; Euclides Alves de Sá ; Caroline Leite ;
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: O Transtorno do Espectro Autista (TEA) é uma patologia do neurodesenvolvimento que acomete cerca de 1 (uma) em cada 100 (cem) crianças, com prevalência de diagnóstico em crianças do sexo masculino. O TEA tem etiologia e fisiopatologia desconhecidas, todavia estão sendo estudadas pela comunidade científica teorias quanto a ação dos fatores epigenéticos, ambientais e genéticos. Sabe-se que os comportamentos fixos restritivos desses pacientes podem acarretar problemas no Trato Gastrointestinal (TGI), como consequência a disbiose, que é o desequilíbrio na contagem entre bactérias protetoras e bactérias agressoras no microbioma intestinal. Esse desequilíbrio homeostático traz malefícios à saúde, pois afeta o eixo intestino-cérebro, responsável por ocasionar e sustentar inúmeros distúrbios neurológicos conhecidos na atualidade. O presente estudo teve como objetivo avaliar a microbiota intestinal de pacientes com TEA e a influência do eixo intestino-cérebro, bem como a suplementação de probióticos na redução dos sintomas relacionados ao desequilíbrio bacteriano no intestino de portadores.
Palavras–chave: Disbiose; Eixo intestino-cérebro; Microbiota; Probióticos; Transtorno do Espectro Autista
Abstract: Autism Spectrum Disorder (ASD) is a neurodevelopmental pathology that affects about 1 (one) in every 100 (one hundred) children, with a prevalence of diagnosis in male children. ASD has an unknown etiology and pathophysiology, however theories regarding the action of epigenetic, environmental and genetic factors are being studied by the scientific community. It is known that the fixed restrictive behaviors of these patients can cause problems in the Gastrointestinal Tract (GIT), as a consequence of dysbiosis, which is the imbalance in the count between protective bacteria and aggressive bacteria in the intestinal microbiome. This homeostatic imbalance brings harm to health, as it affects the gut-brain axis, responsible for causing and sustaining numerous neurological disorders known today. The present study aimed to evaluate the intestinal microbiota of patients with ASD and the influence of the gut-brain axis, as well as probiotic supplementation in the reduction of symptoms related to bacterial imbalance in the intestine of patients.
Keywords: Dysbiosis; Gut-brain axis; Microbiota; Probiotics; Autism Spectrum Disorder
INTRODUÇÃO
O diagnóstico de Transtorno do Espectro Autista tem crescido ao longo do tempo, de forma que já não é mais conhecido como uma condição rara. A despeito dessa afirmação, sua etiologia e fisiopatologia ainda são complexas e por isso mesmo a importância de maiores estudos na área (1).
O TEA relaciona-se com uma variedade de comorbidades como a deficiência intelectual e motora, agressão, distúrbios afetivos, problemas de atenção, diferenças sensoriais, entre outros. Pesquisas indicam que não é um distúrbio unicamente genético, existindo também fatores ambientais e epigenéticos que possivelmente contribuem para seu aparecimento (2).
A definição de autismo se ampliou no decorrer da história, sobretudo com a admissão do espectro pela Associação Americana de Psiquiatria em sua 5ª edição do Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM-5) como “Transtorno do Espectro Autista” (3). A partir dessa nova nomenclatura, o autismo englobou o Transtorno Desintegrativo da Infância, Transtorno de Asperger e Transtorno Invasivo do Desenvolvimento sem outra especificação (4).
O TEA caracteriza-se por alterações presentes desde idade muito precoce, tipicamente antes dos três anos de idade, com comprometimento em três áreas: interação social, comunicação e comportamento restrito e repetitivo (5).
Estudos demonstram que cerca de 45% a 96% de indivíduos com TEA apresentam algum tipo de disfunção de Integração Sensorial (IS), esses indivíduos têm dificuldade para se adaptarem aos estímulos sensoriais que envolvem o ambiente, tendo tais alterações impacto direto em sua participação social como, por exemplo, nas atividades escolares (6).
Nos últimos anos tem se explorado mais sobre os benefícios da nutrição para os sintomas relacionados ao autismo e de que forma ela pode estar associada. Alguns tipos de dietas têm sido experimentados por esse público a fim de verificar se haverá uma melhora na amenização dos sintomas (7).
O presente estudo teve como objetivo avaliar a influência da microbiota intestinal no TEA. Analisar como esta atua no eixo intestino-cérebro dos pacientes e sua relação com os sintomas. Além disso, verificar estratégias alternativas para melhor qualidade de vida, como a suplementação de probióticos na redução dos sintomas relacionados ao desequilíbrio bacteriano no intestino.
TRANSTORNO DE ESPECTRO AUTISTA
De acordo com o Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM-5), o TEA está contido dentre a classificação de Transtornos do Neurodesenvolvimento. O TEA tem como característica peculiaridades em duas áreas, no convívio social e em interesses fixos restritivos (3).
O prejuízo crônico na comunicação e interação social é visto em inúmeros contextos, incluindo falta na reciprocidade social, em comportamentos não verbais de comunicação, assim como é perceptível impasses nas habilidades para desenvolver, manter e compreender relacionamentos sociais. Outra característica é a presença de padrões restritos e repetitivos de comportamento, interesses ou atividades (3).
O diagnóstico do TEA vem a partir da presença desses critérios citados acima e pode ser identificado em crianças ainda com 18 meses (8). Seu diagnóstico tem como padrão ouro a utilização da Escala de Pontuação para Autismo na Infância, que subdivide a patologia em três estágios: leve (mínimo/ assintomático), moderado, e severo (9). Segundo a Revisão Sistemática e Meta-Análise de van ’t Hof et al. (10), a idade média global para diagnóstico é de 60.48 meses.
Os dados epidemiológicos globais disponíveis quanto a prevalência do Transtorno do Espectro Autista mais atuais provém de uma Revisão Sistemática de 2022 executada por Zeidan et al. (11), que afirma que cerca de 1 em cada 100 crianças têm TEA, em que há uma proporção média entre homens e mulheres de 4,2.
ETIOLOGIA
O Transtorno do Espectro Autista tem etiologia complexa e heterogênea. Apesar de reconhecida a influência de fatores genéticos, e ambientais, seus fenótipos específicos permanecem desconhecidos. Atualmente estima-se que 15% das apresentações do TEA estão ligadas a fatores genéticos, podendo ser extrapolado para uma projeção futura de até 50%, deixando assim, um espaço para condições de etiologia com intervenção ambiental (12).
Comprovando as evidências genéticas, irmãos nascidos em famílias com TEA têm chance de 35-40% maior de desenvolver TEA. Estudos apontaram que alterações nas vias de desenvolvimento de estruturas neuronais e axonais, relacionadas à sinaptogênese, surgem de mutações de um único gene (13).
De acordo com a revisão conduzida por Yoon et al. (2), há influência de fatores epigenéticos, a exemplo da metilação do DNA, modificação de histonas e o RNA não codificante. Achados também dos mesmos autores mostram que a taxa de concordância de TEAs em gêmeos monozigóticos é de 92%, e de gêmeos dizigóticos de 10%, sendo a primeira incrivelmente maior.
Ainda no âmbito da genética, a predisposição em casos familiares tem relevância no incremento de casos da síndrome. Já em relação aos fatores ambientais, algumas classes de agrotóxicos, estresse, exposição pré ou pós natal a metais pesados, infecção materna e fatores alimentares parecem ter relação com o TEA. Outros fatores de grande relevância quanto ao possível desencadeamento do TEA são: a idade avançada dos pais, tempo de gestação, hipóxia durante o parto, baixo peso do nascituro e parto cesáreo (14).
Além destes fatores ambientais mencionados anteriormente, Bolter, Girdler e Marschik (1) apontam a obesidade, diabetes, ambiente fetal, alcoolismo, nutrição, infecções, tabagismo como influenciadores no TEA. Com relação às infecções, o risco pode estar associado à resposta imune que provocam e não ao agente patológico em si. Em contrapartida, os referidos autores também mencionam fatores de proteção, como o consumo de folato, ômega 3 e 6.
FISIOPATOLOGIA
Quanto à fisiopatologia apresentada pelo TEA, Galvez-Contreras, Zarate-Lopez, Torres-Chavez, Gonzalez-Perez (15) mencionam que apesar das incertezas, descobertas recentes comprovam uma ligação entre interrupção da conectividade neural com alterações na substância branca e na mielinização em regiões do cérebro de pacientes com a síndrome. Alterações no lobo frontal, áreas límbicas e putâmen geram desequilíbrio na inibição/excitação neurológicas.
Estudos genéticos e post-mortem, indicam relação entre o autismo com erros e deficiências no desenvolvimento de distintas áreas cerebrais, inclusive o córtex frontal, cerebelo, hipocampo e núcleo amigdalóide. Dentre as anormalidades inclui-se a displasia cortical frontal, tamanho reduzido do neurônio e anormalidades dendríticas. Importante ressaltar que essas características não são comuns a todos os pacientes (16).
Veras e Nunes (17) apontam que o TEA, inicialmente era considerado um distúrbio exclusivamente neurológico, entretanto, atualmente, reconhece a possível influência de fatores ambientais, bem como relacionado com o sistema digestivo, especificamente a alteração no eixo cérebro-intestino-microbiota, podendo variar o comprometimento do grau leve ao grave.
De semelhante modo, Anderle e Mello (18), entendem que apesar de uma origem obscura, é clara a importância de uma intervenção nutricional para o TEA, relatando que a digestão incompleta de glúten e caseína ligada a uma alteração na permeabilidade intestinal parece influir no Sistema Nervoso Central (SNC).
As alterações sensoriais, físicas, neuronais, imunológicas, endócrinas e parácrinas reagem de forma complexa e direcionadas ao sistema nervoso central, bi-direcionando ao sistema gastrointestinal. Em crescente aumento de desequilíbrio do microbioma de pacientes com TEA, assim como se relacionam em outras patologias como: distúrbios neurológicos, obesidade, doenças reumáticas, endócrinas e etc. Modificações nos hábitos alimentares e distúrbios do trato gastrointestinal (TGI), também são descritos como tendo interferência direta na etiologia e sintomatologia, impactando de forma prejudicial a qualidade de vida do indivíduo (19).
As desordens na microbiota intestinal afetam diretamente os pacientes com espectro autista, sendo assim de extrema importância o acompanhamento neurológico e nutricional do mesmo. Descrita como capaz de influenciar na manutenção da barreira intestinal, barreira hemato-encefálica, expressão de neurotransmissores e seus receptores, e modulação da atividade cerebral e do comportamento (20).
A desregulação do eixo intestino-cérebro pode causar doenças mentais, a saber: Transtorno do Déficit de Atenção com Hiperatividade (TDAH), tratando de um distúrbio do neurodesenvolvimento, acarreta a falta de atenção, impulsividade e hiperatividade; o TEA, transtorno no desenvolvimento que dificulta a interação social, comunicação verbal e não verbal e a cognição; bem como a esquizofrenia: distúrbio mental grave, que influência nos pensamentos, sentimentos e comportamentos (21).
De acordo com Kang et al. (22), há evidências de uma microbiota intestinal anormal em indivíduos com TEA. Dito isso, a modulação do microbioma intestinal é uma rota viável para a melhora de sintomas gastrointestinais, assim como comportamentais nesses pacientes. Os pesquisadores supracitados avaliaram que o transplante de microbiota fecal tem potencial para transformar o microbioma intestinal disbiótico em um microbioma saudável; além disso, foi observado que os benefícios gastrointestinais foram mantidos mesmo no final do tratamento, e os sintomas do autismo melhoraram significativamente.
Portadores de TEA são mais vulneráveis a manifestações de sintomas patológicos no intestino, os quais possibilitam alterações no comportamento dos seres e na qualidade de vida através do desequilíbrio na estrutura física e mental. Os cidadãos que carregam essa doença e não utilizam um auxílio na questão alimentar, são prejudicados e expostos a uma série de problemas maiores (14).
A disbiose constitui-se por haver o desequilíbrio na contagem de bactérias protetoras e agressoras no microbioma, resultando em um estado mal-adaptativo do trato gastrointestinal. Essa disfunção atrapalha a homeostase do organismo, deixando mais suscetíveis aos transtornos (23).
Os agravantes de uma microbiota desregulada estão correlacionados em graus com o espectro autista, fazendo parte de um conjunto de intervenções e modulações intestinais, vista a redução de inflamação por interleucina 13 (IL-13) e fator de necrose tumoral alfa (TNF-α) e neuroinflamação (24).
De acordo com os autores da Revisão Cekici e Sanlier (25), alimentos que apresentam glúten e caseína em sua composição podem acarretar o desenvolvimento de sintomas em pacientes com TEA, essa influência está ligada a desconfortos gastrointestinais, como é o caso da doença celíaca.
A microbiota intestinal de portadores de TEA é vista como mais fragilizada quando relacionada com pacientes que não carregam a patologia, sendo mais propício o aparecimento de situações desfavoráveis. O nosso intestino é um precursor no processo de variabilidade de mecanismos de controles, estruturando, modificando e prevenindo certos danos alimentares. A ação dos probióticos é benéfica à microbiota, os patógenos entram em competição pelos nutrientes, produções metabólicas, sítios de acessos, modulações de resposta imune do hospedeiro e agentes antimicrobianos. Com isso, a dieta probiótica valida a modulação e regulação da microbiota (27).
Os probióticos bacterianos mais conhecidos são os Lactobacillus, Bifidobacterium e Lactococcus, enquanto a levedura mais utilizada é Saccharomyces boulardii. Estes proporcionam bons efeitos perante a dor abdominal global, melhorando escores de inchaço e flatulência, podendo visar além do trato gastrointestinal, justamente por serem desenvolvidos para otimizar as doenças fisiológicas em diferentes áreas do corpo (28).
Níveis elevados de inflamação na mucosa podem danificar o comportamento no organismo, gerando impactos negativos para os portadores de TEA. Estudo realizado nos Estados Unidos revelou que a suplementação com probióticos durante 12 semanas (Bifidobacterium longum subsp infantis + colostro bovino) em crianças com a patologia e distúrbios gastrointestinais, houve a diminuição da produção de IL-13 e TNF-α em alguns indivíduos do experimento (24).
Ao longo da vida e da infância, a microbiota continua desempenhando papéis importantes na modulação do funcionamento do sistema imunológico, bem como no amadurecimento do cérebro e do corpo do hospedeiro, sendo enfatizado a boa manutenção do microbioma com alimentos ricos em nutrientes e suporte nutricional adequado aos pacientes com TEA (29).
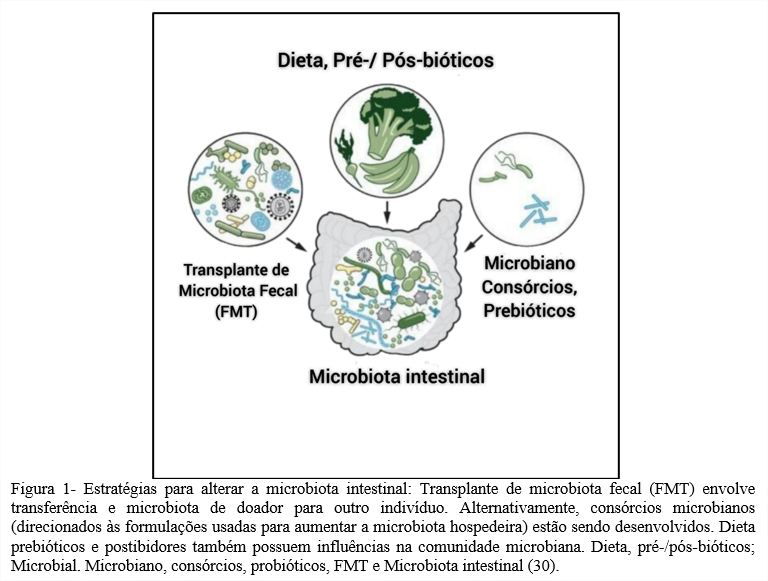
Há, portanto, grande interesse em direcionar essas bactérias para promover a saúde geral e eliminar doenças, com avanços significativos sendo feitos recentemente. Estratégias para regular as bactérias intestinais incluem transplante de microbiota fecal, que envolve a transferência de material fecal de um indivíduo para outro para alcançar o efeito fisiológico desejado, tal protocolo sendo evidenciada na Figura 1. Essa abordagem, entre outras estratégias para modular a microbiota intestinal, tem se mostrado muito promissora no tratamento de várias doenças, embora ainda haja uma oportunidade de integrar e desenvolver abordagens alternativas (30).
DIETOTERAPIA
O estado nutricional do autista não depende só da ingestão alimentar, mas de processos fisiológicos e metabólicos, como a digestão e a absorção. Por um lado, as possíveis perturbações metabólicas do autismo podem conduzir a necessidades acrescidas de vitaminas e minerais, entretanto a recusa e seletividade alimentar são comuns. Assim, nutrientes não digeridos servem de substrato para as bactérias, favorecendo o crescimento de uma microbiota anormal. A instabilidade, por sua vez, pode conduzir a uma colonização por bactérias patogênicas e produtoras de neurotoxinas (31).
Tendo em vista que pacientes com TEA, podem apresentar um desequilíbrio da microbiota intestinal, e essa condição pode comprometer a saúde em decorrência do aumento da permeabilidade intestinal, a qual permite a entrada de microrganismos patogênicos e outras toxinas, o estudo da microbiota de pacientes com TEA torna-se essencial. Entre os diversos tipos de intervenções, foram abordados os aspectos das intervenções nutricionais. A literatura científica tem mostrado, com relação à alimentação, os três aspectos mais marcantes que são: seletividade, recusa e indisciplina (32).
Os neurotransmissores desempenham um papel fundamental no TEA, dando ênfase aos seus produtos metabólicos: ácido γ-aminobutírico (GABA), serotonina, dopamina, epinefrina e acetilcolina. Sendo o GABA um indispensável neurotransmissor de inibição de vários circuitos cerebrais, modulando ações fisiológicas e psicológicas. A secreção do GABA também propicia um pH adequado para a sobrevivência de inúmeras bactérias intestinais. A produção de GABA pela microbiota intestinal pode ser uma forma de desenvolvimento e manutenção desses microrganismos (33).
De acordo com a Revisão Sistemática conduzida por Dias, Rocha, Ferreira e Pena (34), o aumento de sintomas comportamentais de indivíduos com TEA pode ser causado pela má digestão de alimentos contendo glúten e caseína. Estes em excesso no TGI são direcionados para a corrente sanguínea e, por meio da circulação podem afetar SNC.
A revisão mencionada anteriormente também aponta que há uma maior permeabilidade intestinal em crianças com TEA quando comparada com crianças sem o diagnóstico de TEA. Portanto, uma dieta isenta de glúten e caseína pode ser uma via para melhoria da qualidade de vida das crianças no TEA (34).
A relação microbiota-intestino-cérebro na modulação comportamental de portadores de TEA é evidente, sendo possível utilizar mudanças dietéticas como tratamento adjuvante, melhorando sintomas intestinais e modulando comportamentos extra intestinais. O aumento da permeabilidade intestinal permite que metabólitos bacterianos se desloquem para circulação sistêmica levando a uma resposta inflamatória, que atinge áreas cerebrais e a micróglia. A ativação imune pode levar a sinapses defeituosas (35).
A dieta sem glúten pode ajudar a melhorar o sistema digestivo de autistas visto que esses pacientes podem estar mais propensos a problemas digestivos (36). Todavia, é necessário ter cuidado com esse tipo de dieta, pois como ainda não se tem evidências suficientes, o ideal é que ela só seja adotada em caso de confirmação de alergia, intolerância ou hipersensibilidade, visto que esse tipo de dieta restrita pode ocasionar outros problemas nutricionais e implicar negativamente no desenvolvimento neurológico (37).
Portadores do TEA possuem deficiências em determinados aminoácidos, como a tirosina e triptofano, que se relacionam, não somente aos sintomas gastrointestinais, como também aos sintomas neurológicos e psiquiátricos. O metabolismo também está alterado nesses indivíduos, como o metabolismo imperfeito do glúten e da caseína que podem interferir no bom funcionamento de neurotransmissores (38).
CONCLUSÕES
Embora a fisiopatologia do TEA assemelha incerteza, estudos indicam que as comorbidades associadas ao TEA têm origem múltipla, oriundos de interações entre os fatores genéticos, nutricionais, ambientais e epigenéticos. Uma dieta individualizada pode contribuir, visto que a restrição de carboidratos simples, glúten e também o consumo de probióticos podem amenizar o quadro do distúrbio, influenciando positivamente não só nas disfunções parassimpáticas, mas também como uma via de tratamento para os autistas.
REFERÊNCIAS
1. Bölte S, Girdler S, Marschik PB. The contribution of environmental exposure to the etiology of autism spectrum disorder. Cellular and Molecular Life Sciences. 2018 Dec 20;76(7):1275–97. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30570672/
2. Yoon SH, Choi J, Lee WJ, Do JT. Genetic and Epigenetic Etiology Underlying Autism Spectrum Disorder. Journal of Clinical Medicine [Internet]. 2020 Apr 1;9(4):966. Available from: https://www.mdpi.com/2077-0383/9/4/966
3. AMERICAN PSYCHIATRIC ASSOCIATION DSM-5 ® [Internet]. Available from: http://www.niip.com.br/wp-content/uploads/2018/06/Manual-Diagnosico-e-Estatistico-de-Transtornos-Mentais-DSM-5-1-pdf
4. Almeida ML, Neves AS. A Popularização Diagnóstica do Autismo: uma Falsa Epidemia? Psicologia: Ciência e Profissão [Internet]. 2020 Nov 9 [cited 2022 Apr 12];40. Available from: https://www.scielo.br/j/pcp/a/WY8Zj3BbWsqJCz6GvqGFbCR/?format=html
5. Günal A, Bumin G, Huri M. The Effects of Motor and Cognitive Impairments on Daily Living Activities and Quality of Life in Children with Autism. Journal of Occupational Therapy, Schools, & Early Intervention. 2019 Apr 23;1–11. Available from: https://www.tandfonline.com/doi/abs/10.1080/19411243.2019.1604286
6. Metz AE, Boling D, DeVore A, Holladay H, Liao JF, Vlutch KV. Dunn’s Model of Sensory Processing: An Investigation of the Axes of the Four-Quadrant Model in Healthy Adults. Brain Sciences. 2019 Feb 7;9(2):35. Available from: https://www.mdpi.com/2076-3425/9/2/35
7. Gogou M, Kolios G. Are therapeutic diets an emerging additional choice in autism spectrum disorder management? World Journal of Pediatrics. 2018 May 30;14(3):215–23. Available from: https://link.springer.com/article/10.1007/s12519-018-0164-4
8. Hyman SL, Levy SE, Myers SM. Identification, Evaluation, and Management of Children With Autism Spectrum Disorder. Pediatrics [Internet]. 2019 Dec 16;145(1):e20193447. Available from: https://pediatrics.aappublications.org/content/pediatrics/early/2019/12/15/peds.2019-3447.full.pdf?download=true
9. Moon SJ, Hwang JS, Shin AL, Kim JY, Bae SM, Sheehy‐Knight J, et al. Accuracy of the Childhood Autism Rating Scale: a systematic review and meta‐analysis. Developmental Medicine & Child Neurology. 2019 Apr 11;61(9):1030–8. Available from: https://onlinelibrary.wiley.com/doi/full/10.1111/dmcn.14246
10. van ’t Hof M, Tisseur C, van Berckelear-Onnes I, van Nieuwenhuyzen A, Daniels AM, Deen M, et al. Age at autism spectrum disorder diagnosis: A systematic review and meta-analysis from 2012 to 2019. Autism. 2020 Nov 19;25(4):862–73. Available from: https://journals.sagepub.com/doi/10.1177/1362361320971107
11. Zeidan J, Fombonne E, Scorah J, Ibrahim A, Durkin MS, Saxena S, et al. Global prevalence of autism: A systematic review update. Autism Research. 2022 Mar 3;Available from: https://onlinelibrary.wiley.com/doi/full/10.1002/aur.2696
12. Bölte S, Girdler S, Marschik PB. The contribution of environmental exposure to the etiology of autism spectrum disorder. Cellular and Molecular Life Sciences. 2018 Dec 20;76(7):1275–97. Available from: https://pubmed.ncbi.nlm.nih.gov/30570672/
13. Eissa N, Al-Houqani M, Sadeq A, Ojha SK, Sasse A, Sadek B. Current enlightenment about etiology and pharmacological treatment of autism spectrum disorder. Frontiers in neuroscience. 2018 May 16;12:304. Available from: https://www.frontiersin.org/articles/10.3389/fnins.2018.00304/full
14. Cupertino MDC, Resende MB, Veloso IDF, Carvalho CA de, Duarte VF, Ramos GA. Transtorno do espectro autista: uma revisão sistemática sobre aspectos nutricionais e eixo intestino-cérebro. ABCS Health Sciences. 2019 Aug 30;44(2). Available from: https://www.portalnepas.org.br/abcshs/article/view/1167
15. Galvez-Contreras AY, Zarate-Lopez D, Torres-Chavez AL, Gonzalez-Perez O. Role of Oligodendrocytes and Myelin in the Pathophysiology of Autism Spectrum Disorder. Brain Sciences. 2020 Dec 8;10(12):951. Available from: https://www.mdpi.com/2076-3425/10/12/951
16. Al Dera H. Cellular and molecular mechanisms underlying autism spectrum disorders and associated comorbidities: A pathophysiological review. Biomedicine & Pharmacotherapy. 2022 Apr;148:112688. Available from: https://www.sciencedirect.com/science/article/pii/S0753332222000762
17. Veras R dos SC, Nunes CP. CONEXÃO CÉREBRO-INTESTINO-MICROBIOTA NO TRANSTORNO DO ESPECTRO AUTISTA. Revista de Medicina de Família e Saúde Mental [Internet]. 2019 May 30 [cited 2022 Apr 13];1(1). Available from: https://revista.unifeso.edu.br/index.php/medicinafamiliasaudemental/article/view/1564
18. Anderle T, de Mello E. Autismo: aspectos nutrológicos das dietas e possível etiologia. International Journal of Nutrology. 2018 Sep;11(02):066–70. Available from: https://www.thieme-connect.com/products/ejournals/html/10.1055/s-0038-1670668
19. Kim N, Yun M, Oh YJ, Choi H-J. Mind-altering with the gut: Modulation of the gut-brain axis with probiotics. Journal of Microbiology. 2018 Feb 28;56(3):172–82. Available from: https://link.springer.com/article/10.1007/s12275-018-8032-4
20. Torrijo Bueno B. Influencia de la microbiota en pacientes con trastornos del comportamiento. repositoriounicanes [Internet]. 2017 Oct 13 [cited 2022 Apr 13]; Available from: https://repositorio.unican.es/xmlui/handle/10902/12432
21. Krajmalnik-Brown R, Kang D-W, Park JG, Labaer J, Ilhan Z. Microbiome markers and therapies for autism spectrum disorders [Internet]. [cited 2022 Apr 13]. Available from: https://patents.google.com/patent/US9719144B2/en
22. Kang D-W, Adams JB, Coleman DM, Pollard EL, Maldonado J, McDonough-Means S, et al. Long-term benefit of Microbiota Transfer Therapy on autism symptoms and gut microbiota. Scientific Reports [Internet]. 2019 Apr 9 [cited 2019 Apr 23];9(1). Available from: https://www.nature.com/articles/s41598-019-42183-0
23. Pereira IG, Ferraz IAR. Suplementação de glutamina no tratamento de doenças associadas à disbiose intestinal. Revista Brasileira de Saúde Funcional [Internet]. 2017 Jun 13 [cited 2022 Apr 13];1(1):46–6. Available from: https://seer-adventista.com.br/ojs3/index.php/RBSF/article/view/830
24. Sanctuary MR, Kain JN, Chen SY, Kalanetra K, Lemay DG, Rose DR, et al. Pilot study of probiotic/colostrum supplementation on gut function in children with autism and gastrointestinal symptoms. van Wouwe JP, editor. PLOS ONE. 2019 Jan 9;14(1):e0210064. Available from: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0210064
25. Cekici H, Sanlier N. Current nutritional approaches in managing autism spectrum disorder: A review. Nutritional Neuroscience. 2017 Aug;22(3):145–55. Available from: https://www.tandfonline.com/doi/abs/10.1080/1028415X.2017.1358481
26. Rocha GS, Lima ND, da Silva Lima M, Pessoa NM, da Silva MC, Carvalho VS, de Oliveira MM, Rocha SC, da Silva HA. Terapias alternativas e complementares no tratamento de sintomas gastrointestinais em crianças com Transtorno do Espectro Autista. Revista Eletrônica Acervo Saúde. acervomaiscombr [Internet]. 2020 Jul 11 [cited 2022 Apr 13]; Available from: https://acervomais.com.br/index.php/saude/article/view/3538
27. Ho KJ, Varga J. Early-Life Gut Dysbiosis: A Driver of Later-Life Fibrosis? Journal of Investigative Dermatology. 2017 Nov;137(11):2253–5. Available from: https://www.sciencedirect.com/science/article/pii/S0022202X17328312
28. Morrow LE, Wischmeyer P. Blurred lines: dysbiosis and probiotics in the ICU. Chest. 2017 Feb 1;151(2):492-9. Available from: https://www.sciencedirect.com/science/article/abs/pii/S0012369216607754
29. Flannery J, Callaghan B, Sharpton T, Fisher P, Pfeifer J. Is adolescence the missing developmental link in Microbiome-Gut-Brain axis communication? Developmental Psychobiology. 2019 Jan 28;61(5):783–95. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1002/dev.21821
30. Wargo JA. Modulating gut microbes. Science. 2020 Sep 10;369(6509):1302–3. Available from: https://www.science.org/doi/abs/10.1126/science.abc3965
31. Oliveira BMF de, Frutuoso MFP. Muito além dos nutrientes: experiências e conexões com crianças autistas a partir do cozinhar e comer juntos. Cadernos de Saúde Pública [Internet]. 2021 [cited 2021 Sep 11];37(4). Available from: https://www.scielo.br/j/csp/a/54gYDFVCTvRBSmkrCSFK9NR/?lang=pt
32. Pulikkan J, Maji A, Dhakan DB, Saxena R, Mohan B, Anto MM, et al. Gut Microbial Dysbiosis in Indian Children with Autism Spectrum Disorders. Microbial Ecology. 2018 Mar 21;76(4):1102–14. Available from: https://link.springer.com/article/10.1007/s00248-018-1176-2
33. Arneth BM. Gut–brain axis biochemical signalling from the gastrointestinal tract to the central nervous system: gut dysbiosis and altered brain function. Postgraduate Medical Journal. 2018 Jul 19;94(1114):446–52. Available from: https://pmj.bmj.com/content/94/1114/446.abstract
34. Dias EC, Rocha JS, Ferreira GB, Pena G das G. Dieta isenta de glúten e caseína no transtorno do espectro autista: uma revisão sistemática. Revista Cuidarte [Internet]. 2018 [cited 2021 May 14];9(1):2059–73. Available from: http://www.scielo.org.co/scielo.php?script=sci_abstract&pid=S2216-09732018000102059&lng=en&nrm=iso&tlng=pt#:~:text=A%20dieta%20sem%20gl%C3%BAten%20e
35. Bento GAO, Leite VLT, Silva PHA, Magalhães BMS, Cruz CM da. Impacto da Microbiota Intestinal no Comportamento das Crianças com Transtorno do Espectro Autista (TEA). SEMPESq – Semana de Pesquisa da Unit – Alagoas [Internet]. 2020 Nov 25 [cited 2022 Apr 13];(8). Available from: https://eventos.set.edu.br/al_sempesq/article/view/13681
36. Herlambang T, Afifa LN, Inawati PA, Muhith A. Analysis of Gluten Free Casein Free Compliance (GFCF) Diet in Terms of the Incidence of Gastroenteritis in Children with Autism Spectrum Using Rank Spearman Test. InIOP Conference Series: Earth and Environmental Science 2021 May 1 (Vol. 747, No. 1, p. 012109). IOP Publishing. Available from: https://iopscience.iop.org/article/10.1088/1755-1315/747/1/012109/meta
37. Loureiro A, et al. Transtorno do Espectro do Autismo [Internet]. Available from: https://www.sbp.com.br/fileadmin/user_upload/21775d-MO_-_Transtorno_do_Espectro_do_Autismo__2_.pdf
38. Arianne M, Leite C, De Lima Da Silva S, Guimarães B, Correia B, Ribeiro M, et al. INTERVENÇÃO NUTRICIONAL NO TRANSTORNO ESPECTRO DO AUTISMO [Internet]. [cited 2022 Apr 13]. Available from: https://doity.com.br/media/doity/submissoes/5da4af79-0a64-4f0f-a79c-5fec43cda1d7-resumo-autismo-corrigidopdf.pdf

