
IMPLICAÇÕES DA PRODUÇÃO DE BIOFILME POR ACINETOBACTER SPP. PARA A ÁREA CLÍNICA E DE ALIMENTOS
Capítulo de livro publicado no livro do I Congresso Latino-Americano de Segurança de Alimentos. Para acessa-lo clique aqui.
DOI: https://doi.org/10.53934/08082023-41
Este trabalho foi escrito por:
Thamiris Sant’Anna de Holanda ; Michel Santos Gomes do Nascimento ; Ricardo Campos Monteiro *; Janaína dos Santos Nascimento
*Autor correspondente (Corresponding author) –Email:[email protected]m
Resumo: Algumas espécies do gênero Acinetobacter são associadas a infecções relacionadas à assistência à saúde (IRAS) de importância amplamente reconhecida. Infecções adquiridas na comunidade também têm sido relatadas ao longo dos últimos anos, o que vem a ser um fato preocupante, uma vez que é notório que patógenos humanos podem ser transmitidos através da cadeia alimentar. Vários alimentos de origem animal e vegetal têm sido associados à presença de Acinetobacter spp., incluindo isolados resistentes a antibióticos. A produção de biofilme tem sido elencada como um dos fatores mais importantes fatores de virulência que justificam a permanência e a disseminação de Acinetobacter spp. em diferentes ambientes, tanto associados a ambientes de assistência à saúde quanto a produção de alimentos. O controle da produção de biofilme é de suma importância para mitigar a veiculação de Acinetobacter spp., visto que a colonização de equipamentos e instrumentos hospitalares assim como a tolerância a sanitizantes empregados em indústrias alimentícias estão fortemente associados a esse fator de virulência.
Palavras–chave: Acinetobacter spp., produção de biofilme, alimentos, infecções.
Abstract: Some species of the genus Acinetobacter are associated with healthcare-associated infections of widely recognized importance. Community-acquired infections have also been reported over the past few years, which is a matter of concern, as it is well known that human pathogens can be transmitted through the food chain. Several foods of animal and plant origin have been associated with the presence of Acinetobacter spp., including antibiotic-resistant isolates. Biofilm production has been listed as one of the most important virulence factors that justify the permanence and dissemination of Acinetobacter spp. in different environments, both associated with healthcare environments and food production. Controlling biofilm production is extremely important to mitigate the transmission of Acinetobacter spp., since the colonization of hospital equipment and instruments, as well as tolerance to sanitizers used in food industries, are strongly associated with this virulence factor.
Keywords: Acinetobacter spp.; biofilm production; food; infections.
INTRODUÇÃO
O gênero Acinetobacter é composto por cocobacilos Gram negativos, não-fermentadores, oxidase negativos, pertencentes à família Moraxellaceae. Bactérias desse gêneropodem sobreviver em superfícies inanimadas e secas por vários meses, e possuem um bom crescimento em variações de pH. Geralmente são encontradas em ambientes como solo, água, vegetais e na microbiota humana (1, 2, 3).
Acinetobacter baumannii é a espécie mais importante e está associada a uma gama de infecções graves, especialmente em unidades de terapia intensiva. Além de A. baumannii, outras espécies de relevância clínica são A. calcoaceticus, A. lwoffii, A. pittii, A. nosocomialis e A. seifertii. A. baumannii, no entanto, é um patógeno do grupo ESKAPE (acrônimo para Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa e espécies de Enterobacter), associado a infecções resistentes a antibióticos adquiridas em hospitais e que também tem sido comumente encontrado e diversos tipos de alimentos, como apresentado na Figura 1 (4, 5, 6).
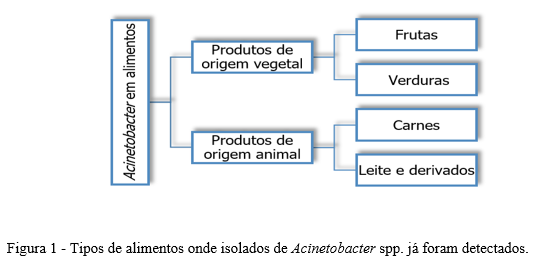
Sabe-se que A. baumannii, assim como algumas outras espécies de Acinetobacter, é inerentemente resistente a antibióticos e devido ao uso crescente desses agentes, bactérias multirresistentes (MDR) têm evoluído. Vários estudos indicam que a capacidade de existência de A. baumannii, incluindo aquelas MDR, em diferentes ambientes é proporcionada principalmente pela formação de biofilme (7, 8).
Dessa forma, este estudo tem por objetivo relatar, de modo sucinto, a importância da produção de biofilme por Acinetobacter spp. tantopara a área clínica quanto para área de alimentos.
MATERIAL E MÉTODOS
Para a realização desse estudo, foi realizado o levantamento de artigos científicos e e-books utilizando-se os descritores a seguir, de forma isolada e combinados entre si: “Acinetobacter”, “biofilme”, “alimentos”, “infecções”, “sanitizantes” e suas devidas traduções para a língua inglesa, disponíveis nas bases de dados das plataformas PubMed, Periódicos Capes e Google Acadêmico. Foram selecionados materiais publicados nos últimos 20 anos, cujos dados foram analisados e compilados de forma a atingir o objetivo do trabalho.
RESULTADOS E DISCUSSÃO
Devido ao elevado ecletismo metabólico e nutricional, as espécies de Acinetobacter adaptam-se facilmente a diferentes ambientes, sendo comumente isolados desde produtos de origem animal a produtos de origem vegetal (9, 10, 4, 6). Um dos fatores que contribui para essa adaptação é a produção de biofilme.
Biofilmes consistem em comunidades bacterianas que aderem umas às outras e a superfícies, envoltas em uma matriz extracelular composta por polissacarídeos, proteínas, ácidos nucléicos e lipídeos (11). Essas estruturas permitem que as bactérias suportem condições ambientais adversas, incluindo a escassez de nutrientes e a dessecação (11, 12). As etapas comuns no desenvolvimento do biofilme são o contato inicial e a fixação à superfície biótica ou abiótica, a formação de microcolônias, a maturação e formação da arquitetura do biofilme e, por último, o desprendimento ou dispersão do biofilme, como apresentado na Figura 2 (13, 14).
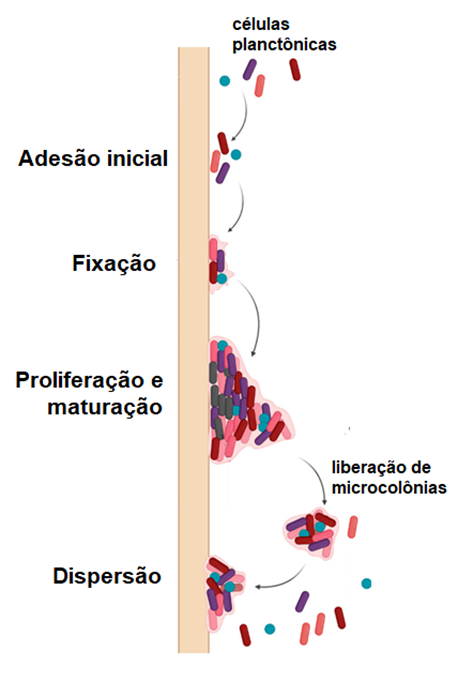
Figura 2- Etapas da formação e desenvolvimento do biofilme bacteriano [Adaptada de Shrestha et al., 2021 (14)].
Os biofilmes, apesar de poderem contribuir de forma benéfica, como auxiliar no crescimento de vegetais e ter uma aplicação na fermentação de alimentos e no tratamento de águas residuais, geralmente apresentam um risco significativo para a saúde pública. Isto se deve ao seu papel em auxiliar o aumento da resistência microbiana, desencadeando dificuldades no tratamento de infecções em humanos e animais (15, 16).
De acordo com Chagas e colaboradores (17), a ancoragem da comunidade bacteriana é proporcionada pela matriz exopolissacarídica, o que confere suporte e alta resistência antibiótica à comunidade bacteriana. A. baumannii possui um grande repertório de genes e de proteínas de virulência relacionados ao biofilme e fatores como a transferência de plasmídeos, presença de bombas de efluxo, porinas de membranas, fosfolipases, polissacarídeos capsulares, proteases, sistemas quelantes de ferro e de sistemas de secreção de proteínas também contribuem para a resistência microbiana no biofilme (5, 11, 17).
A capacidade de Acinetobacter em formar biofilmes é um importante fator de virulência, pois participa do estabelecimento de uma relação ecológica negativa entre o patógeno e o hospedeiro. Esse caráter permite, contudo, a colonização de dispositivos médicos, como cateteres urinários, cateteres venosos centrais, tubos endotraqueais e ventiladores mecânicos, assim como em outras superfícies, como tubulações de água potável, contribuindo assim, para o desenvolvimento das IRAS (Infecções relacionadas à assistência à saúde), anteriormente conhecidas como infecções nosocomiais, como citado na Tabela 1 (11, 15, 16, 18).


Vale ressaltar que o biofilme produzido por A. baumannii tem grande impacto social, pois essa espécie é comumente isolada em amostras hospitalares e apresenta resistência à gama de antimicrobianos, levando-a a ser considerado “alerta vermelho”, por estar relacionada a quadro clínicos de alcoolismo e tabagismo, diarreia aguda, doenças pulmonares, diabetes, doenças autoimunes e neurológicas, além de sepse no âmbito hospitalar (19, 20, 5).
No setor alimentício, o biofilme também é uma estrutura preocupante (Tabela 1), pois além de abrigar e auxiliar a proliferação de bactérias patogênicas, o biofilme é mais resistente a sanitizantes do que as células isoladas. Além disso, está relacionado a possível corrosão de equipamentos, interferindo na qualidade do produto final, desde a avaliação sensorial à veiculação do patógeno (21).
A ocorrência do gênero Acinetobacter em ambientes de processamento de alimentos está bem documentada e a produção de biofilme por Acinetobacter spp. isolados de alimentos e de água potável já foi descrita em alguns trabalhos na literatura (22, 23, 24, 25). Já foi demonstrado, inclusive, que biofilmes produzidos por Acinetobacter spp. podem proteger e proporcionar a persistência e a disseminação de outros patógenos alimentares potenciais. Esse fato já foi observado em superfícies de uma indústria de carne, onde biofilmes de A. calcoaceticus foram capazes de coagregar outras bactérias, como Escherichia coli (26).
Para a indústria de alimentos, a produção de biofilme por Acinetobacter spp. é um fator essencial para garantir sua colonização e a sua permanência no ambiente. Alguns trabalhos relatam a tolerância de isolados de Acinetobacter spp. a altas concentrações de quaternários de amônia (27) e de hipoclorito de sódio (28, 29, 30), muito superiores àquelas recomendadas pelo FDA para a sanitização de equipamentos e de utensílios usados no processamento de alimentos e em outras superfícies de contato com alimentos de consumo humano (31).
Vale ressaltar, ainda, que biofilmes formados na superfície de alimentos frescos, por exemplo, podem causar sérios riscos à qualidade do produto fresco e à saúde do consumidor, pois esses biofilmes podem não ser facilmente removidos com uma simples lavagem com água (25). Procedimentos de limpeza inadequados em ambientes de processamento de alimentos podem, portanto, potencialmente aumentar o risco de contaminação dos alimentos por bactérias deteriorantes e patogênicas, como Acinetobacter spp. (32).
CONCLUSÕES
O biofilme é um importante fator de virulência de Acinetobacter spp., o que permite sua colonização em dispositivos médicos, tubulações de água potável, alimentos, equipamentos e em outros ambientes. As infecções relacionadas a este biofilme podem levar a mortalidade e a internações prolongadas, aumentando o custo em administração de fármacos antimicrobianos e ao aumento da veiculação do patógeno.
Faz-se necessário, portanto, um maior controle dos ambientes produtores ou que manipulam alimentos para certificar se os métodos utilizados para higienização de ambientes, equipamentos e fômites utilizados no processamento de alimentos e em ambientes de assistência à saúde são suficientes para garantir a eliminação do biofilme produzido por esses micro-organismos.
REFERÊNCIAS
- Vanegas-Múnera, J.; Roncancio-Villamil, G.; Jiménez-Quiceno, J. N. Acinetobacter baumannii: importancia clínica, mecanismos de resistencia y diagnóstico. CES Medicina. 2014;28(2):233-246.
- Moubareck, C. A.; Halat, D. H. Insights into Acinetobacter baumannii: A Review of Microbiological, Virulence, and Resistance Traits in a Threatening Nosocomial Pathogen. Antibiotics (Basel). 2020;9(3):119.
- De Souza, L. C. R.; Bezerra, N. V.; Da Trindade, E. L. Aspectos epidemiológicos de Acinetobacter baumannii e avaliação do perfil de resistência em amostras biológicas de pacientes atendidos em um hospital oncológico em Belém-PA. RevSALUS. 2021;3(1):49-55.
- Malta, R. C. R.; Ramos, G.L.D.P.A.; Nascimento, J. From food to hospital: we need to talk about Acinetobacter spp. Germs. 2020;10(3):210-217.
- Gedefie, A.; Demsis, W.; Ashagrie, M.; Kassa, Y.; Tesfaye, M.; Tilahun, M.; Bisetegn, H.; Sahle, Z. Acinetobacter baumannii Biofilm Formation and Its Role in Disease Pathogenesis: A Review. Infect Drug Resist. 2021;14:3711-3719.
- Malta, R.C.R.; Cruz, C.H.S.; Santos, J.B.; Ramos, G.L.P.A.; Nascimento, J.S. Acinetobacter em alimentos: uma visão geral. 1st Edition. Ponta Grossa: Atena; 2021.
- Longo, F.; Vuotto, C.; Donelli, G. Biofilm formation in Acinetobacter baumannii. New Microbiol. 2014;37(2):119-127.
- Yang, C.H.; Su, P.W.; Moi, S.H.; Chuang, L.Y. Biofilm formation in Acinetobacter baumannii: genotype-phenotype correlation. Molecules. 2019;24(10):1849.
- Dahiru, M.; Enabulele, O. I. Acinetobacter baumannii in Birds’ Feces: a public health threat to vegetables and irrigation farmers. Advances in Microbiology. 2015;5(10):693.
- Marí-Almirall, M.; Cosgaya, C.; Pons, M. J.; Nemec, A.; Ochoa, T. J.; Ruiz, J.; et al. Pathogenic Acinetobacter species including the novel Acinetobacter dijkshoorniae recovered from market meat in Peru. International Journal of Food Microbiology. 2019;305:108248
- Eze, E.C.; Chenia, H.Y.; El Zowalaty, M.E. Acinetobacter baumannii biofilms: effects of physicochemical factors, virulence, antibiotic resistance determinants, gene regulation, and future antimicrobial treatments. 2018;11:2277-2299.
- Ribeiro, Juliana de Almeida. Avaliação da produção de biofilme por amostras clínicas de Acinetobacter baumannii do estado de Minas Gerais [Graduação em Biomedicina]. Uberlândia: Universidade Federal de Uberlândia; 2019.
- Colquhoun, J. M.; Rather, P.N. Insights into mechanisms of biofilm formation in Acinetobacter baumannii and implications for uropathogenesis. Frontiers in cellular and infection microbiology. 2020;10:253.
- Shrestha, L.; Fan, H.M.; Tao, H.R.; Huang, J.D. Recent Strategies to Combat Biofilms Using Antimicrobial Agents and Therapeutic Approaches. 2022;11(3):292.
- Pompilio, A.; Scribano, D.; Sarshar, M.; Di Bonaventura, G.; Palamara, A. T.; Ambrosi, C. Gram-Negative Bacteria Holding Together in a Biofilm: The Acinetobacter baumannii Way. Microorganisms. 2021;9(7):1353.
- Queiroz, Y. M.; Maciel, I. A.; Santos, F. D. S. Mecanismo de resistência da bactéria Acinetobacter baumannii e suas implicações no controle das infecções hospitalares. Rev.Bras,Anal.Clin. 2022;54(1):37-43
- Chagas, T.T.; Lima, W.G.; Paiva, M.C.; Castro, A.P. Capacidade de Formação de Biofilmes e perfil de resistência de Acinetobacter baumannii isolados em unidades de terapia intensiva: uma revisão sistemática. Revista Colombiana de Ciencias Químico-Farmacéuticas. 2022;51(2):834-859.
- Bai, X.; Wu, F.; Zhou, B.; Zhi, X. Biofilm bacterial communities and abundance in a large-scale drinking water distribution system in Shanghai. Journal of water and health. 2010;8(3):593-600.
- Polanco, N.; Manzi, L. Toxigenic effect of Acinetobacter baumannii isolated from children with acute diarrhea. Investigación Clínica. 2008;49(1):59-67.
- Weiss, G.A.; Hennet, T.. Mechanisms and consequences of intestinal dysbiosis. Cellular and Molecular Life Sciences. 2017;74:2959-2977.
- Scherrer, J. V.; Marcon, L. N.. Formação de biofilme e segurança dos alimentos em serviços de alimentação. RASBRAN. 2016;7(2):91-99.
- Amorim, A. M. B.; Nascimento, J. S.. Acinetobacter: an underrated foodborne pathogen?. The Journal of Infection in Developing Countries. 2017;11(2):111-114
- Ramos, G. L. P. A.; Nascimento, J. S.. Characterization of Acinetobacter spp. from raw goat milk. Ciência Rural. 2019;49(10):2019404
- Oleiwi, S. R.; Ahmed, E. F.; Rasheed, S. F.. Study the Adhesion Capacity on abiotic surfaces by Acinetobacter baumannii isolated from drinking water. Eurasian Journal of Biosciences. 2020;14:4217-4223.
- Ababneh, Q.; Al-Rousan, E.; Jaradat, Z.. Fresh produce as a potential vehicle for transmission of Acinetobacter baumannii. FoodContamination. 2022;9:5.
- Habimana, O.; Heir, E.; Langsrud, S.; Asli, A. W.; MØRETRØ, T.. Enhanced Surface Colonization by Escherichia coli O157:H7 in Biofilms formed by an Acinetobacter calcoaceticus isolate from meat-processing environments. Applied and Enviromental Microbiology. 2010;76(13):4557-4559.
- Babaei, M.; Sulong, A.; Hamat, R.; Nordin, S.; Neela, V.. Extremely high prevelence of antiseptic resistant quaternary ammonium compound E gene among clinical isolates of multiple drug resistant Acinetobacter baumannii in Malaysia. Annals of Clinical Microbiology and Antimicrobials. 2015;14(1):11.
- Liu, L.; Qu, X.; Xia, Q.; Wang, H.; Chen, P.; Li, X.; et al. Effect of Lactobacillus rhamnosus on the antioxidant activity of Cheddar cheese during ripening and under simulated gastrointestinal digestion. LWT. 2018;95:99-106.
- Kampf, G.. “Sodium Hypochlorite”. In: Antiseptic Stewardship. Springer International Publishing. 2018;161-210.
- Köhler, A. T.; Rodloff, A. C.; Labahn, M.; Reinhardt, M.; Truyen, U.; Speck, S. Efficacy of sodium hypochlorite against multidrug-resistant Gram-negative bacteria. Journal os Hospital Infection. 2018;100(3):e40-e46
- FDA – Food and Drug Administration. Code of Federal Regulations. Title 21, 3, 21CFR178.1010, Part 178: Indirect food additives: Adjuvants, productions aids, and sanitizers, Subpart B: Substances utilized to control the growth of microorganisms. Sec. 178.1010, Sanitizing solutions. 2019.
- Fernandes, L. M.; Ramos, G. L. P. A.; Malta, R. C. R.; Nascimento, J. D. S. Tolerance of foodborne Acinetobacter spp. to sanitizer agents. J Infect Dev Ctries. 2022;16(12):1845-1851.
