
FRUTO DA CASTANHOLA: ESTUDO DE SEUS COMPOSTOS BIOATIVOS EM DIFERENTES ESTÁDIOS DE MATURAÇÃO
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-75
Este trabalho foi escrito por:
Yasmin Jaine Alves de Lucena*; Alison dos Santos Oliveira; Juvêncio Olegário de Oliveira Neto; Maíra Felinto Lopes; Vitória Larissa Melquíades da Silva
*Autor correspondente – E-mail: [email protected]
Resumo: No Brasil, existem muitas espécies frutíferas que apresentam potencial para a alimentação humana, entretanto, ainda pouco exploradas, daí a importância da comunidade acadêmica para embasar e confirmar tais características. Entre essas espécies, destaca-se a castanhola (Terminalia catappa), a mesma possui uma polpa carnosa, contendo em seu interior uma semente arredondada oleaginosa, envolvida por uma casca muito dura. A coloração do fruto varia do verde ao amarelo e vermelho a depender do estágio de maturação e é utilizado na alimentação humana na sua forma in natura. Primeiramente, fez-se a obtenção da polpa do fruto em diferentes estágios de maturação e observou-se os seguintes compostos bioativos: antocianinas e flavonóides, clorofilas e carotenoides, betalaínas, taninos, compostos fenólicos por extração em meio aquoso e alcóolico. Os dados das análises foram submetidos à análise de variância (ANOVA) e em caso de significância estatística para o teste F, as médias dos tratamentos foram comparadas pelo teste de Tukey (p≤0,05). Diante disso, o objetivo desse trabalho foi avaliar os compostos bioativos dos frutos da Terminalia catappa em diferentes estágios de maturação. Conclui-se que os diferentes estágios de maturação influenciam diretamente na composição e teor desses compostos presentes no fruto, fator determinante na escolha dos mesmos para aplicação em áreas da indústria alimentícia como produção de bebidas, produtos de panificação, doces e cremes.
Palavras–chave: Terminalia catappa; fruta; compostos fenólicos
Abstract: In Brazil, there are many fruit species that have potential for human consumption, however, still little explored, hence the importance of the academic community to support and confirm such characteristics. Among these species, the castanet (Terminalia catappa) stands out, it has a fleshy pulp, containing inside a rounded oleaginous seed, surrounded by a very hard shell. The color of the fruit varies from green to yellow and red depending on the stage of maturation and is used in human food in its in natura form. First, the pulp of the fruit was obtained at different stages of maturation and the following bioactive compounds were observed: anthocyanins and flavonoids, chlorophylls and carotenoids, betalains, tannins, phenolic compounds by extraction in aqueous and alcoholic media. The analysis data were submitted to analysis of variance (ANOVA) and in case of statistical significance for the F test, the treatment means were compared using the Tukey test (p≤0.05). Therefore, the objective of this work was to evaluate the bioactive compounds of Terminalia catappa fruits at different stages of maturation. It is concluded that the different stages of maturation directly influence the composition and content of these compounds present in the fruit, a determining factor in their choice for application in areas of the food industry such as the production of beverages, bakery products, sweets and creams.
Key Word: Terminalia catappa; fruit; phenolic compounds
INTRODUÇÃO
No Brasil, existem muitas espécies frutíferas que apresentam benefícios para a alimentação humana com potenciais nutritivos e ação antioxidante, entretanto pouco exploradas, daí a importância das pesquisas para constatar fontes de compostos nutricionais e funcionais em diferentes espécies e estágios de maturação, especialmente pela presença de compostos bioativos que desempenham ação preventiva de doenças na saúde humana (1);(2).
A Terminalia catappa pertencente à família Combretaceae, é típica de regiões tropicais e subtropicais e muito utilizada na zona urbana para arborizar ambientes. Apesar de seu país de origem ser a Índia, chegou à América do Sul com propósito de reflorestamento e, atualmente, é comum na região do litoral brasileiro. O seu tronco pode ter formato reto ou torto, podendo variar de 25 a 45 m de altura e 50 a 150 cm de diâmetro, e sua safra ocorre normalmente entre os meses de novembro a março (3;4).

Figura 1 – Árvore de Terminalia catappa presente no distrito industrial de Campina Grande/PB
Os frutos da castanhola possuem uma polpa carnosa, contendo em seu interior uma semente arredondada e rica em óleo, envolvida por uma casca muito dura. A coloração do fruto varia do verde ao amarelo e vermelho a depender do estágio de maturação. São comestíveis, ricos em proteínas e lipídios e são utilizados na alimentação humana. A pigmentação natural presente no fruto da castanhola indica a presença de antocianinas, componentes de natureza fenólica, pertencentes ao grupo dos flavonóides, que apresentam atividade antioxidante. Os flavonóides possuem um papel fundamental na habilidade para capturar radicais livres e, assim, promover a prevenção de doenças crônicas, como o câncer e as doenças cardiovasculares (5).
Os atributos de composição físico-químicas dos frutos de castanhola são determinadas por seu estado de maturação, o percentual de compostos em macro e micronutrientes, elementos reguladores como as vitaminas, seu teor de água e o conteúdo de compostos bioativos são diretamente relacionados ao estado de evolução do fruto, que também tem influências direta das condições climáticas, intimamente associado a exposição ao sol, índice pluviométrico e umidade (6).
Compostos bioativos são substâncias orgânicas que podem ser adquiridas de plantas (frutas, vegetais e grãos) e/ou seus coprodutos, ou ainda, produzidos durante o processamento de alimentos, sendo capazes de regular diferentes atividades biológicas no organismo e trazendo benefícios a saúde com efeitos anti-inflamatório, antitumoral e antidiabético (7).
A castanhola já vem sendo analisada e utilizada para promover efeitos anti-inflamatórios, em virtude de suas propriedades antioxidantes que estão relacionadas aos flavonoides, polifenóis e taninos (8). Diante disso, o objetivo desse trabalho foi avaliar os compostos bioativos dos frutos da castanhola em diferentes estágios de maturação.
MATERIAL E MÉTODOS
O trabalho foi executado no Laboratório de Tecnologia de Produtos de Origem Vegetal do Centro de Ciências e Tecnologia de Alimentos da Universidade Federal de Campina Grande, campus Pombal-PB.
Obtenção da polpa
Os frutos da castanhola foram colhidos de plantas localizadas na cidade de Campina Grande, no estado da Paraíba em quatro estágios de maturação: verde (estágio 1), de vez (estágio 2), parcialmente maduro (estágio 3) e totalmente maduro (estágio 4). Essa seleção está relacionada a coloração da casca, uma vez que os frutos do estágio 1 apresentavam a cor da casca verde, os do estágio 2, a cor verde amarelada, os do estágio 3 uma cor amarelo arroxeada e os do estágio 4, totalmente arroxeada (vináceo). Em seguida foram acondicionados em caixas plásticas e transportados para o laboratório. Após a chegada, realizou-se a higienização dos frutos por imersão em água clorada (100 ppm) durante 15 minutos e posterior enxágue em água corrente para retirar o excesso da solução de hipoclorito. Em seguida, os frutos tiveram seu caroço extraído por meio de descasque manual com o uso de faca, para que apenas a polpa fosse submetida ao Extrator de Suco Mondial Turbo Juicer Premium CF-06 para se obter a polpa mais líquida. Após obtenção da polpa do fruto em diferentes estágios de maturação, as amostras foram analisadas quanto aos seus compostos bioativos, cujas metodologias estão expressas a seguir.
Compostos fenólicos e Taninos
Os compostos fenólicos (utilizando como padrão o ácido gálico) e taninos (utilizando como padrão ácido tânico) foram determinados pelo método de Folin-ciocalteau descrito por Waterhouse (9). Inicialmente, obteve-se a curva padrão e a equação da reta. Para os compostos fenólicos foi feita a extração por meio aquoso e taninos, pesou-se 0,5 g de amostra adicionando-se 25 mL de água aos poucos, macerando bem. Após essa etapa de extração, em tubos de ensaio, adicionou-se uma alíquota de cada amostra, a água e o reagente Folin-ciocalteau (na parede do tubo e em água gelada) seguido de agitação e repouso por 5 minutos. Após o tempo de reação, adicionou-se 250 uL do carbonato de sódio, seguido de nova agitação e repouso em banho maria a 40ºC por 30 minutos. Ao esfriar, realizou-se a leitura das amostras em espectrofotômetro em um comprimento de onda de 765 nm. Diferentemente dos aquosos, para a fase inicial de extração dos compostos fenólicos alcóolicos, o procedimento foi pesar 1 g da amostra (em tubo de Falcon de 15 mL), adicionar 4 mL de metanol 50% e homogeneizar em vortex, deixando em repouso por 60 minutos a temperatura ambiente. Em seguida, centrifugou-se por 15 minutos a 15.000 rpm e transferiu-se o sobrenadante para outro tubo. A partir do resíduo da primeira extração, adicionou-se 4 mL de acetona 70%, homogeneizou-se em vortex deixando em repouso por 60 minutos, depois, centrifugou-se novamente por 15 minutos e transferiu-se o novo sobrenadante para o tubo que já continha o primeiro, finalizando com a adição de 2 mL de água destilada. Após esse processo de extração, a análise seguiu a sequência de etapas descritas anteriormente.
Antocianinas e flavonóides
A determinação de antocianinas e flavonóides foi realizada pelo método de Francis (10), pesando-se 1g de amostra, adicionando-se em seguida, 10 mL da solução de Etanol-HCl. Logo após, foi realizada a mistura durante 1 minuto, a qual foi recolhida em um tubo recoberto por papel alumínio e guardada na geladeira por 24 horas. Após esse período, a mistura foi filtrada em papel de filtro e completou-se o volume do tubo para 10 mL com a solução de etanol-HCl. Em seguida, realizou-se a leitura das amostras em espectrofotômetro em um comprimento de onda de 374 nm para flavonóides e 535nm para antocianinas.
Betalaínas
As betalaínas (betacianinas e betaxantinas) foram determinadas de acordo com Castellar et al. (11). Os extratos foram preparados utilizando a proporção etanol:água (80:20) como solução de extração. As amostras foram pesadas, cerca de 1g e maceradas em 10 mL de etanol 80%, sendo agitadas e armazenadas em geladeira por 24 h. Após isso, as amostras foram centrifugadas a 3.500 rpm durante 10 minutos a 24 °C. Depois, reservou-se o sobrenadante em uma proveta e adicionou-se ao resíduo mais 10 mL de etanol 80%, que foi submetido ao mesmo procedimento descrito anteriormente. Os dois sobrenadantes foram combinados na mesma proveta e o volume final ajustado para 25 mL com etanol 80%, sofrendo uma nova agitação. Ao final, realizou-se a leitura dos sobrenadantes em espectrofotômetro em um comprimento de onda de 535 nm e 480 nm, para betacianinas e betaxantinas, respectivamente.
Clorofila e carotenoides totais
A determinação de clorofila e carotenoides se deu pelo método de Lichtenthaler (12), pesando-se cerca de 200 mg de amostra, colocando-a em um almofariz, ao qual foi adicionado 0,2 g de carbonato de cálcio (CaCO3) mais cerca de 3 mL de acetona 80%, macerando bem. Em seguida, verteu-se o extrato em um tubo de centrífuga e lavou-se o resíduo do almofariz com 2 mL de acetona a 80%, completando o volume para 5 mL. Então, centrifugou-se por 10 minutos a 10ºC e 3000 rpm. Após essa etapa, verteu-se o sobrenadante para uma proveta de 10 mL e observe o volume. Ao final, realizou-se a leitura de uma alíquota em espectrofotômetro nos comprimentos de onda de 470, 646 e 663 nm.
Análise estatística
O experimento foi conduzido em delineamento inteiramente casualizado com três tratamentos e três repetições. Os dados das análises foram submetidos à análise de variância (ANOVA) e em caso de significância estatística para o teste F, as médias dos tratamentos foram comparadas pelo teste de Tukey (p≤0,05). Para a estatística dos dados, utilizou-se o programa ASSISTAT versão 7.7 pt.
RESULTADOS E DISCUSSÃO
Os resultados obtidos na identificação dos compostos bioativos das polpas nos diferentes estágios de maturação estão apresentados na Tabela 1.
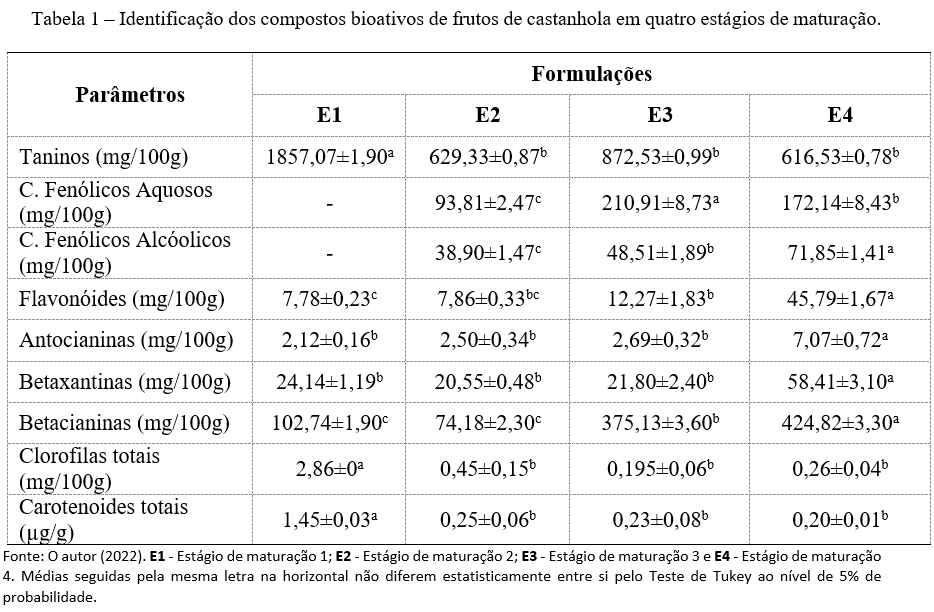
Os taninos são compostos de sabor adstringente encontrados em várias partes dos vegetais principalmente nas suas cascas e sementes, úteis na proteção contra possíveis pragas, pois contém odor repulsivo e alta capacidade de causar intoxicações em animais (13). Nota-se um valor muito elevado na polpa de castanhola no estágio de maturação 1 (1857,07 mg/100g), o que era esperado, já que geralmente quanto mais verde o fruto, mais adstringente, consequentemente maior o teor de taninos a medida que vai amadurecendo resultando numa menor concentração de ácido tânico em E4, estado máximo de maturação onde o fruto atinge o ápice do desenvolvimento aumentando os teores de açúcares e reduzindo sua adstringência e quantidade de ácido tânico (13).
Quanto aos compostos fenólicos totais por extração aquosa e alcoólica, observa-se que os valores diferiram estatisticamente entre si (p<0,05) para todos os extratos. Nos fenólicos aquosos, o tratamento E3 apresentou a maior média, com 210,91 mg EAG/100g, seguido dos tratamentos E4 e E2 com 172,14 e 93,81 mg EAG/100g, respectivamente. Já o extrato alcoólico o tratamento E4 apresentou o maior valor com 71,85 mg EAG/100g, seguido do tratamento E3 com 48,51 mg EAG/100g e do tratamento E2 com 38,90 mg EAG/100g. É possível observar que os extratos aquosos apresentaram maior valor de fenólicos totais que se assemelham ao trabalho de Silva et al. (14) que avaliando a extração de compostos fenólicos por extração aquosa e alcóolica do fruto da mangaba observaram que a extração aquosa apresentou valor superior quando comparada a extração alcoólica.
A polpa E4 obteve os maiores valores para antocianinas e flavonoides, isso acontece, pois coloração arroxeada intensa presente no fruto da castanhola pode ser resultante dessa forte presença das antocianinas, um componente fenólico de atividade antioxidante pertencente ao grupo dos flavonoides que têm um papel fundamental na habilidade para capturar radicais livres e, assim, promover a prevenção de várias doenças. Assim, à medida que a polpa de castanhola vai amadurecendo ela vai mudando de uma coloração esverdeada passando pelo amarelo até um roxo intenso quando madura.
Foram verificados valores elevados de 58,41 e 424,82 mg/100g, para betacianinas e betaxantinas, respectivamente em E4, justamente por esta apresentar uma pigmentação roxa mais forte se comparada às demais. A presença dessas substâncias são responsáveis por propiciar uma coloração atraente e forte valor nutricional, no entanto elas são altamente instáveis, podendo ser perdidas na presença de luz e pH (15).
Em relação aos teores de clorofilas totais para os quatro estágios de maturação avaliados, observa-se que apenas a amostra E1 diferiu significativamente das demais (p<0,05), apresentando maior média com valor de 2,86 mg/100g. Os outros estágios obtiveram médias menores, com valores entre 0,19 a 0,45 mg/100g. Silva (16), ao avaliar os compostos bioativos de castanhola verde, obteve valor de 7,830 mg/100g, resultado superior ao encontrado no presente estudo. O estágio de maturação em que o fruto se encontra verde, há uma maior concentração de clorofilas quando comparados com os estágios mais maduros. Os carotenóides estão presentes nos cloroplastos e podem ser camuflados pela presença de outros pigmentos clorofilinos, devido isso, apesar de presentes em maior quantidade no estádio verde, não são percebidos com facilidade, já que a clorofila é o pigmento que predomina. Porto (17).
Analisando os estágios estudados para o parâmetro de carotenoides totais, a amostra E1 diferiu estatisticamente das demais (p<0,05) e apresentou maior média com valor de 1,45 µg/g. As outras amostras não diferiram entre si e obtiveram valores entre 0,25 a 0,20 µg/g. A medida que o fruto amadurece e a clorofila vai se degradando, os carotenóides tornam-se mais visíveis em tons que variam do amarelo alaranjado ao vermelho. De acordo com Lima et al., (18), os carotenóides são pigmentos naturais nos alimentos, alguns representantes dessa classe atuam como precursores da vitamina A e apresentam função regulatória e alta capacidade antioxidante; dado a essa função eles têm sido associados à prevenção de neoplasias, ao aumento da atividade do sistema imunológico, além de estarem relacionados à prevenção da maioria das Doenças Crônicas Não Transmissíveis (DCNTs).
CONCLUSÕES
Diante do exposto, esse estudo fornece informações a respeito dos quatro estágios de maturação do fruto da castanhola, onde foi possível observar que o fruto do E1 e E2 possui coloração variando de verde e amarela, quanto as antocianinas, flavonoides, betacianinas e betaxantinas o E4 apresentou maiores médias devido a sua coloração mais roxa, para os compostos fenólicos aquosos e alcóolicos as amostras E3 e E4 apresentaram maiores valores. Dessa forma, conclui-se que os diferentes estágios de maturação influenciam diretamente na composição e teor desses compostos presentes no fruto, fator determinante na escolha dos mesmos para aplicação em áreas distintas da indústria alimentícia como a área de bebidas, panificação, doces, cremes entre outros, mostrando assim o seu potencial.
REFERÊNCIAS
- Serra, J.L.; Rodrigues, A.M.C.; Freitas, R.A.; Meirelles, A.J.A.; Darnet, S.H.; Silva, L.H.M. Alternative sources of oils and fats from Amazonian plants: fatty acids, methyl tocols, total carotenoids and chemical composition. Food research international. Maranhão, v.116, n.1, p.12-19, 2019.
- Teixeira, N; Mello, J. C. S; Fronza, P.; Batista, L.F.; Paula-Souza, J.; Brandão, M.G.L. Edible fruits from Brazilian biodiversity: a review on their sensorial characteristics versus bioactivity as tool to select research. Food research international. Minas Gerais, v.119, n.1, p.325-48, 2019.
- Katiki, L. M., Gomes, A. C. P., Barbieri, A. M. E., Pacheco, P. A., Rodrigues, L., Veríssimo, C. J., Gutmanis, G., Piza, A. M., Louvandini, H., Ferreira, J. F. S. Terminalia catappa: chemical composition, in vitro and in vivo effects on Haemonchus contortus. Veterinary Parasitology, v. 246, p. 118-123, 2017.
- Marques, M. R., Paz, D. D., Batista, L. P. R., Barbosa, C. D. O., Araújo, M. A. M., Moreira-Araújo, R. S. D. R. An in vitro analysis of the total phenolic content, antioxidant power, physical, physicochemical, and chemical composition of Terminalia Catappa Linn fruits. Food Science and Technology, v. 32, n. 1, p. 209-213, 2012.
- Uchida, V. H.; Miguel, T. B. V.; Mata, A. L. M.; Duarte, M. M. L. Análise por planejamento experimental dos fatores que influenciam a extração do corante da castanhola: Universidade Federal Do Rio Grande Do Norte, Programa De Pós-Graduação Em Engenharia Química. XX Congresso Brasileiro de Engenharia Química: Engenharia e Tecnologia de Alimentos, Florianópolis/SC, p. 1-8, 2014.
- Merelo, P.; Agustí, J.; Arbona, V.; Costa, M.; Estornell, L.H.; Gómezcadenas, A.; Coimbra, S.; Gómez, M.D.; Pérez-Amador, M.A.; Domingo, C.; Talón, M.; Tadeo, F.R. Cell wall remodeling in abscission zone cells during ethylene-promoted fruit abscission in citrus. Frontiers in Plant Science, v.8, p.1-20, 2017.
- Galanakis, C. M. Introduction. In C. M. Galanakis (Ed.), Nutraceutical and functional food components. Effects of innovative processing techniques, p. 1 – 14. London: Elsevier, 2017.
- Silva, L. P., de Angelis, C. D., Bonamin, F., Kushima, H., Mininel, F. J., Dos Santos, L. C., Delella, F. K., Felisbino, S. L., Vilegas, W., Rocha, L. R. M., Ramos, M. A. S., Bauab, T. M., Toma, W., Hiruma-Lima, C. A. Terminalia catappa L.: A medicinal plant from the Caribbean pharmacopeia with anti-Helicobacter pylori and antiulcer action in experimental rodent models. Journal of Ethnopharmacology, v. 159, p. 285-295, 2015.
- Waterhouse, A. Folin-ciocalteau micro method for total phenol in wine. American Journal of Enology and Viticulture, p.3-5, 2006.
- Francis, F. J. Analysis of anthocyanins. In: MARKAKIS, P. (Ed.). Anthocyanins as Food color. New York: Academic Press, 1982, p. 181-207.
- Castellar, M. R.; Solano, F.; Obón, J. M. Betacyanin and other antioxidants production during growth of Opuntia stricta (Haw.) fruits. Plant Foods Human Nutrition, v.67, n.4, p.337-343, 2012.
- Miller, G. L. Use of dinitrosalicylic acid reagente for determination of reducing sugar. Analytical Chemistry, v. 31, n. 3, p. 426-428, 1959.
- Rocha, W. S., Lopes, R. M., Silva, D. B. D., Vieira, R. F., Silva, J. P. D., & Agostini-Costa, T. D. S. Compostos fenólicos totais e taninos condensados em frutas nativas do cerrado. Revista Brasileira de Fruticultura, v. 33, p. 1215-1221, 2011.
- Silva, M. E. C.; Santos, E. B. S.; De Carvalho Marques, G. E.; Brandão, C. M.; & Cardoso, D. V. V. Hancornia speciosa Gomes: caracterização química, compostos bioativos e atividade antioxidante Hancornia speciosa Gomes: chemical characterization, bioactive compounds and antioxidant activity. Brazilian Journal of Development, v. 8, n. 3, p. 16439-14452, 2022.
- Priatni, S.; Pradita, A. Stability study of betacyanin extract from red dragon fruit (Hylocereus polyrhizus) peels. Procedia Chemistry, v. 16, p. 438-444, 2015.
- Silva, Gerbson Vicente de Andrade. Compostos bioativos e avaliação centesimal da farinha da castanhola (Terminalia catappa Linn.). 2018. 38 f. TCC (Graduação) – Curso de Engenharia de Alimentos, Centro de Ciências e Tecnologia Agroalimentar Unidade Academica de Tecnologia de Alimentos Curso de Graduação em Engenharia de Alimentos, Universidade Federal de Campina Grande, Pombal -PB, 2018.
- PORTO, R. G. C. L. Influência do estágio de maturação no teor de compostos bioativos e atividade no cajuí (Anacardium humile St. Hill) e castanhola (Terminallia catappa L.) – Dissertação (Mestrado) – Universidade Federal do Piauí. Programa de pós-graduação em Alimentos e Nutrição – Teresina, 2014.
- Lima, Juliana Pinto de; LOPES, Cristiane de Oliveira; DIAS, Nayane Aparecida Araújo; PEREIRA, Michel Cardoso de Angelis. Atividade e Biodisponibilidade dos Carotenóides no Organismo: activity and bioavailability of carotenoids in body. Revista Ciências em Saúde, Lavras – Mg, v. 2, p. 1-9, 01 jan. 2012.
Tag:CBPAV


