COMPOSTOS FENÓLICOS EM NOZ PECAN: UMA REVISÃO
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-53
Este trabalho foi escrito por:
Tatiane Jéssica Siebeneichler*
Pós-Graduação em Ciência e Tecnologia de Alimentos (PPGCTA) – (UFPel)
*Autor correspondente (Corresponding author) – Email: [email protected]
Resumo: A noz pecan é um fruto seco reconhecido como fonte de gorduras mono e poli-insaturados e compostos bioativos. Dentre os bioativos, os compostos fenólicos são os principais responsáveis pela alta atividade antioxidante em nozes e possuem inúmeras atividades biológicas comprovadas. Considerando a importância dos compostos fenólicos, o presente trabalho apresenta uma revisão sobre os fenólicos identificados e quantificados em nozes pecan e as atividades biológicas relacionadas. De acordo com os resultados, os compostos fenólicos podem estar em formas livres ou complexadas a açúcares. A composição depende de uma série de fatores intrínsecos (cultivares, estádio de amadurecimento) e extrínsecos (agronômicos, ambientais), além da forma como são processadas e armazenadas. A torrefação da noz reduziu os níveis de ácido 3,4-dihidroxibenzóico, 1,2-dihidroxibenzeno, ácido siríngico, catequina, rutina, ácido p-cumárico, ácido trans-ferúlico, quercetina, ácido trans-cinâmico e kaempferol. Diversas atividades biológicas já foram testadas com os compostos presentes em pecan, a maior parte estão associados com atividade antioxidante, propriedades antimicrobianas, anti-inflamatórias, antitumorais e cardioprotetoras. Embora pesquisas ainda sejam necessárias, há um consenso de que há altos níveis de compostos fenólicos em noz pecan e estudos com esses compostos demostram importantes benefícios para saúde humana.
Palavras–chave: compostos bioativos; polifenóis; nogueira pecan
Abstract: The pecan nut is a dried fruit recognized for its health benefits. These benefits are mainly attributed to the lipid composition and bioactives. Among the bioactives, phenolic compounds are the main responsible for the high antioxidant activity in nuts and have numerous proven biological activities. Considering the importance of phenolic compounds, the present work presents a review on the phenolics identified and quantified in pecan nuts and the related biological activities. According to the results, the phenolic compounds can be in free forms or complexed with sugars. The composition depends on a series of intrinsic (cultivars, ripening stage) and extrinsic (agronomic, environmental) factors, in addition to the way they are processed and stored. Pecan roasting reduced the levels of 3,4-dihydroxybenzoic acid, 1,2-dihydroxybenzene, syringic acid, catechin, rutin, p-coumaric acid, trans-ferulic acid, quercetin, trans-cinnamic acid and kaempferol. Several biological activities have already been tested with compounds present in pecan, most of which are associated with antioxidant activity, antimicrobial, anti-inflammatory, antitumor and cardioprotective properties. Although research is still needed, there is a consensus that there are high levels of phenolic compounds in pecan nut and studies with these compounds show important benefits for human health.
Key Word: bioactive compounds; polyphenols; pecan
INTRODUÇÃO
A nogueira pecan [Carya illinoinensis (Wangenh) K. Koch] é uma espécie originária da América do norte e até hoje essa região é a maior produtora. No último século, os emigrantes estadunidenses introduziram a espécie em outros locais do planeta, ajudando a difundir e aumentar a produção dessa noz. O Sul do Brasil tem se destacado na produção de noz pecan em virtude do incremento anual de novos pomares favorecidos pela adaptação edafoclimática e pelo estímulo do consumo (1–3).
A noz pecan é reconhecida como uma fonte rica em ácidos graxos monoinsaturados e poli-insaturados (1–3). Os benefícios da ingestão desses ácidos graxos estão relacionados, principalmente, aos fatores de risco de doenças cardiovasculares, como níveis de colesterol, lipoproteína de baixa densidade e alta densidade, níveis de triacilgliceróis e demais perfis de lipoproteínas (4–6). Além da composição lipídica, a noz também possui compostos bioativos interessantes, com destaque para os compostos fenólicos. Em um estudo com mais de 100 alimentos consumidos rotineiramente nos Estados Unidos, descobriram que a noz pecan possui o maior teor de compostos fenólicos totais e maior capacidade antioxidante entre o grupo de nozes e superior a muitas frutas e legumes (7).
A forte capacidade antioxidante da pecan se deve pelo teor de compostos fenólicos presentes. Os fenólicos são moléculas capazes de neutralizar radicais livres para reduzir o risco de doenças crônicas, incluindo câncer, diabetes, doenças cardiovasculares. Diversos estudos identificaram e quantificaram ácidos fenólicos, flavonoides, proantocianidinas e taninos em noz pecan. Considerando a importância dos compostos fenólicos, o presente trabalho apresenta uma revisão sobre os fenólicos identificados e quantificados em nozes pecan e as atividades biológicas relacionadas.
METODOLOGIA
Para o desenvolvimento desta revisão foi realizada uma pesquisa bibliográfica nas plataformas de busca Science Direct, Scopus e Google Schoolar, utilizando as seguintes palavras: “pecan” “phenolic” “Carya illinoinensis”. Os critérios de exclusão foram: com temática discordante e estudos sem identificação dos compostos fenólicos.
COMPOSTOS FENÓLICOS EM NOZ PECAN
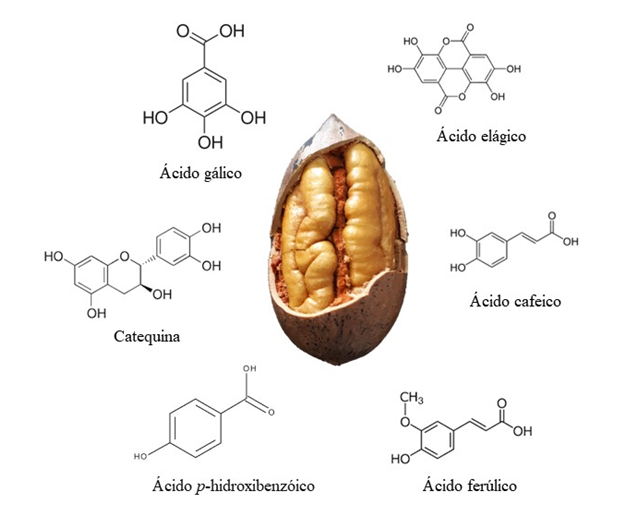
Os compostos fenólicos compõem um grupo quimicamente heterogêneo, são distribuídos em ácidos fenólicos, cumarinas, flavonoides, estilbenos, taninos e lignanas(8). A estrutura química é caracterizada por conter um anel aromático contendo uma ou mais hidroxilas. São classificados em fenóis simples ou em polifenóis, dependendo do número de unidades fenólicas (Figura 1) (9).
Na natureza, os compostos fenólicos normalmente ocorrem conjugados com mono e polissacarídeos. São sintetizados por plantas como forma de defesa contra patógenos, herbívoros ou condições ambientais adversas, por exemplo, radiação ultravioleta, déficit hídrico, temperaturas extremas (calor ou frio) e excesso de salinidade no solo, ou até mesmo danos físicos. Eles conferem sabor amargo devido à sua interação com a glicoproteína salivar e agregam cor aos vegetais.
Os primeiros estudos em pecan identificaram um pequeno número de compostos fenólicos, majoritariamente ácidos gálico, elágico e p-hidroxibenzóico (10). Os avanços das metodologias de extração e o uso de cromatografia de alta eficiência associada a detectores DAD, MS ou MS∕MS têm possibilitado a identificação de um grande número de compostos fenólicos. Os principais compostos fenólicos encontrados em noz pecã são: o ácido hidroxibenzóico, ácido elágico, ácido gálico, ácidos hidroxicinâmicos e derivados desses ácidos (Figura 1). Além desses foram identificados flavonoides, antocianidinas e taninos (Tabela 1). Esses compostos estão listados na Tabela 1 e as vias biossintéticas dos principais compostos estão resumidas em um esquema biossintético na Figura 2. Essa composição pode sofrer alterações dependendo da cultivar avaliada, das condições climáticas, técnicas de cultivo e localização geográfica em que a nogueira foi cultivada (11–13). Além desses fatores, foi observado que durante os estádio de desenvolvimento e amadurecimento, o perfil e os níveis de compostos fenólicos são dinâmicos na noz pecan. Por exemplo, a catequina foi o fenólico mais abundante em nozes imaturas, seguido de epicatequina, ácido elágico e ácido gálico, mas à medida que a noz amadureceu os níveis desses fenólicos diminuíram (12). Esta queda pode ser atribuída à sua conversão em outras formas a jusante, como formas esterificadas ou glicosiladas, juntamente com o desenvolvimento da pecan. Além disso, a catequina pode converter-se em moléculas maiores e mais complexas, como proantocianidinas e proantocianidinas oligoméricas (12).
A aplicação de processamento térmico, como a torrefação, é muito comum em nozes e castanhas, pois desenvolve características sensoriais apreciadas pelos consumidores. O aumento da temperatura ativa reações químicas que geram compostos responsáveis pelo sabor, cor e aroma característicos. Entretanto, o aumento da temperatura também pode provocar a perda de compostos de interesse, como de compostos fenólicos, que em geral, são mais instáveis a altas temperaturas. Em pecan, a torrefação em forno convencional e micro-ondas causou o decréscimo dos teores de ácido 3,4-dihidroxibenzóico, 1,2-dihidroxibenzeno, ácido siríngico, catequina, rutina, ácido p-cumárico, ácido trans-ferúlico, quercetina, ácido trans-cinâmico e kaempferol (14). A torrefação por forno a partir de 70 ºC durante 1h causou reduções significativas de alguns compostos fenólicos. De modo geral, essas perdas foram intensificadas em temperaturas superiores a 130 ºC. Por outro lado, os níveis de ácido gálico aumentaram com o tratamento térmico, principalmente em micro-ondas a 520 W (14). Esse aumento de ácido gálico pode estar relacionado com a clivagem de galotaninos.
Fenólicos de pecan são geralmente encontrados em maior concentração na película que recobre a noz e podem estar associados a outros componentes, como carboidratos e proteínas. A força da ligação de fenólicos aos carboidratos aumenta à medida que o número de grupos de OH nas moléculas de polifenóis aumenta. Além disso, polifenóis de alto peso molecular estão frequentemente envolvidos em complexos com proteínas (15). Por essas condições, a escolha do método de extração dos compostos é fundamental para obter uma extração eficaz.
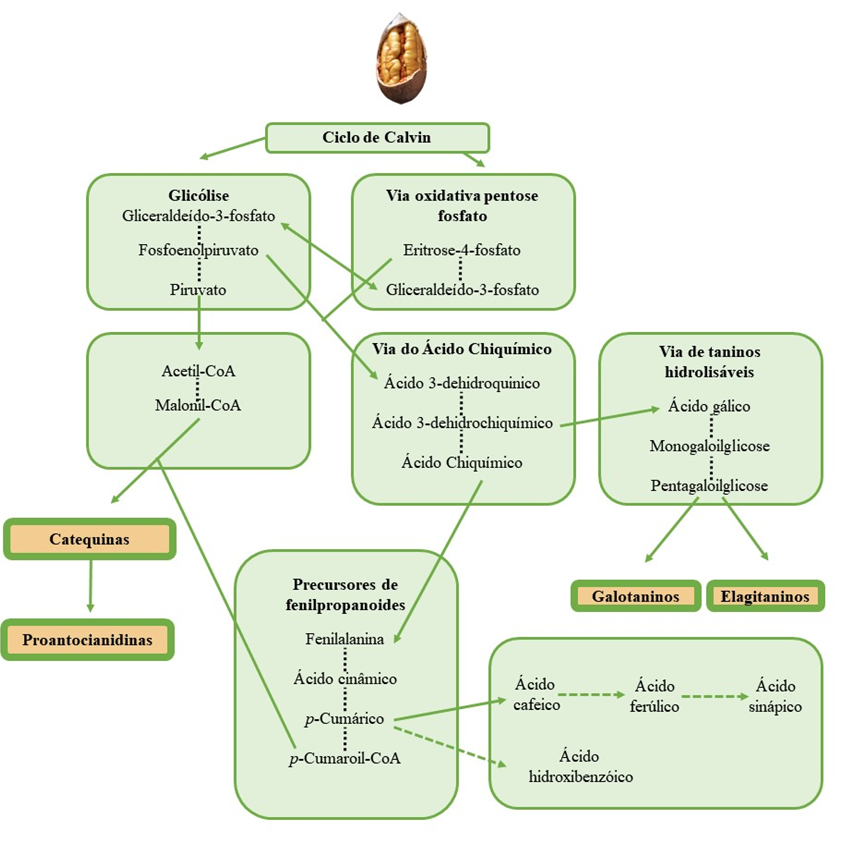
Tabela 1 – Compostos fenólicos quantificados em noz pecan
| Compostos | Quantificação | Referências |
| Ácido hidroxibenzóico e derivados | ||
| p-hidroxibenzóico | 29,0-90,1 µg g-1 | La Rosa et al., (2011) (10) |
| 28,64-49,16 µg g-1 | Robbins et al., (2015) (17) | |
| 3,0 µg g-1 | Gong & Pegg, (2017) (18) | |
| Ácido protocatecuico | 13,3-30,5 µg g-1 | La Rosa et al., (2011) (10) |
| 20,99-24,08 µg g-1 | Robbins et al., (2015) (17) | |
| 14,46-32,71 mg 100 g-1 | Juhaimi et al., (2017) (14) | |
| Ácido protocatecuico-hexosídeo | 3,3 µg g-1 | Gong & Pegg, (2017) (18) |
| Ácido gálico | 189-274,5 µg g-1 | La Rosa et al., (2011) (10) |
| 7,6 µg g-1 | Gong & Pegg, (2017) (18) | |
| 11,8-34,9 mg 100 g-1 | Juhaimi et al., (2017) (14) | |
| 11,9-27,67 µg g-1 | Bouali et al., (2020) (19) | |
| 0,13-0,24 mg g-1 | Rodrigues et al., (2022) (20) | |
| Ácido siríngico | 6,58-10,76 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Derivados de ácido gálico | ||
| Monogaloil hexosídeo | 4,6-10,4 µg g-1 | Gong & Pegg, (2017) (18) |
| Digaloil hexosídeo | 0,3 µg g-1 | Gong & Pegg, (2017) (18) |
| 1,5 µg g-1 | Gong & Pegg, (2017) (18) | |
| Metil galato | 0,35 mg g-1 | Rodrigues et al., (2022) (20) |
| Ácido elágico e derivados | ||
| Ácido elágico | 4,6-5,5 µg g-1 | La Rosa et al., (2011) (10) |
| 32,1-132,0 µg g-1 | Robbins et al., (2015) (17) | |
| 86,4 µg g-1 | Gong & Pegg, (2017) (18) | |
| 154,01-291,45 µg g-1 | Bouali et al., (2020) (19) | |
| 0,89-1,07 mg g-1 | Rodrigues et al., (2022) (20) | |
| Ácido elágico-pentosideo | 5,86-9,30 µg g-1 | Robbins et al., (2015) (17) |
| 8,3 µg g-1 | Gong & Pegg, (2017) (18) | |
| 2,9 µg g-1 | Gong & Pegg, (2017) (18) | |
| Isômeros de metil e dimetil ácido elágico | 3,09-7,35 µg g-1 | Robbins et al., (2015) (17) |
| 4,8 µg g-1 | Gong & Pegg, (2017) (18) | |
| Ácido elágico metilado e glicosilado | 0,8-17,7 µg g-1 | Gong & Pegg, (2017) (18) |
| Derivados de ácido elágico-galoil | 5,81-8,46 µg g-1 | Robbins et al., (2015) (17) |
| 2,1 µg g-1 | Gong & Pegg, (2017) (18) | |
| Ácido elágico-galoil-pentosideo | 8,3-12,0 µg g-1 | Gong & Pegg, (2017) (18) |
| HHDP-hexosideos | 2,4-7,0 µg g-1 | Gong & Pegg, (2017) (18) |
| HHDP-galoil-hexosideos | 0,3-9,6 µg g-1 | Gong & Pegg, (2017) (18) |
| Ácido valoneico-dilactona | 7,71-262,4 µg g-1 | Robbins et al., (2015) (17) |
| 48,2 µg g-1 | Gong & Pegg, (2017) (18) | |
| (continua ) |
Tabela 1 – Continuação
| Compostos | Quantificação | Referências |
| Ácidos hidroxicinâmicos e derivados | ||
| Ácido p-cumárico | 0,73-1,26 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Ácido cafeico | 2,1 µg g-1 | Gong & Pegg, (2017) (18) |
| 6,27-8,48 mg 100 g-1 | Juhaimi et al., (2017) (14) | |
| Ácido cafeico hexosídeo | 4,19-6,74 µg g-1 | Robbins et al., (2015) (17) |
| Ácido ferúlico | 4,50-11,54 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Ácido sinapoilquínico | 11,71-14,71 µg g-1 | Robbins et al., (2015) (17) |
| Outros não-flavonóides | ||
| 1,2-di-hidroxibenzeno | 13,38-28,77 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Resveratrol | 1,21-3,11 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Flavonóides | ||
| Catequina | 10,6-82,3 µg g-1 | Robbins et al., (2015) (17) |
| 9,9 µg g-1 | Gong & Pegg, (2017) (18) | |
| 18,3-47,6 mg 100 g-1 | Juhaimi et al., (2017) (14) | |
| 128,11-231,55 µg g-1 | Bouali et al., (2020) (19) | |
| Epicatequina hexosideo | 10,7 µg g-1 | Gong & Pegg, (2017) (18) |
| Epicatequina | 2,8 µg g-1 | Gong & Pegg, (2017) (18) |
| 2,44-12,37 µg g-1 | Bouali et al., (2020) (19) | |
| Epicatequina-3-galato | 2,0-4,2 µg g-1 | Gong & Pegg, (2017) (18) |
| Polímeros de flavan-3-ols | ||
| Dimeros procianidina tipo B | 3,93-6,03 µg g-1 | Robbins et al., (2015) (17) |
| 1,3-31,42 µg g-1 | Gong & Pegg, (2017) (18) | |
| Dimeros procianidina tipo A | 4,47-8,49 µg g-1 | Robbins et al., (2015) (17) |
| 0,7-3,0 µg g-1 | Gong & Pegg, (2017) (18) | |
| Trimeros procianidina tipo B | 18,34 µg g-1 | Gong & Pegg, (2017) (18) |
| Tetrameros procianidina tipo B | 7,08 µg g-1 | Gong & Pegg, (2017) (18) |
| Pentameros procianidina tipo B | 5,53 µg g-1 | Gong & Pegg, (2017) (18) |
| Hexameros procianidina tipo B | 1,62 µg g-1 | Gong & Pegg, (2017) (18) |
| Heptameros procianidina tipo B | 0,41 µg g-1 | Gong & Pegg, (2017) (18) |
| Flavonóis | ||
| Kaempferol | 2,68-5,21 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Quercetina | 3,67-10,01 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Isorhamnetina | 1,67-4,55 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Rutina | 6,71-12,67 mg 100 g-1 | Juhaimi et al., (2017) (14) |
| Antocianidinas | ||
| Delfinidina | 0,14 mg g-1 | Rodrigues et al., (2022) (20) |
| Cianidina | 0,39 mg g-1 | Rodrigues et al., (2022) (20) |
| Peonidina | 0,04 mg g-1 | Rodrigues et al., (2022) (20) |
| (continua) |
Tabela 1 – Continuação
| Compostos | Quantificação | Referências |
| Fenóis totais | 12,57-23,52 mg GAE g−1 FW | Bouali et al., (2019) (19) |
| 11,70-12,50 mg GAE g−1 FW | La Rosa et al., (2011)(10) | |
| 1,72-2,20 mg g-1 | Rodrigues et al., (2022) (20) | |
| Flavonóides totais | 8,64-16,07 mg CE g−1 FW | Bouali et al., (2019) (19) |
| 5,80-6,40 mg CE g−1 FW | La Rosa et al., (2011) (10) | |
| Flavonóis totais | 3,16-6,33 mg CE g−1 FW | Bouali et al., (2019) (19) |
| Taninos condensados totais | 43,43-78,84 mg CE g−1 FW | Bouali et al., (2019) (19) |
| o-difenóis totais | 1,80-3,70 mg CAE g−1 FW | Bouali et al., (2019) (19) |
| Antocianidinas totais | 20,30-26,70 mg CE g−1 FW | La Rosa et al., (2011) (10) |
EXTRAÇÃO DE COMPOSTOS FENÓLICOS DE NOZ PECAN
A matriz da noz é complexa em termos de composição e devido à natureza dos complexos formados entre os compostos fenólicos com polissacarídeos e proteínas e diferenças de solubilidade, não há procedimento de extração universal adequado para a obtenção de todos os fenólicos em uma única extração. O extrato fenólico pode apresentar um certo grau de variabilidade no perfil de compostos e quantificação, dependendo das técnicas de extração e dos solventes utilizados (5,12,14,21–23). Nesse aspecto, a extração é determinada principalmente por fenômenos de solubilidade. Em geral, os compostos fenólicos naturais têm um alto número de locais doadores de hidrogênio e locais de aceitação de hidrogênio. Isso significa que eles podem estabelecer interações intermoleculares (atrações eletrostáticas e ligações de hidrogênio) com moléculas de solventes mostrando essas características (15).
O coeficiente de distribuição fornece uma medida de afinidade molecular entre solventes e compostos fenólicos. Por exemplo, os coeficientes de distribuição (valores de log D) da maioria dos compostos fenólicos e polifenóis presentes na noz pecan têm valores de log D baixos ou negativos (24). Isso indica que eles podem distribuir-se melhor na água (um solvente muito polar com uma alta constante dielétrica) do que em solventes não polares.
A presença de hidroxila na estrutura dos compostos fenólicos e na molécula de água favorece as solubilidades mútuas. Ademais, o aumento do número de hidroxilas presentes nos compostos fenólicos, em geral, aumenta a solubilidade em água. Como resultado, a maioria dos glicosídeos fenólicos são mais solúveis em água do que as agliconas correspondentes (15). Fenólicos também são solúveis em álcoois de baixo peso molecular, como metanol e etanol. Outros solventes orgânicos com capacidade de ligação de hidrogênio, também foram empregados para extração de compostos fenólicos de noz, o mais utilizado é acetona (10,12,21). A maioria dos estudos adotam misturas desses solventes. Recentemente um estudo de otimização de extração de compostos fenólicos obteve um extrato etanólico com altos teores de ácido elágico, para a otimização foi utilizada a metodologia de superfície de resposta. As condições ideais de extração foram com 40% de etanol, 85º C e 60 ml/g (20).
ATIVIDADES BIOATIVAS
O consumo de nozes tem sido associado a prevenção de doenças cardiovasculares e câncer. Esses benefícios são atribuídos, principalmente, à composição lipídica e de bioativos presentes na noz, ambos com comprovada biodisponibilidade em humanos (25).
Conforme revisado por Larrosa et al. (2010)(26) o ácido elágico e os elagitaninos, como aqueles presentes em pecan, podem desempenhar papéis importantes na prevenção de doenças cardiovasculares e mortalidade por câncer. Os mecanismos pelos quais o ácido elágico pode proteger contra essas doenças são diversas e incluem diminuição síntese de moléculas inflamatórias, e redução da expressão do fator nuclear κB (NF-κB), que é um fator de transcrição envolvido no controle da expressão de diversos genes ligados à resposta inflamatória. Estudos de digestibilidade mostram que os elagitaninos são hidrolizados durante o processo digestório e que as formas hidrolizadas, como o ácido elágico, são melhor absorvidas do que os elagitaninos (27).
Além desse grupo de compostos, o ácido gálico e seus derivados também são reconhecidos como bioativos, que fornecem diversos benefícios à saúde, incluindo antioxidante, anti-inflamatório e antineoplásicos (28). Da mesma forma, as procianidinas, abundantes em pecan, exibem atividades biológicas variadas: antioxidante, anticâncer, antiaterosclerose, melhora da vasodilatação, prevenção de diabetes, antiobesidade, prevenção da doença de Alzheimer, melhora da insônia, antivírus, neuroproteção e anti-inflamatório (29). Já os flavonoides, estão associados, principalmente, com atividade antioxidante, propriedades antimicrobianas, anti-inflamatórias, antitumorais e cardioprotetores (30).
CONCLUSÕES
Um grande número de compostos fenólicos foi identificado em noz pecan, o que se deve, principalmente, pelos avanços com o uso de cromatografia de alta eficiência associada a detectores DAD, MS ou MS∕MS. Entretanto, devido à complexidade da matriz, ainda não há um método de extração capaz de extrair todos os compostos simultaneamente. Embora pesquisas ainda sejam necessárias, há um consenso de que há altos níveis de compostos fenólicos em noz pecan e que esses compostos presentes aportam importantes benefícios para saúde humana.
AGRADECIMENTOS
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pelo apoio e concessão de bolsa.
REFERÊNCIAS
- Ribeiro SR, Ribeiro QM, Klein B, Santos ID dos, Forgiarini S, Hamann JJ, et al. Effect of low oxygen on quality attributes of ‘Barton’ pecan nuts after long-term storage at different temperatures. Sci Hortic (Amsterdam) [Internet]. 2020;263(December 2019):109098. Available from: https://doi.org/10.1016/j.scienta.2019.109098
- Ribeiro SR, Klein B, Santos ID dos, Thewes FR, Brackmann A, Both V, et al. Effects of controlled atmosphere and storage temperature on the quality of shelled ‘ Barton ’ pecan nuts during long-term storage. Food Res Int [Internet]. 2022;158(June):111498. Available from: https://doi.org/10.1016/j.foodres.2022.111498
- Thewes FR, Both V, Thewes FR, Brackmann A, Wagner R, Ribeiro SR, et al. Pecan storage: Effects of 1-MCP on the overall quality and volatile compounds profile of shelled and unshelled pecans. Lwt [Internet]. 2021;145(March):111298. Available from: https://doi.org/10.1016/j.lwt.2021.111298
- Domínguez-Avila JA, Alvarez-Parrilla E, López-Díaz JA, Maldonado-Mendoza IE, Gómez-García MDC, De La Rosa LA. The pecan nut (Carya illinoinensis) and its oil and polyphenolic fractions differentially modulate lipid metabolism and the antioxidant enzyme activities in rats fed high-fat diets. Food Chem. 2015;168:529–37.
- Tanwar B, Modgil R, Goyal A. Nutritional and phytochemical composition of pecan nut [Carya illinoinensis (Wangenh.) K. Koch] and its hypocholesterolemic effect in an animal model. Br Food J. 2021;123(4):1433–48.
- Guarneiri LL, Paton CM, Cooper JA. Pecan-enriched diets decrease postprandial lipid peroxidation and increase total antioxidant capacity in adults at-risk for cardiovascular disease. Nutr Res [Internet]. 2021;93:69–78. Available from: https://doi.org/10.1016/j.nutres.2021.07.004
- Wu X, Beecher GR, Holden JM, Haytowitz DB, Gebhardt SE, Prior RL. Lipophilic and hydrophilic antioxidant capacities of common foods in the United States. J Agric Food Chem. 2004;52(12):4026–37.
- Khoddami A, Wilkes MA, Roberts TH. Techniques for analysis of plant phenolic compounds. Molecules. 2013;18(2):2328–75.
- Stromsnes K, Correas AG, Lehmann J, Gambini J, Olaso‐gonzalez G. Anti‐inflammatory properties of diet: Role in healthy aging. Biomedicines. 2021;9(8):1–28.
- De La Rosa LA, Alvarez-Parrilla E, Shahidi F. Phenolic compounds and antioxidant activity of kernels and shells of Mexican pecan (Carya illinoinensis). J Agric Food Chem. 2011;59(1):152–62.
- Jia X, Luo H, Xu M, Wang G, Xuan J, Guo Z. Investigation of nut qualities of pecan cultivars grown in China. J Plant Sci. 2019;7(5):117–24.
- Jia X, Luo H, Xu M, Zhai M, Guo Z, Qiao Y, et al. Dynamic changes in phenolics and antioxidant capacity during pecan (Carya illinoinensis) kernel ripening and its phenolics profiles. Molecules. 2018;23(2).
- Ribeiro SR, Klein B, Ribeiro QM, Santos ID dos, Genro ALG, Ferreira DDF, et al. Chemical composition and oxidative stability of eleven pecan cultivars produced in southern Brazil. Food Res Int [Internet]. 2020;136(August):109596. Available from: https://doi.org/10.1016/j.foodres.2020.109596
- Juhaimi F Al, Özcan MM, Uslu N, Doğu S. Pecan walnut (Carya illinoinensis (Wangenh.) K. Koch) oil quality and phenolic compounds as affected by microwave and conventional roasting. J Food Sci Technol. 2017;54(13):4436–41.
- Bodoira R, Maestri D. Phenolic Compounds from Nuts: Extraction, Chemical Profiles, and Bioactivity. J Agric Food Chem. 2020;68(4):927–42.
- Salminen JP, Karonen M, Sinkkonen J. Chemical ecology of tannins: Recent developments in tannin chemistry reveal new structures and structure-activity patterns. Chem – A Eur J. 2011;17(10):2806–16.
- Robbins KS, Gong Y, Wells ML, Greenspan P, Pegg RB. Reprint of “Investigation of the antioxidant capacity and phenolic constituents of U.S. pecans.” J Funct Foods [Internet]. 2015;18:1002–13. Available from: http://dx.doi.org/10.1016/j.jff.2015.05.026
- Gong Y, Pegg RB. Separation of Ellagitannin-Rich Phenolics from U.S. Pecans and Chinese Hickory Nuts Using Fused-Core HPLC Columns and Their Characterization. J Agric Food Chem. 2017;65(28):5810–20.
- Bouali I, Tsafouros A, Ntanos E, Albouchi A, Boukhchina S, Roussos PA. Inter ‑ cultivar and temporal variation of phenolic compounds , antioxidant activity and carbohydrate composition of pecan ( Carya illlinoinensis ) kernels grown in Tunisia. Hortic Environ Biotechnol [Internet]. 2020;61(1):183–96. Available from: https://doi.org/10.1007/s13580-019-00188-8
- Rodrigues NP, Pechina BDR, Sarkis JR. A comprehensive approach to pecan nut valorization: Extraction and characterization of soluble and insoluble-bound phenolics. JAOCS, J Am Oil Chem Soc. 2022;(July):1–12.
- Villarreal-Lozoya JE, Lombardini L, Cisneros-Zevallos L. Phytochemical constituents and antioxidant capacity of different pecan [Carya illinoinensis (Wangenh.) K. Koch] cultivars. Food Chem. 2007;102(4):1241–9.
- Kureck I, Policarpi P de B, Toaldo IM, Maciel MV de OB, Bordignon-Luiz MT, Barreto PLM, et al. Chemical Characterization and Release of Polyphenols from Pecan Nut Shell [Carya illinoinensis (Wangenh) C. Koch] in Zein Microparticles for Bioactive Applications. Plant Foods Hum Nutr. 2018;73(2):137–45.
- Gong Y, Pegg RB, Kerrihard AL, Lewis BE, Cruces L, Heerema RJ. Pecan Kernel Phenolics Content and Antioxidant Capacity Are Enhanced by Mechanical Pruning and Higher Fruit Position in the Tree Canopy. 2020;145(3):193–202.
- Labuckas D, Maestri D, Lamarque A. Molecular characterization, antioxidant and protein solubility-related properties of polyphenolic compounds from walnut (Juglans regia). Nat Prod Commun. 2016;11(5):637–40.
- Hudthagosol C, Haddad EH, McCarthy K, Wang P, Oda K, Sabaté J. Pecans acutely increase plasma postprandial antioxidant capacity and catechins and decrease ldl oxidation in humans1-3. J Nutr. 2011;141(1):56–62.
- Larrosa M, García-Conesa MT, Espín JC, Tomás-Barberán FA. Ellagitannins, ellagic acid and vascular health. Mol Aspects Med [Internet]. 2010;31(6):513–39. Available from: http://dx.doi.org/10.1016/j.mam.2010.09.005
- Ros E, Izquierdo-Pulido M, Sala-Vila A. Beneficial effects of walnut consumption on human health: Role of micronutrients. Curr Opin Clin Nutr Metab Care. 2018;21(6):498–504.
- Kahkeshani N, Farzaei F, Fotouhi M, Alavi SS, Bahramsoltani R, Naseri R, et al. Pharmacological effects of gallic acid in health and disease: A mechanistic review. Iran J Basic Med Sci. 2019;22(3):225–37.
- Yang H, Tuo X, Wang L, Tundis R, Portillo MP, Simal-Gandara J, et al. Bioactive procyanidins from dietary sources: The relationship between bioactivity and polymerization degree. Trends Food Sci Technol [Internet]. 2021;111:114–27. Available from: https://doi.org/10.1016/j.tifs.2021.02.063
- Prakash M, Basavaraj B V., Chidambara Murthy KN. Biological functions of epicatechin: Plant cell to human cell health. J Funct Foods [Internet]. 2019;52(October 2018):14–24. Available from: https://doi.org/10.1016/j.jff.2018.10.021
Tag:CBPAV