
AMIDO – UMA ABORDAGEM ACERCA DA COMPOSIÇÃO, ESTRUTURA, PROPRIEDADES, MODIFICAÇÃO E APLICAÇÃO
Capítulo de livro publicado no livro do II Congresso Brasileiro de Produção Animal e Vegetal: “Produção Animal e Vegetal: Inovações e Atualidades – Vol. 2“. Para acessá-lo clique aqui.
DOI: https://doi.org/10.53934/9786585062039-79
Este trabalho foi escrito por:
Poliana Sander Ferreira1*; Eveline Lopes Almeida1
1Planta Piloto de Cereais, Raízes e Tubérculos, Escola de Química, Centro de Tecnologia, Universidade Federal do Rio de Janeiro, Cidade Universitária, Rio de Janeiro RJ, Brasil
*Autor correspondente (Corresponding author) – Email:[email protected]
Resumo: O amido, um polissacarídeo de reserva das plantas, é um importante ingrediente para as indústrias alimentícias e não-alimentícias. A ampla aplicação industrial do amido é devido ao seu baixo custo, biodegradabilidade, renovabilidade e fácil disponibilidade. Portanto, compreender a sua composição química, estrutura molecular e granular, bem como suas propriedades físico-químicas, contribuem para o processamento e direcionamento do amido em uma variedade de propósitos, tais como substituição ao glúten, agente gelificante, espessante, estabilizante, encapsulante, entre outros. Amidos em sua forma nativa apresentam características indesejáveis, como instabilidade térmica e tendência a retrogradação, que os tornam impróprios para a maioria das aplicações. Portanto, os amidos são comumente submetidos à processos de modificações para melhorar suas características positivas e/ou diminuir suas limitações tecnológicas. Deste modo, esta revisão fundamenta o conhecimento existente na literatura sobre a estrutura do amido, integra aspectos de sua composição e propriedades físico-químicas, bem como referencia os métodos de modificação aplicáveis para melhorar e/ou aumentar as aplicações tecnológicas dos amidos dentro do setor alimentício.
Palavras–chave: alimento; amilose; amilopectina; gelatinização; retrogradação
Abstract: Starch, a plant reserve polysaccharide, is an essential ingredient for the food and non-food industries. The extensive industrial application of starch is due to its low cost, biodegradability, renewability, and easy availability. Therefore, understanding its chemical composition, molecular and granular structure, and physicochemical properties contribute to the processing and targeting of starch for various purposes, such as gluten replacement, gelling agent, thickener, stabilizer, and encapsulant, among others. Starches in their native form have undesirable characteristics, such as thermal instability and a tendency to retrograde, which make them unsuitable for most applications. Therefore, starches are commonly subjected to modification processes to improve their positive characteristics and/or reduce technological limitations. Thus, this review bases the existing knowledge in the literature on starch structure; it integrates aspects of its composition and physicochemical properties and references applicable modification methods to improve and/or increase the starch technological applications within the food sector.
Key Word: foods; amylose; amylopectin; gelatinization; retrogradation
INTRODUÇÃO
O amido é encontrado amplamente na natureza e é a fonte de energia mais importante para a nutrição humana (1). Consiste na reserva de carboidratos mais abundante nos vegetais, sendo comumente utilizado pelas plantas como fonte de carbono e energia. Comumente, este polissacarídeo é armazenado nos amiloplastos de órgãos reprodutivos (grãos), vegetativos (tubérculos, raízes, caules, folhas), frutos (banana, lobeira e outros) e raízes (mandioca). A partir dessas fontes o amido comercial é obtido (2–4).
O amido é uma matéria-prima mundialmente importante devido a sua vasta disponibilidade e multifuncionalidade atribuídas as suas diversas funções tecnológicas. Pode ser aplicado na formulação de rações, medicamentos, cosméticos, plásticos, adesivos, tintas, etc. Contudo, a indústria alimentícia é o setor que mais utiliza amido (em torno de 60%), aplicando-o como ingrediente funcional em uma ampla variedade de alimentos, e para uma variedade de propósitos, tais como substituição ao glúten, agente gelificante, espessante, estabilizante, vitrificante, encapsulante, entre outros (4–6).
Amidos de milho, batata e mandioca são amidos comerciais amplamente utilizados na indústria. Por sua vez, amidos não-convencionais apresentam potencial de serem complementares aos amidos comerciais para diferentes aplicações e podem apresentar como vantagem a produção sustentável, valorização de resíduos e subprodutos, disponibilidade local, viabilidade tecnológica, significado cultural e a produção de alimentos especiais (7). Para tanto, é essencial compreender a relação entre a estrutura do amido e suas propriedades para a escolha do ingrediente com a funcionalidade desejável para a aplicação pretendida (8). Logo, o objetivo desta revisão é compreender os componentes e estrutura do amido e a relação com suas propriedades físicas, como gelatinização, formação de pasta, gelificação e retrogradação, as quais apresentam grande importância nutricional e tecnológica quando direcionado a alguma aplicação.
COMPOSIÇÃO DO AMIDO
O amido distingue-se dos demais carboidratos por ocorrer na natureza em partículas denominadas grânulos (9). A maioria dos grânulos de amido de ocorrência natural, independentemente da fonte vegetal ou tecido, é composto majoritariamente (cerca de 98% em base seca) por dois homopolissacarídeos – amilose e amilopectina. A fração remanescente do grânulo é composta por compostos intermediários e constituintes traços e/ou contaminantes, tais como lipídios, minerais e proteínas (2,4,5,10,11). Na sequência é discutido sobre cada um desses constituintes.
AMILOSE
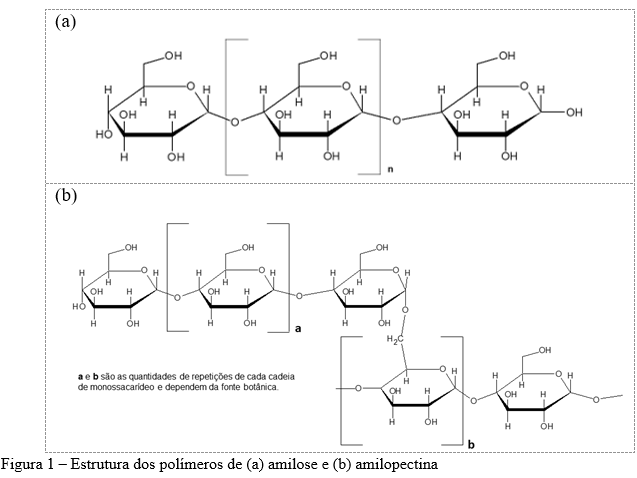
A amilose é um polímero essencialmente linear formada por unidades de α-D-glicopiranosil unidas por ligações glicosídicas (1→4) (Figura 1a), contendo poucas ramificações conectadas por ligações α-D-(1→6), cerca de 0,3-0,5% do total de ligações. O grau de polimerização (DP) da amilose é maior que 600 (podendo chegar a 18.000) e apresenta peso molecular médio na ordem de 105 a 106 Da. Tais variações podem ser originárias das diferentes fontes botânicas, bem como devido ao grau de maturação, isto quando dentro de uma mesma espécie. De modo geral, a amilose constitui de 20 a 30% da maioria dos grânulos de amido nativos, podendo atingir 70% da composição de amidos com alto teor de amilose (3,5,6,10–12). A função da amilose é desconhecida. Possivelmente, ela contribui para o empacotamento das moléculas de glucano dentro da matriz de amilopectina em regiões amorfas menos densas (13).
AMILOPECTINA
A amilopectina também apresenta cadeias formadas por moléculas de glicose unidas por ligações α-D-(1→4). No entanto, a amilopectina se diferencia da amilose por ser um polissacarídeo altamente ramificado – entre 4 e 5% do total de ligações. Estas ramificações podem ser formadas por cadeias poliméricas curtas (12 < DP < 20), longas (30 < DP < 45) e muito longas (DP médio > 60) ligadas a cadeia principal por ligações α-D-(1→6). Portanto, o polímero de amilopectina apresenta elevado peso molecular, entre 50–500 x 106 Da, e consiste no principal polissacarídeo da maioria dos amidos: entre 70-75% dos amidos nativos e 98-99% para os amidos denominado cerosos (3,5,6,9,10).
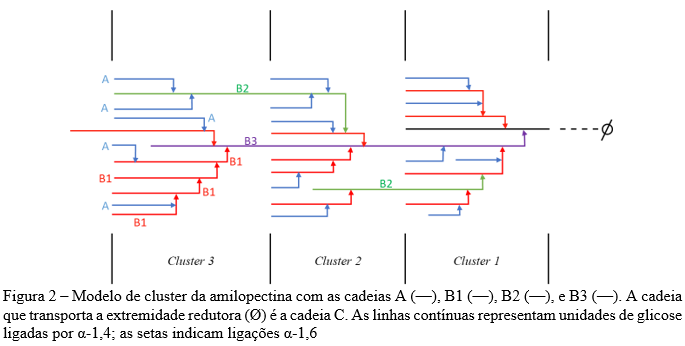
A respeito da arquitetura interna da amilopectina, o modelo de backbone é uma teoria recente e se opõe ao modelo tradicional de clusters. No modelo de backbone, a arquitetura interna da amilopectina é caracterizada como cadeias internas em uma espinha segmentada do tipo linear com ramificações contendo cadeias externas formando duplas hélices vindo em um plano perpendicular (14).
No modelo de clusters (Figura 2), o polímero de amilopectina é composto por três tipos de ramificações (A, B e C). As cadeias A apresentam o final redutor conectado à uma cadeia B ou C por intermédio de ligações α-(1→6) e não são ramificadas. As cadeias B são aquelas conectadas à uma cadeia C ou à uma outra cadeia B por meio de uma ligação α-(1→6) e possuem uma ou mais cadeias A ou B ligadas a elas por meio de ligações α-(1→6) (ou seja, são ramificadas). Cadeias B1 estão localizadas em um único cluster; as cadeias B2 e B3 são mais longas, estendendo-se a dois, três ou mais clusters, respectivamente. As cadeias C são aquelas que apresentam um grupo terminal redutor (ø) e várias ramificações (cadeias B). De forma resumida, cada uma das cadeias das moléculas de amilopectina tem a mesma conformação de α-hélice direita encontrada nas moléculas de amilose; no entanto, as cadeias B e C têm monômeros de glicose conectados por ligações α-D-(1→4) e ligações α-D-(1→6) nos pontos de ramificação (3,8,10,11).
MATERIAL INTERMEDIÁRIO
Além da amilose e da amilopectina, grânulos de amido também podem conter um terceiro componente de poliglucano denominados “material intermediário” (13,15). Sugestivamente, esses componentes são conhecidos desta forma por possuírem grau de ramificação e massa molar intermediários aos da amilose e a amilopectina (16). De maneira resumida, materiais intermediários são um material polimérico formado por ligações glicosídicas entre monômeros de glicose, com estrutura ramificada semelhante à amilopectina e comprimento da cadeia de amilose (17), exibindo propriedades distintas tanto da amilose quanto da amilopectina (4).
Em termos de disponibilidade, são mais facilmente encontrados em grânulos de amido com alto teor de amilose, principalmente de batata, cevada e milho, aveia, trigo e centeio. Ressaltasse que a estrutura desses materiais varia amplamente com a fonte de amido e com a sua síntese (13). Estima-se que esses componentes se originem de clusters imaturos formados por enzimas responsáveis pela formação da amilose em sinergismo com enzimas de ramificação e desramificação do amido; resultando na clivagem da cadeia de amilose e na transferência de cadeias para uma molécula de amilopectina. No entanto, este fenômeno ainda não foi confirmado experimentalmente (17)
LIPÍDIOS
Amidos de tubérculos (batata) e raízes (mandioca) contêm uma porcentagem muito pequena de lipídios (cerca de 0,1%), em comparação com amidos de cereais (milho, trigo, arroz, sorgo), que contêm 0,8 a 1,0% de lipídios (2). No caso dos cereais, os lipídios podem estar presentes no interior dos grânulos de amido, na forma de lisofosfolipídeos e ácidos graxos livres; e/ou externos ao grânulo de amido, na forma de triglicerídeos, fosfolipídios e ácidos graxos livres, provenientes da membrana do amiloplasto (4). Devido aos efeitos do processamento na despolimerização do amido ou de forma natural, os ácidos graxos presentes no amido podem formar complexos estáveis com o carboidrato penetrando nas hélices terminais da amilose ou amilopectina (15). Amidos comerciais geralmente contêm menos de 1% de lipídios. Concentrações maiores normalmente são removidos por extração ou hidrólise (18).
PROTEÍNAS
O teor de proteína dos amidos varia de acordo com a sua fonte de obtenção (18). Amidos de tubérculos (batata) e raízes (tapioca) contêm uma pequena quantidade de proteínas (cerca de 0,1%) em comparação com os amidos de cereais (milho, trigo, milho ceroso), que contêm 0,2 a 0,4% de proteínas (2). A contaminação proteica dos amidos pode ser resíduos de armazenamento do endosperma preso à superfície dos grânulos, como também proteína proveniente de enzimas (responsáveis pela síntese e degradação do amido) aprisionadas dentro o grânulo (4,10). Se as condições forem tais que as enzimas se tornem ativas, isso certamente influenciará a funcionalidade do amido, especialmente no que tange a área de panificação (19).
Em linhas gerais, a presença residual de lipídios ou proteínas em amido apresentam como desvantagens a alta reatividade dos macronutrientes quanto as técnicas de modificação física, química ou biológica do amido. Nestes casos, as reações podem envolver o carboidrato ou ainda influenciar na formação de compostos tóxicos, geração de radicais livres, reações de Maillard, comprometer as enzimas amilolíticas e/ou alterar na reticulação de proteínas (15).
MINERAIS
Amidos contém pequena quantidade de minerais e sais inorgânicos, o qual varia de acordo com a fonte de obtenção e região do mundo onde foram produzidos (18). Os teores de cinzas dos amidos geralmente variam entre 0,1% e 0,5% (10), o qual é representado principalmente pelo fósforo (fosfolipídios, monoésteres e fosfato inorgânico) (4). Grupos fosfato aniônicos causam repulsão mútua localizada das cadeias de glucanas, levando à instabilidade estrutural, tornando a estrutura propensa à ação amilolítica (13). Tecnologicamente, a presença de íons em sistemas amiláceos aquosos, seja com carga positiva ou negativa, pode afetar o desempenho em termos de finalidades gelificantes (15).
ESTRUTURA GRANULAR
Os grânulos de amido são frequentemente descritos de acordo com suas características: forma, tamanho, polimorfismo e cristalinidade. Essas características estão altamente relacionadas a uma série de fatores, como origem botânica, condições de crescimento e fisiologia da planta; e são determinantes nas propriedades físicas dos amidos (8,11,20).
ASPECTOS MORFOLÓGICOS
O amido nativo ocorre na forma de grânulos com várias formas e tamanhos (21), características estas que dependem da bioquímica do cloroplasto ou amiloplasto em que o amido é formado, bem como da fisiologia da planta (22). Formas comuns de grânulos de amido nativo incluem esfera, elipsoide, polígono, oval, lenticular e túbulo irregular. Quanto ao tamanho, os grânulos podem variar entre <1-100 μm de diâmetro, com variadas distribuições de tamanho de partícula (unimodal, bimodal, trimodal) (Figura 3a). Estas características estão altamente relacionadas a algumas de suas propriedades funcionais, como inchamento, solubilidade e suscetibilidade enzimática (4,11,19).
Diferentes técnicas microscópicas podem ser empregadas para analisar a morfologia dos grânulos de amido, são elas: microscopia eletrônica de varredura (MEV), microscopia de luz e de luz polarizada, microscopia de força atômica, microscopia eletrônica de transmissão, e microscopia confocal de varredura a laser (21). Por microscopia eletrônica de varredura ou por microscopia de luz é possível verificar a forma e a dimensão dos grânulos de amido, bem como obter imagens de sua superfície – geralmente lisa e sem características, exceto pela composição de sulcos e fissuras (19,21). Sob microscopia de luz polarizada, grânulos de amido nativo exibem birrefringência que aparece como uma cruz de Malta característica, oriunda do arranjo radial e ordenado dos cristalitos dentro dos grânulos (23). Microscopia eletrônica de transmissão é aplicável ao estudo da morfologia interna dos grânulos, como tamanho e forma das lamelas cristalinas (24). Microscopia de força atômica é uma técnica de imagem de alta resolução que permite visualizar e dimensionar a rugosidade da superfície dos grânulos de amido, sendo a sua topografia dependente da fonte botânica (25–27). A microscopia confocal de varredura a laser é amplamente utilizada em estudo das características morfológicas de grânulos de amido, incluindo cavidades, anéis de crescimento, canais, sulcos equatoriais, distribuição de amilose, grupos de proteína e fosfato (21).
ESTRUTURA E POLIMORFISMO
Os amidos são constituídos por uma hierarquia de elementos estruturais complexos, desde lamelas e regiões amorfas até blocos, anéis de crescimento e grânulos, que aumentam em escala de nanômetros a mícrons (21,23). As moléculas de amilose e amilopectina são sintetizadas radialmente e simultaneamente ao crescimento de um grânulo de amido, com seus respectivos grupos redutores terminais (ø) orientados para a região central, denominada hilo, a qual é considerada o ponto inicial de crescimento do grânulo (Figura 3b) (4,8,10,13).
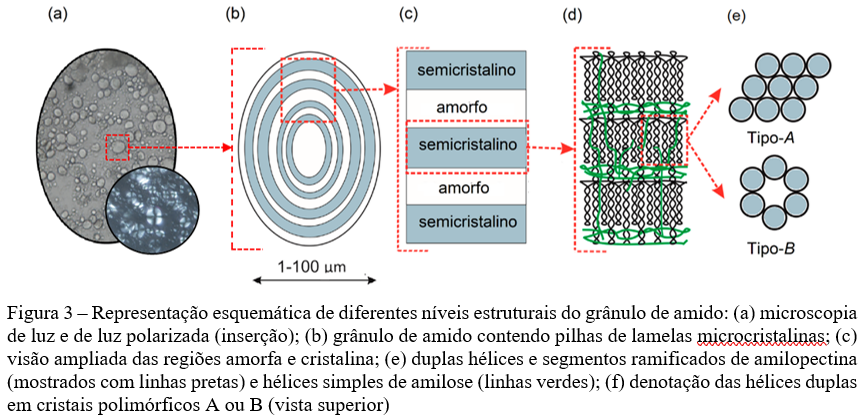
Na organização granular, cadeias adjacentes de amilopectina se associam de modo a formar uma estrutura lamelar composta por regiões semicristalinas, ordenadas e empacotadas, contínuas e conectadas por ligações covalentes às regiões amorfas, alternadas a uma distância de repetição de 9-10 nm (Figura 3c) (8–10). Este arranjo radial e ordenado de moléculas de amilopectina tornam os grânulos anisotrópicos e, portanto, birrefringentes, o que é evidenciado pelo cruzamento de polarização (Cruz de Malta) visto quando os grânulos são examinados usando luz plana polarizada (inserção apresentada na Figura 3a), de modo que o centro da cruz está no hilo (4,9,10).
A cristalinidade dos grânulos de amido é relativamente baixa, na faixa de 15% a 45%, e aumenta com a proporção de amilopectina no amido (19). Por ora, é válido afirmar que a amilopectina é o componente mais importante dos amidos em termos de estrutura e funcionalidade, pois sozinha ela é suficiente para a formação o grânulo. Por outro lado, presume-se que a amilose esteja localizada entre as cadeias da amilopectina e aleatoriamente intercalada entre as regiões amorfas e cristalinas (Figura 3d) (12).
Diversos métodos analíticos podem ser empregados na avaliação da estrutura ordenada de grânulos de amido. Neste sentido, espectroscopias de infravermelho por transformada de Fourier, Raman e ressonância magnética nuclear são técnicas de curto alcance, enquanto a técnica de difração de raios-X se enquadra como uma técnica de alto alcance (21). A respeito desta última técnica, quatro padrões distintos de difração podem ser obtidos; A, B, C e V. O padrão A é obtido para amidos de cereais (exceto variedades com alto teor de amilose); o padrão B é comum para amidos radiculares e tubulares (e para variedades com alto teor de amilose), bem como para amido retrogradado (19).
As diferenças entre esses dois polimorfos surgem do teor de água e da forma de empacotamento das suas duplas hélices (28). Amido com polimorfismo tipo-A possui uma célula unitária monoclínica, duplas hélice de amilopectina relativamente compactas e baixo teor de água. Por outro lado, as duplas hélices de amidos tipo-B têm uma estrutura menos empacotada, alto teor de água e é formado por célula unitária hexagonal (Figura 3e). O polimorfo C consiste em um padrão intermediário dos polimorfismos A e B (8,11). Em relação ao padrão V, este pode ser encontrado em amidos que apresentam amilose complexada com moléculas de ácidos graxos (também encontrado em amidos nativos), emulsificantes, butanol e iodo (29).
PROPRIEDADES FÍSICO-QUÍMICAS
Amidos de diferentes fontes botânicas possuem diversas propriedades funcionais e, portanto, têm aplicações versáteis na indústria alimentícia. Essas amplas aplicações são resultantes da transformação de grânulos de amido nativo semicristalinos para o estado amorfo (gelatinização), para gerar uma pasta após a absorção de água e desenvolver viscosidade (formação de pasta), desenvolvendo um gel após a formação da rede (gelificação), recristalizando e formando um estado insolúvel e agregado (retrogradação) (8). Na sequência será discutido acerca dessas características de amidos nativos nestas diferentes fases de transformação.
GELATINIZAÇÃO
Grânulos de amido são construídos a partir de polímeros hidrofílicos. Contudo, o próprio grânulo de amido nativo não é solúvel em água fria devido à estrutura semicristalina do grânulo e às ligações de hidrogênio formadas entre grupos hidroxila (19). Quando suspendidos em excesso de água à temperatura ambiente, grânulos de amido nativo são capazes de absorver umidade (até 30% m/m). Esta umidade é majoritariamente distribuída na região amorfa dos grânulos e pode ser removida por processo de secagem, sem alterar a estrutura original do grânulo (8–10).
Em contrapartida, quando grânulos de amido, em excesso de água, são aquecidos a uma temperatura específica, ocorre o intumescimento granular além do inchaço reversível. Neste caso, ocorre o rompimento das ligações de hidrogênio nas regiões amorfas e a ruptura da ordem molecular no interior dos grânulos acarretando na perda da birrefringência (visualizada pela redução da evidencia da Cruz de Malta). À medida que a temperatura continua a aumentar, o inchamento granular, que teve seu início próximo ao hilo, evolui para a periferia, até a ocorrência da ruptura total dos grânulos. Essa transição térmica, denominada gelatinização, é uma característica exclusiva dos amidos e consiste em um processo irreversível, isto é, a secagem do amido gelatinizado resultará em grânulos amorfos, diferente da estrutura inicial (semicristalina) (5,6,9,10,19,22).
A temperatura na qual os grânulos de amido perdem a estrutura semicristalina é conhecida como temperatura de gelatinização (8). Esse parâmetro físico, assim como a entalpia de gelatinização do amido, podem ser quantificadas por calorimetria de varredura diferencial (do inglês, differential scanning calorimetry – DSC) durante o aquecimento em excesso de água (11). As propriedades de gelatinização (temperaturas e entalpia) podem variar conforme o método de medição, proporção amido-água, pH, presença ou ausência de um sal inibidor ou promotor do inchaço, concentração do sal, ou da presença e concentração de um soluto, como a sacarose (10,11).
Os parâmetros de gelatinização são mais fortemente influenciados pelo tipo de amido, sendo controlados por características derivadas da estrutura molecular da amilopectina (comprimento de cadeia, extensão de ramificação, peso molecular), composição do amido (proporção amilose: amilopectina e teor de fósforo) e arquitetura granular (proporção de regiões cristalinas e amorfas) (22). Em geral, a temperatura de gelatinização aumenta com o aumento do comprimento da cadeia ramificada da amilopectina, uma vez que estas formam a região ordenada e compactada dos grânulos de amido. A maioria dos amidos apresentam temperaturas de gelatinização entre 55 e 80 °C, podendo chegar até a 130 °C no caso de amidos cerosos, devido à maior cristalinidade porcentual da amilopectina (30).
Além da energia térmica, excesso de água também é fundamental para a ocorrência do fenômeno de gelatinização, uma vez que a água atua como um agente plastificante volátil. A presença de água diminuirá a temperatura de transição vítrea (Tg) e, consequentemente, a temperatura de fusão dos cristalitos (19). Plastificantes não voláteis, como polióis (glicerol, glicol e sorbitol), compostos contendo nitrogênio (ureia, derivados de amônio e aminas), açúcares e ácido cítrico também são aplicáveis para melhorar a processabilidade do amido (6). Por fim, a perda de estrutura cristalina dentro do grânulo de amido pode resultar em muitas mudanças em suas propriedades funcionais, incluindo inchamento, formação de pasta e birrefringência (11).
PROPRIEDADES DE PASTA
A gelatinização do amido é seguida por um processo de formação de pasta. Grânulos de amido gelatinizados e inchados são bastante frágeis e facilmente rompidos. Portanto, o aquecimento contínuo desses grânulos, em excesso de água e sob ação cisalhante, resulta na formação de uma massa viscosa, denominada pasta de amido. Resumidamente, a pasta é constituída por uma fase contínua (uma dispersão/solução molecular) de moléculas de polímero de amido inchado, componentes solúveis lixiviados (principalmente amilose), fragmentos de grânulos (grãos fantasmas e outros remanescentes) e moléculas retrogradadas (a ser discutido posteriormente) (8–10).
No processamento normal de alimentos envolvendo calor e umidade, a maioria dos grânulos de amido sofre gelatinização e formação de pasta. Isto porque à medida que a temperatura de uma suspensão formada por amido e água aumenta, as moléculas dentro dos grânulos vibram e torcem tão violentamente que as ligações de hidrogênio intermoleculares são hidrolisadas, permitindo maior penetração das moléculas de água entre as cadeias de polissacarídeo. Como resultado, as ligações de hidrogênio intermoleculares entre as cadeias são substituídas por ligações de hidrogênio com as moléculas de água, produzindo uma hidratação mais extensa. Por consequência, as moléculas de amido ficam envoltas por moléculas de água que as plastificam e permitem que elas se movam mais livremente e se separem mais umas das outras, causando o inchaço irreversível dos grânulos em várias vezes o seu tamanho original (10).
O comportamento de cozimento de diferentes pastas de amidos pode ser comparado usando um amilógrafo, como Rapid Visco Analyzer (RVA) e Brabender Amylograph. Ambos os equipamentos registram a mudança na viscosidade sob baixas taxas de cisalhamento em função da temperatura (8,10). Muitos fatores podem afetar as propriedades de pasta do amido, incluindo tamanho de partícula, presença de impurezas e teor de amilose. Diferentes metodologias e parâmetros experimentais, como pH, concentração da pasta, temperaturas e taxas de cisalhamento também podem afetar os resultados das propriedades da pasta (11).
GELIFICAÇÃO E RETROGRADAÇÃO
Após a gelatinização e à medida que uma pasta de amido é resfriada, as moléculas de amilose e amilopectina iniciam uma etapa de reassociação, migrando do estado amorfo (causado pela gelatinização do amido) para um estado mais ordenado ou semicristalino. Como consequência é observado o aumento da opacidade e a formação de precipitado insolúvel (no caso de soluções diluídas) ou de um gel viscoelástico firme, resultado da formação de redes/zonas de associação em uma tentativa das moléculas dos polímeros de amido formar cristais organizados. O processo coletivo, pelo qual as moléculas em solução se tornam menos solúveis é denominado retrogradação e ocorre porque o amido gelatinizado não está em equilíbrio termodinâmico. Esse fenômeno ocorre especialmente em amidos nativos (9,10,19,31) e geralmente é acompanhado por liberação de água, fenômeno denominado sinérese (4,8).
A firmeza do gel obtido como resultado final da retrogradação depende da extensão da formação da zona de junção, a qual é influenciada pela quantidade de água presente no meio, temperatura, concentração de amido e pela presença de outros componentes como lipídios, proteínas, açúcares, sais, ácidos e surfactantes. Ainda, a taxa e a extensão da retrogradação dos amidos estão associadas a fatores como a estrutura das moléculas de amilose e amilopectina, bem como pela razão entre esses polissacarídeos no grânulo. Este último fator é um dos mais importantes para a retrogradação, uma vez que esse fenômeno é resultado da cristalização, ou seja, da formação e agregação subsequente de duplas hélices dos polímeros de amilose e amilopectina (9–11).
Em linhas gerais, a força de um gel de amido aumenta com o seu teor de amilose. Isto porque as moléculas lineares de amilose podem formar zonas de junção longas e fortes na rede de gel. Amidos nativos de cereais e leguminosas, como milho, trigo, arroz e ervilha, são conhecidos por reterem grânulos rígidos e inchados e, por consequência desenvolvem géis fortes; contudo, apresentam maior tendência a retrogradação. Em contraste, amidos cerosos, amido de batata e amido de tapioca produzem pastas mais viscosas, não formam gel ou apenas formam géis fracos (pois tendem a inchar e se dispersar livremente após o cozimento, resultado da ausência de amilose e de lipídios endógenos para formar complexos de amilose-lipídio) e apresentam baixa tendência à retrogradação. Amidos com maiores teores de amilose tendem a gerar géis mais firmes e apresentam alta resistência à quebra por enzimas digestivas, alta tendência à retrogradação e formação de complexos de amilose-lipídio (5,8–10).
De modo geral, a cinética de retrogradação do amido é dividida em dois processos distintos. O processo de retrogradação inicial está relacionado à perda da rede de amilose, quando duplas hélices são formadas a partir de segmentos de cadeia, seguida de agregação hélice-hélice. Deste modo, é válido afirmar que a amilose é responsável por alterações de curto prazo (menos de um dia) no processo de retrogradação. Por outro lado, o polímero de amilopectina apresenta duplas hélices mais curtas, atribuídas pelas restrições impostas por sua estrutura ramificada e pelo comprimento dessas ramificações. Essas duplas hélices se agregam, podendo resultar em redes tridimensionais com água incorporada. Portanto, a retrogradação da amilopectina prossegue lentamente ao longo de várias semanas de armazenamento e contribui para as mudanças reológicas e estruturais a longo prazo. É válido salientar que em amidos nativos, a quantidade de amilopectina geralmente é maior do que a amilose; portanto, a maioria dos cristalitos formados durante a retrogradação do amido está relacionada à associação de cadeias de amilopectina (19,31).
A retrogradação pode ser mensurada pelas mesmas técnicas utilizadas para quantificar a gelatinização. Ademais, essa propriedade dos amidos é uma característica importante para a aplicação desse polissacarídeo, uma vez que as propriedades dos alimentos à base de amido, como viscosidade, digestibilidade, dureza e tempo de prateleira, são amplamente afetadas pelo fenômeno de retrogradação (11). Adicionalmente, diferentes métodos podem ser empregados para reduzir a taxa de retrogradação do amido em produtos alimentícios, incluindo a adição de derivados químicos ao amido, como hidroxipropilação e acetilação; armazenamento em temperatura abaixo da temperatura de transição vítrea acarretando na diminuição da mobilidade molecular do amido; adição de agentes complexantes (por exemplo, monoglicerídeos, lecitina e estearoil lactilato de sódio) para formar complexo helicoidal de inclusão com amilose e cadeias ramificadas longas de amilopectina; e hidrólise do amido por enzimas amilolíticas (por exemplo, α– e β-amilases) para reduzir o comprimento das cadeias de glucano (8).
MODIFICAÇÃO E APLICAÇÃO EM ALIMENTOS
Amidos são considerados a principal fonte de energia para alimentação humana (4). Os amidos comerciais, tradicionalmente provenientes de cereais como milho e trigo, são comumente aplicados para alterar a textura e aparência dos alimentos. De forma mais detalhada, nos alimentos o amido apresenta a capacidade de modificar características como adesividade, espessamento, vitrificação, estabilidade de emulsão, turvação, estabilidade de espuma, retenção de umidade, polvilhamento, expansão, crocância e gelificação (5). Desse modo, os amidos tradicionalmente fazem parte da composição de produtos de panificação (pães, tortas, biscoitos, etc.), produtos de confeitaria, molhos, sopas, maionese, sorvetes, bebidas, massas, pudins, entre outros (32).
Contudo, materiais produzidos a partir de amido nativo são caracterizados por baixa estabilidade ao calor, baixa solubilidade em água, alta temperatura de gelatinização, alta viscosidade e propriedades mecânicas ruins, devido ao seu alto grau de cristalinidade que propicia ao amido baixa reatividade (20). Essas propriedades do amido nativo não atendem aos requisitos de aplicações nutricionais e industriais (1). Em linhas gerais, as aplicações de amidos dentro da indústria alimentícia são expandidas após modificação do material amiláceo por métodos químicos, físicos e/ou enzimáticos (8,33,34).
A modificação química dos polímeros de amido é realizada por meio da inserção de grupo funcional (por exemplo: carboxil, acetil, hidroxipropil, amina, amida ou outros) à cadeia do amido. Os novos grupos funcionais alteram suas propriedades físico-químicas e funcionais, como os comportamentos de gelatinização, formação de pasta, gelificação e retrogradação. Amidos de grau alimentício são modificados quimicamente para melhorar a consistência da pasta, clareza e estabilidade durante resfriamento e congelamento. Algumas novas aplicações de amidos quimicamente modificados são como quelante, crioprotetor, auxiliar de secagem, substituto de gordura, carreador de sabor, precursor de sabor e cor (através de reações de Maillard) e substrato em fermentações (35).
As modificações físicas produzem mudanças nas propriedades do amido sem introduzirem nenhuma modificação química na estrutura molecular (além da clivagem limitada da ligação glicosídica (despolimerização) que resulta na diminuição do peso molecular médio) (36). No setor alimentício, um dos principais interesses na modificação física é a produção de amidos clean label (37). Segundo a RDC 259/2002, amidos modificados fisicamente podem ser classificados como ingredientes, ao invés de aditivos alimentares, e não precisam ser identificados nos rótulos dos alimentos como amido modificado (38), tornando-os aceitáveis como produtos naturais.
Comparado as modificações químicas, os tratamentos físicos são geralmente mais simples, apresentam menor custo e não produzem efluentes contendo sais, reagentes ou subprodutos de reagentes. Outro interesse é devido vários tratamentos físicos aumentarem o teor de amidos resistente e de digestão lenta (36). Essa abordagem possibilita a mudança de visão de muitos consumidores quanto aos alimentos ricos em amido, alterando-o de um ingrediente não saciante, calórico e não nutritivo para um alimento saciante e auxiliar no controle de peso (14).
No tratamento enzimático, as enzimas atuam de maneira específica ao substrato, apresentando como vantagens a eliminação de subprodutos indesejáveis, geração de amido com maior pureza, baixo custo e consistência de produtos de alta qualidade. Ademais, a modificação por enzimas também consiste em um importante método na fabricação de amidos clean label (37). Em linhas gerais, a modificação enzimática altera características como viscosidade, solubilidade e gelificação ampliando a aplicação dos amidos como ingrediente alimentício. Ademais, enzimas podem ser adicionadas para aumentar o teor de amido resistente, produzir malte e inspecionar o impacto da estrutura/tipo de amido na degradação do amido (34). Uma abordagem para a modificação enzimática do amido é projetar um amido com uma nova estrutura, na qual a massa molecular, a distribuição do comprimento da cadeia ramificada e a relação amilose/amilopectina possam ser alteradas por reações enzimáticas. Essas técnicas geralmente produzem amidos com propriedades físico-químicas alteradas e atributos estruturais modificados para diversas aplicações alimentícias (1).
De modo geral, prospecta-se o aumento da demanda de amido modificado na indústria de alimentos e bebidas, devido à sua natureza isenta de glúten. Além disso, a alta demanda por alimentos processados, o aumento do uso de adesivos de base biológica em várias aplicações industriais e o aumento do interesse no desenvolvimento de produtos à base de amido contribuirão para o crescimento do mercado de amido modificado (33).
CONCLUSÕES
O amido é um componente natural bastante simples no sentido de que é constituído apenas por unidades de glicose. Contudo, ele se torna complexo quando avaliado a nível molecular e granular. De fato, a composição e as características estruturais do amido, tais como composição, morfologia, estrutura interna e grau de cristalinidade, estão intimamente associadas as suas propriedades físicas, como gelatinização e retrogradação, e influenciam diretamente nos seus atributos funcionais. Portanto, na escolha da matéria-prima amilácea para uma dada aplicação tecnológica, seja ela alimentícia ou não, deve-se levar em consideração todos estes atributos, os quais por muitas vezes é derivativo das diferentes fontes botânicas e podem ser alterados ao submeter o material amiláceo à processos de modificação físicos, químicos e/ou enzimáticos.
REFERÊNCIAS
- Park SH, Na Y, Kim J, Kang SD, Park K-H. Properties and applications of starch modifying enzymes for use in the baking industry. Food Sci Biotechnol [Internet]. 2018;27(2):299–312. Available from: https://doi.org/10.1007/s10068-017-0261-5
- McDonagh P. Native, modified and clean label starches in foods and beverages. In: Baines D, Seal R, editors. Natural food additives, ingredients and flavourings. Cambrige: Woodhead Publishing; 2012. p. 162–75.
- Pérez S, Baldwin PM, Gallant DJ. Structural features of starch granules I. In: BeMiller JN, Whistle R, editors. Starch: Chemistry and Technology. 3rd ed. New York: Academic Press; 2009. p. 149–92.
- Schmiele M, Sampaio UM, Clerici MTPS. Basic principles: Composition and properties of starch. In: Clerici MTPS, Schmiele M, editors. Starches for food application. London: Academic Press; 2019. p. 1–22.
- Agama-Acevedo E, Flores-Silva PC, Bello-Perez LA. Cereal starch production for food applications. In: Clerici MTPS, Schmiele M, editors. Starches for food application. London: Academic Press; 2019. p. 71–102.
- Avérous LR, Halley PJ. Starch polymers: from the field to industrial products. In: Avérous LR, Halley PJ, editors. Starch polymers: From genetic engineering to green applications. 1st ed. Elsevier; 2014. p. 3–10.
- Zhu F. Underutilized and unconventional starches: Why should we care? Trends Food Sci Technol. 2020;100(April):363–73.
- Ai Y, Jane J-L. Understanding starch structure and functionality. In: Sjöö M, Nilsson L, editors. Starch in food: structure, function and applications. 2nd ed. Woodhead Publishing; 2018. p. 151–78.
- BeMiller JN, Huber KC. Carboidratos. In: Damodaran S, Parkin KL, Fennema OR, editors. Química de Alimentos de Fennema. 4th ed. Porto Alegre: Artmed; 2010. p. 75–130.
- BeMiller JN. Carbohydrate chemistry for food scientists. London: Woodhead Publishing; 2019. 427 p.
- Zhu F, Xie Q. Structure and physicochemical properties of starch. In: Sui Z, Kong X, editors. Physical Modifications of Starch. Singapore: Springer Nature; 2018. p. 1–14.
- Denardin CC, Silva LP da. Estrutura dos grânulos de amido e sua relação com propriedades físico-químicas. Ciência Rural. 2009;39(3):945–54.
- Tetlow IJ, Bertoft E. A review of starch biosynthesis in relation to the building block-backbone model. Int J Mol Sci. 2020;21(7001):1–37.
- Hamaker BR. Current and future challenges in starch research. Curr Opin Food Sci [Internet]. 2021;40:46–50. Available from: https://doi.org/10.1016/j.cofs.2021.01.003
- Medina-López SV, Zuluaga-Domínguez CM, Fernández-Trujillo JP, Hernández-Gómez MS. Nonconventional hydrocolloids’ technological and functional potential for food applications. Foods. 2022;11(401):1–33.
- Han W, Zhang B, Li J, Zhao S, Niu M, Jia C, et al. Understanding the fine structure of intermediate materials of maize starches. Food Chem [Internet]. 2017;233:450–6. Available from: http://dx.doi.org/10.1016/j.foodchem.2017.04.155
- Schmiele M, Sampaio UM, Clerici MTPS. Identification and analysis of starch. In: Clerici MTPS, Schmiele M, editors. Starches for food application: Chemical, Technological and Health Properties. London: Academic Press; 2019. p. 23–69.
- Luallen T. Utilizing starches in product development. In: Sjöö M, Nilsson L, editors. Starch in food: structure, function and applications. 2nd ed. Woodhead Publishing; 2018. p. 545–79.
- Eliasson A-C. Starch: Physicochemical and functional aspects. In: Eliasson A-C, editor. Carbohydrates in food. 3rd ed. Boca Raton: CRC Press; 2017. p. 479–577.
- Dome K, Podgorbunskikh E, Bychkov A, Lomovsky O. Changes in the crystallinity degree of starch having different types of crystal structure after mechanical pretreatment. Polymers (Basel). 2020;12(3):1–12.
- Xu H, Zhou J, Liu X, Yu J, Copeland L, Wang S. Methods for characterizing the structure of starch in relation to its applications: a comprehensive review. Crit Rev Food Sci Nutr [Internet]. 2021;1–18. Available from: https://doi.org/10.1080/10408398.2021.2007843
- Singh N, Singh J, Kaur L, Sodhi NS, Gill BS. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chem. 2003;81:219–31.
- Bertoft E. Understanding starch structure: recent progress. Agronomy. 2017;7(56):1–29.
- Wei C, Qin F, Zhou W, Yu H, Xu B, Chen C, et al. Granule structure and distribution of allomorphs in C-type high-amylose rice starch granule modified by antisense RNA inhibition of starch branching enzyme. J Agric Food Chem. 2010;58:11946–54.
- Baldwin PM, Adler J, Davies MC, Melia CD. High resolution imaging of starch granule surfaces by Atomic Force Microscopy. J Cereal Sci. 1998;27:255–65.
- Barrera GN, Calderón-domínguez G, Chanona-pérez J, Gutiérrez-lópez GF, León AE, Ribotta PD. Evaluation of the mechanical damage on wheat starch granules by SEM , ESEM , AFM and texture image analysis. Carbohydr Polym [Internet]. 2013;98(2):1449–57. Available from: http://dx.doi.org/10.1016/j.carbpol.2013.07.056
- Juszczak L, Fortuna T, Krok F. Non-contact atomic force microscopy of starch granules surface. Part I. Potato and tapioca starches. Starch/Stärke. 2003;55:1–7.
- Imberty A, Buleon A, Tran V, Pérez S. Recent advances in knowledge of starch structure. Starch. 1991;43(10):375–84.
- Wu C, Zhou X. The overview of functional starch. In: Jin Z, editor. Functional Starch and Applications in Food. Singapore: Springer; 2018. p. 1–26.
- Jane J, Chen YY, Lee LF, McPherson AE, Wong KS, Radosavljevic M, et al. Effects of amylopectin branch chain length and amylose content on the gelatinization and pasting properties of starch. Cereal Chem. 1999;76(5):629–37.
- Bao J. The functionality of rice starch. In: Eliasson A-C, editor. Starch in food: Structure, function and applications. Cambrige: Woodhead Publishing; 2004.
- Egharevba HO. Chemical properties of starch and its application in the food industry. In: Emeje, M, editor. London: IntechOpen; 2020.
- Amaraweera SM, Gunathilake C, Gunawardene OHP, Manamperi A, Fernando CAN, Kulatunga AK, et al. Development of starch-based materials using current modification techniques and their applications: A review. Molecules. 2021;26(6880):1–30.
- Punia S. Barley starch modifications: Physical, chemical and enzymatic – A review. Int J Biol Macromol [Internet]. 2020;144:578–85. Available from: https://doi.org/10.1016/j.ijbiomac.2019.12.088
- Chen Y-F, Kaur L, Singh J. Chemical Modification of Starch. In: Sjöö M, Nilsson L, editors. Starch in Food: Structure, Function and Applications. 2nd ed. Woodhead Publishing; 2018. p. 283–321.
- BeMiller JN. Physical Modification of Starch. In: Sjöö M, Nilsson L, editors. Starch in Food: Structure, Function and Applications. 2nd ed. Woodhead Publishing; 2018. p. 223–53.
- Park S, Kim Y-R. Clean label starch: production, physicochemical characteristics, and industrial applications. Food Sci Biotechnol [Internet]. 2021;30(1):1–17. Available from: https://doi.org/10.1007/s10068-020-00834-3
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução – RDC nº 259, de 20 de setembro de 2002. Regulamento Técnico sobre Rotulagem de Alimentos Embalados. Diário Oficial da União: seção 1, ano 139, n. 184, Brasília, DF, p. 33-34, 23 set. 2002.
Tag:CBPAV


